Automatisation du marquage des ADN pour lAnalyse Chromosomique



















- Slides: 39

Automatisation du marquage des ADN pour l’Analyse Chromosomique sur Puces à ADN (ACPA): validation de la station BRAVO au CHU de Lyon. Jessica MICHEL Laboratoire de Cytogénétique Constitutionnelle Groupement Hospitalier Est du CHU de Lyon le 10 Septembre 2014 1

La plateforme ACPA de Lyon • Depuis 2007 Déficiences intellectuelles isolées/syndromiques et syndromes malformatifs • Depuis 2011 Troubles du spectre autistique • Depuis 2013 Syndromes polymalformatifs en prénatal Lyon le 10 Septembre 2014 2

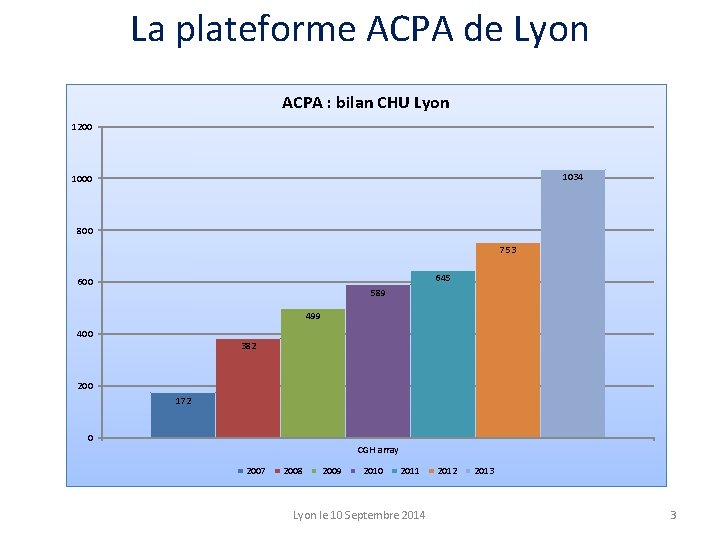
La plateforme ACPA de Lyon ACPA : bilan CHU Lyon 1200 1034 1000 800 753 645 600 589 499 400 382 200 172 0 CGH array 2007 2008 2009 2010 2011 Lyon le 10 Septembre 2014 2012 2013 3

La plateforme ACPA de Lyon Nécessité d’automatisation • Extraction ADN: Hamilton (en cours de validation) -> utilisation début 2015 • Technique ACPA : BRAVO Agilent • Interprétation résultats: - Agilent Cytogenomics - Cartagenia Lyon le 10 Septembre 2014 4

Agilent Bravo Automated Liquid Handling Platform Ø Préparation des ADN et pipetage Ø Peut traiter 48 patients en simultané Lyon le 10 Septembre 2014 Améliorations attendues: Ø Gain de temps. Ø Reproductibilité de la technique. Ø Qualité des résultats. Ø Risque d’erreur réduit. Ø Traçabilité. 6

Appareillages spécifiques Douchette codes à barres Thermocycleur Centrifugeuse compatible avec les plaques PCR 96 puits Scelleuse Thermique ( + films thermosensibles) 2 « Racks » pour microtubes 1. 5 m. L Lyon le 10 Septembre 2014 7

Consommables spécifiques Pour une série de 48 patients 5 Boites 96 pointes 250µL (Tips) 1 plaque « deep well 384 puits» réutilisable 1 seule fois 1 plaque purification 1 plaque « réservoir » réutilisable 1 plaque « poubelle » réutilisable Films protecteurs 3 Plaques PCR 96 puits 8

Préparation d’une technique Avant passage sur le BRAVO Lyon le 10 Septembre 2014 9

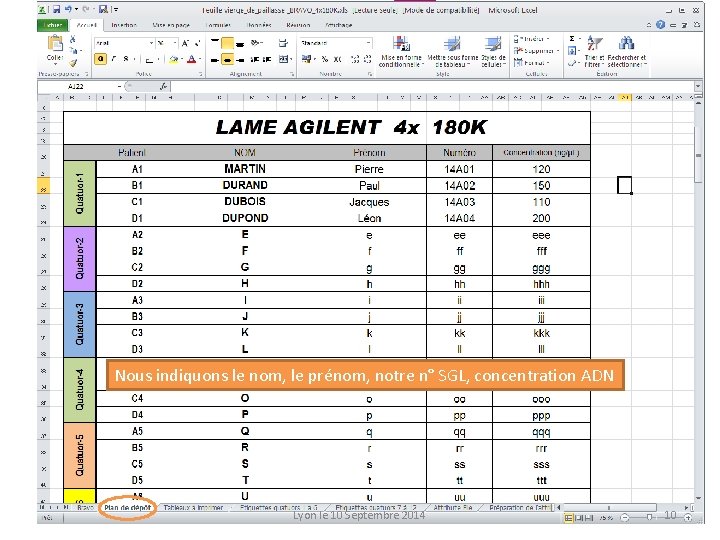
Nous indiquons le nom, le prénom, notre n° SGL, concentration ADN Lyon le 10 Septembre 2014 10

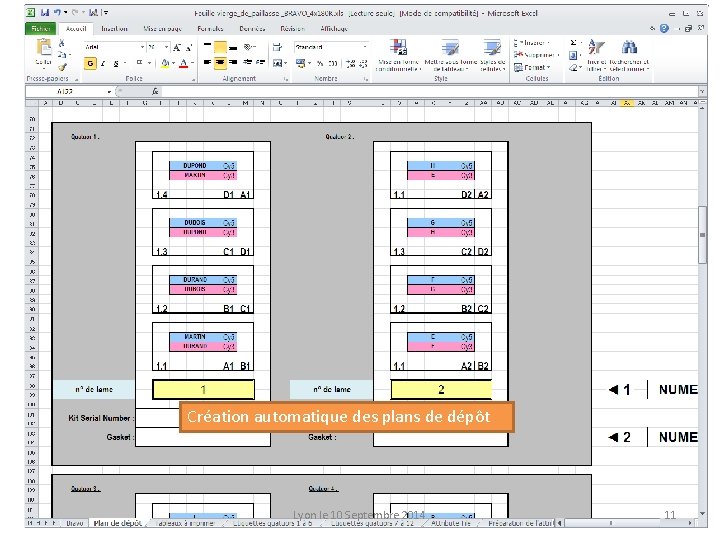
Création automatique des plans de dépôt Lyon le 10 Septembre 2014 11

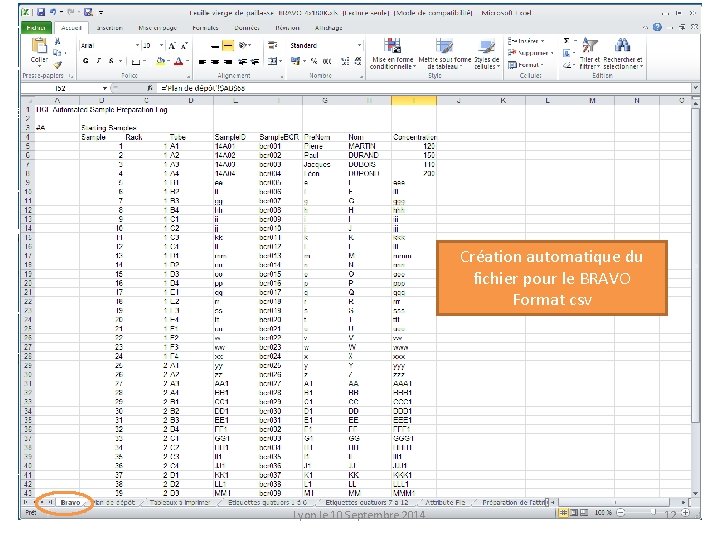
Création automatique du fichier pour le BRAVO Format csv Lyon le 10 Septembre 2014 12

Création automatique des étiquettes pour les tubes « finaux » (ADN marqués et combinés en « dye-swap » ) Lyon le 10 Septembre 2014 13

Création automatique de l’attributefile pour Cytogenomics Lyon le 10 Septembre 2014 14

ACPA : Technique en « Dye-Swap » Image en miroir Cy 3 Patient A Cy 5 Patient D Cy 3 Quatuor Patient B Cy 5 Cy 3 Patient C del(13)(q 33. 1) et dup(13)(q 33. 1 q 34) Adaptation du protocole BRAVO. Lyon le 10 Septembre 2014 15

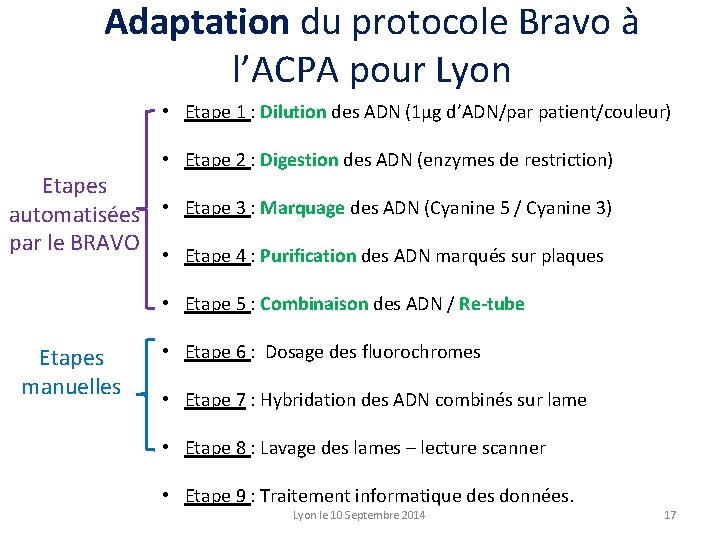
Application du protocole Bravo à l’ACPA pour Lyon • Etape 1 : Dilution des ADN (1µg d’ADN/par patient/couleur) Etapes automatisées par le BRAVO • Etape 2 : Digestion des ADN (enzymes de restriction) • Etape 3 : Marquage des ADN (Cyanine 5 / Cyanine 3) • Etape 4 : Purification des ADN marqués sur plaques • Etape 5 : Combinaison des ADN / Re-tube • Etape 6 : Dosage des fluorochromes • Etape 7 : Hybridation des ADN combinés sur lame • Etape 8 : Lavage des lames – lecture scanner • Etape 9 : Traitement informatique des données. Lyon le 10 Septembre 2014 16

Adaptation du protocole Bravo à l’ACPA pour Lyon • Etape 1 : Dilution des ADN (1µg d’ADN/par patient/couleur) • Etape 2 : Digestion des ADN (enzymes de restriction) Etapes automatisées • Etape 3 : Marquage des ADN (Cyanine 5 / Cyanine 3) par le BRAVO • Etape 4 : Purification des ADN marqués sur plaques • Etape 5 : Combinaison des ADN / Re-tube Etapes manuelles • Etape 6 : Dosage des fluorochromes • Etape 7 : Hybridation des ADN combinés sur lame • Etape 8 : Lavage des lames – lecture scanner • Etape 9 : Traitement informatique des données. Lyon le 10 Septembre 2014 17

Validation : Premiers essais Essais sur 24 patients (soit 6 Quatuors): Ø Test 1 : Vérifications d’anomalies connues Ø Test 2 : Technique automatisée VS Technique manuelle Ø Test 3: Patient commun à trois quatuors -> reproductibilité des résultats. Ø Test 4: Self-Self. Ø Test 5: ADN issus de 4 tissus de types différents. Problèmes initiaux rencontrés: Ø Programmation : plan de dépôt Ø Normalisation : volume d’eau prévu erroné -> rajout d’eau au cours de processus Ø Mix marquage : protocole « CGH/SNP enzymatic » -> rajout de mix manuellement en cours de processus Ø Re-tube : tout l’ADN marqué n’est pas récupéré à la fin de la technique (1/3) Lyon le 10 Septembre 2014 18

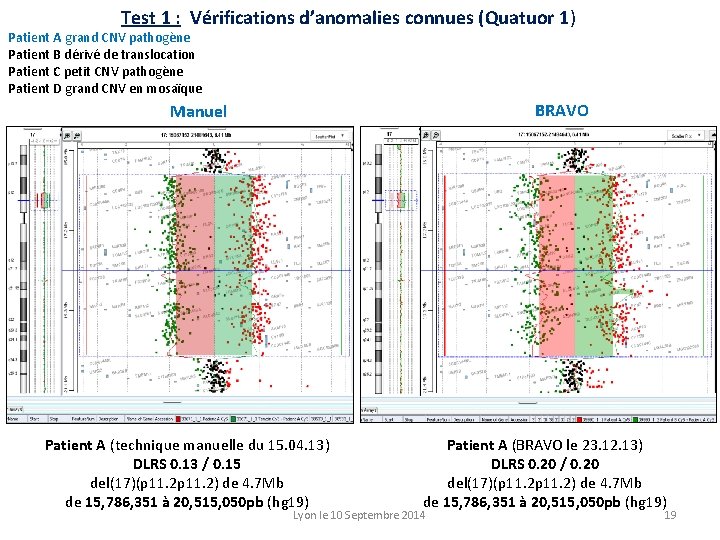
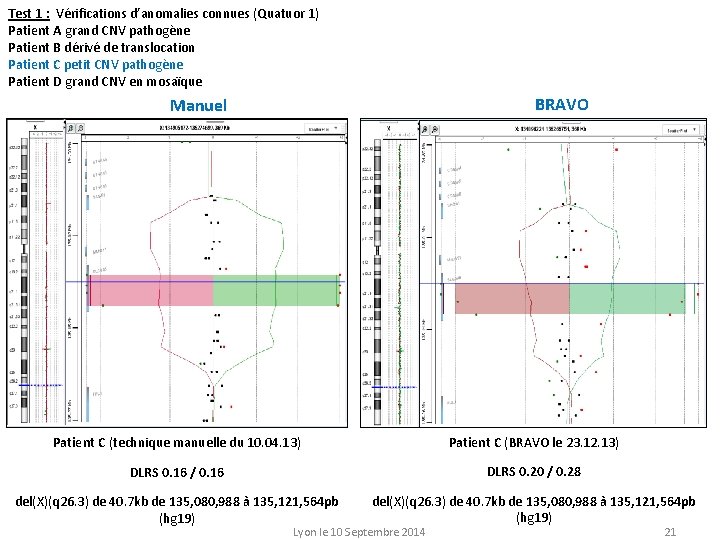
Test 1 : Vérifications d’anomalies connues (Quatuor 1) Patient A grand CNV pathogène Patient B dérivé de translocation Patient C petit CNV pathogène Patient D grand CNV en mosaïque BRAVO Manuel Patient A (technique manuelle du 15. 04. 13) DLRS 0. 13 / 0. 15 del(17)(p 11. 2) de 4. 7 Mb de 15, 786, 351 à 20, 515, 050 pb (hg 19) Patient A (BRAVO le 23. 12. 13) DLRS 0. 20 / 0. 20 del(17)(p 11. 2) de 4. 7 Mb de 15, 786, 351 à 20, 515, 050 pb (hg 19) Lyon le 10 Septembre 2014 19

Test 1 : Vérifications d’anomalies connues (Quatuor 1) Patient A grand CNV pathogène Patient B dérivé de translocation Patient C petit CNV pathogène Patient D grand CNV en mosaïque BRAVO Manuel Patient C (technique manuelle du 10. 04. 13) Patient C (BRAVO le 23. 12. 13) DLRS 0. 16 / 0. 16 DLRS 0. 20 / 0. 28 del(X)(q 26. 3) de 40. 7 kb de 135, 080, 988 à 135, 121, 564 pb (hg 19) Lyon le 10 Septembre 2014 21

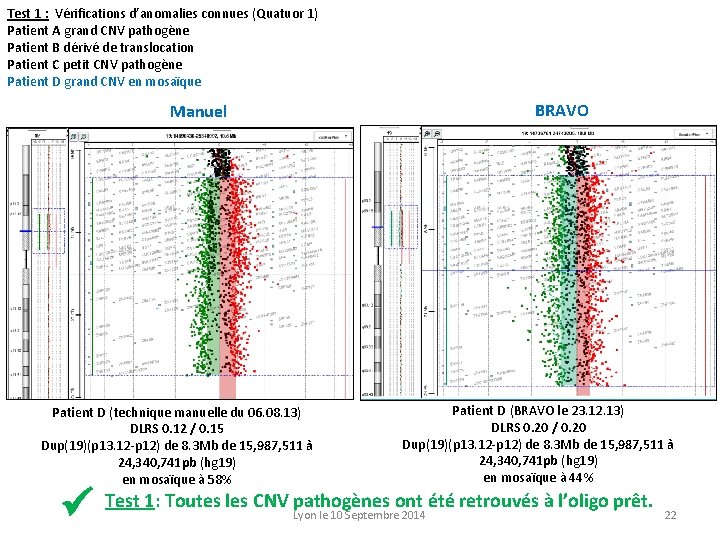
Test 1 : Vérifications d’anomalies connues (Quatuor 1) Patient A grand CNV pathogène Patient B dérivé de translocation Patient C petit CNV pathogène Patient D grand CNV en mosaïque BRAVO Manuel Patient D (technique manuelle du 06. 08. 13) DLRS 0. 12 / 0. 15 Dup(19)(p 13. 12 -p 12) de 8. 3 Mb de 15, 987, 511 à 24, 340, 741 pb (hg 19) en mosaïque à 58% Patient D (BRAVO le 23. 12. 13) DLRS 0. 20 / 0. 20 Dup(19)(p 13. 12 -p 12) de 8. 3 Mb de 15, 987, 511 à 24, 340, 741 pb (hg 19) en mosaïque à 44% Test 1: Toutes les CNV pathogènes ont été retrouvés à l’oligo prêt. Lyon le 10 Septembre 2014 22

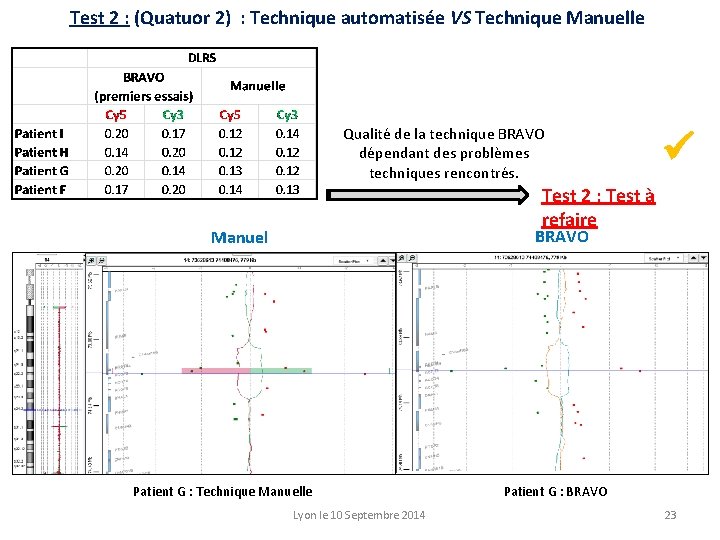
Test 2 : (Quatuor 2) : Technique automatisée VS Technique Manuelle Qualité de la technique BRAVO dépendant des problèmes techniques rencontrés. Test 2 : Test à refaire BRAVO Manuel Patient G : Technique Manuelle Lyon le 10 Septembre 2014 Patient G : BRAVO 23

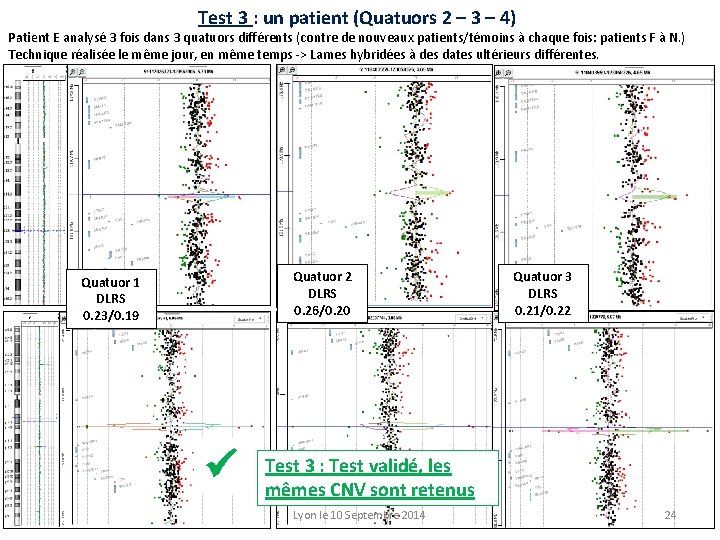
Test 3 : un patient (Quatuors 2 – 3 – 4) Patient E analysé 3 fois dans 3 quatuors différents (contre de nouveaux patients/témoins à chaque fois: patients F à N. ) Technique réalisée le même jour, en même temps -> Lames hybridées à des dates ultérieurs différentes. Quatuor 2 DLRS 0. 26/0. 20 Quatuor 1 DLRS 0. 23/0. 19 Quatuor 3 DLRS 0. 21/0. 22 Test 3 : Test validé, les mêmes CNV sont retenus Lyon le 10 Septembre 2014 24

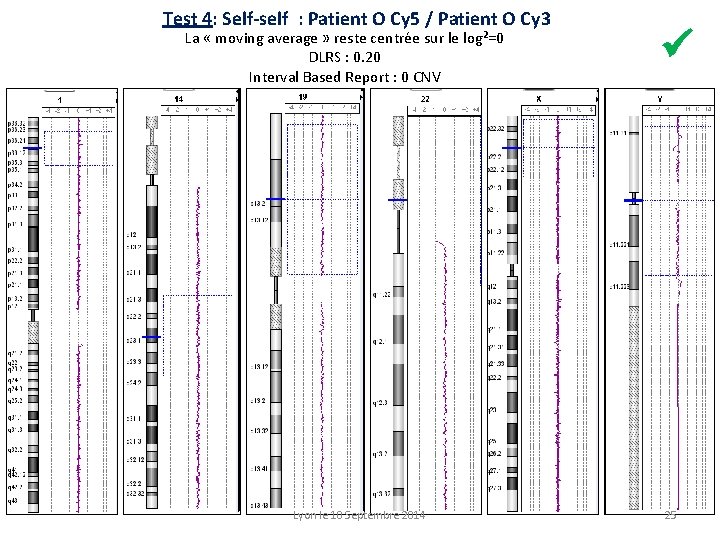
Test 4: Self-self : Patient O Cy 5 / Patient O Cy 3 La « moving average » reste centrée sur le log²=0 DLRS : 0. 20 Interval Based Report : 0 CNV Lyon le 10 Septembre 2014 25

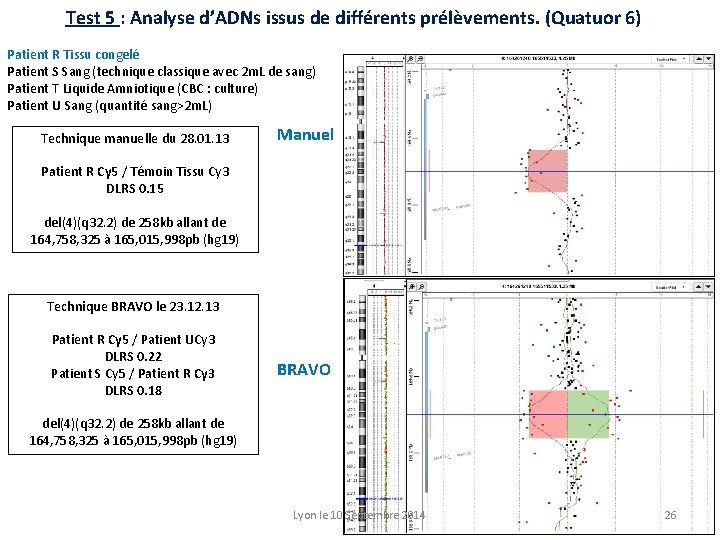
Test 5 : Analyse d’ADNs issus de différents prélèvements. (Quatuor 6) Patient R Tissu congelé Patient S Sang (technique classique avec 2 m. L de sang) Patient T Liquide Amniotique (CBC : culture) Patient U Sang (quantité sang>2 m. L) Technique manuelle du 28. 01. 13 Manuel Patient R Cy 5 / Témoin Tissu Cy 3 DLRS 0. 15 del(4)(q 32. 2) de 258 kb allant de 164, 758, 325 à 165, 015, 998 pb (hg 19) Technique BRAVO le 23. 12. 13 Patient R Cy 5 / Patient UCy 3 DLRS 0. 22 Patient S Cy 5 / Patient R Cy 3 DLRS 0. 18 BRAVO del(4)(q 32. 2) de 258 kb allant de 164, 758, 325 à 165, 015, 998 pb (hg 19) Lyon le 10 Septembre 2014 26

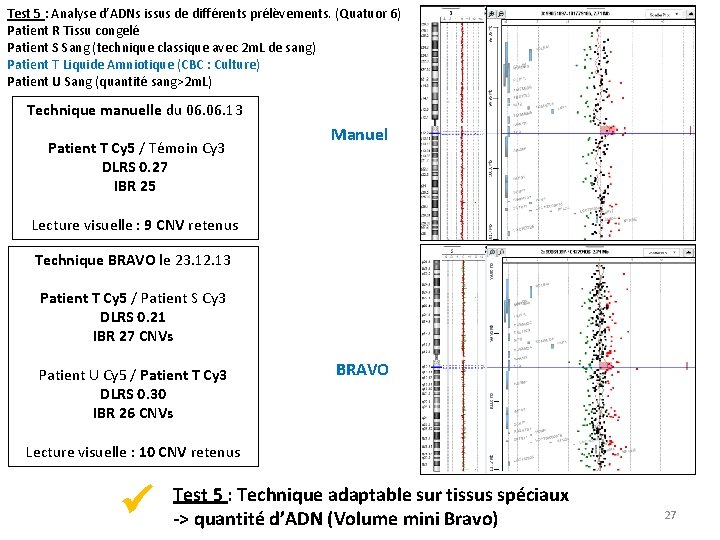
Test 5 : Analyse d’ADNs issus de différents prélèvements. (Quatuor 6) Patient R Tissu congelé Patient S Sang (technique classique avec 2 m. L de sang) Patient T Liquide Amniotique (CBC : Culture) Patient U Sang (quantité sang>2 m. L) Technique manuelle du 06. 13 Patient T Cy 5 / Témoin Cy 3 DLRS 0. 27 IBR 25 Manuel Lecture visuelle : 9 CNV retenus Technique BRAVO le 23. 12. 13 Patient T Cy 5 / Patient S Cy 3 DLRS 0. 21 IBR 27 CNVs Patient U Cy 5 / Patient T Cy 3 DLRS 0. 30 IBR 26 CNVs BRAVO Lecture visuelle : 10 CNV retenus Test 5 : Technique adaptable sur tissus spéciaux Lyon le(Volume 10 Septembre 2014 -> quantité d’ADN mini Bravo) 27

Premières séries de patients 1 Janvier-Février : 2 Séries de 24 patients Evènements et modifications du protocole Ø Tests « à blanc » : heurt entre le bras de l’appareil et la « deep well 384 » -> 3 « têtes préleveuses » cassées à changer -> adaptation au consommable « deep well 384 » achetée (Marché HCL) Ø Installation caisson -> décalage de la tête du Bravo Ø Répartition mix de digestion : pas de mix dans 2 colonnes -> 2/6 Quatuors non marqués à refaire Þ Intervention Agilent -> re-paramétrage des axes -> affiner le réglage de la hauteur Premières série : améliorations apportées -> Tester « à blanc » toutes les étapes -> 2 quatuors à refaire Lyon le 10 Septembre 2014 28

Premières séries de patients 2 Mars : Séries de 24 patients Ø Résultats corrects: 0, 15<DLRS<0, 20 environ 10 CNV/patient Ø Mais problèmes rencontrés : apparitions de bulles -> problèmes de volumes Intervention Agilent Troisième série : 6 quatuors validés Lyon le 10 Septembre 2014 30

Validation de méthodes Ø Série de 24 patients dont 12 patients avec anomalie connue Chaque Quatuor = 2 anciens patients + 2 nouveaux patients Toutes les anomalies connues ont été retrouvées. Validation technique du Bravo (sur 24 patients) Lyon le 10 Septembre 2014 31

Suite séries de patients 3 Mars : Série de 48 patients Ø Tests « à blanc » : Digestion – Marquage – Combinaison – Retube ( étapes ayant subi des changements) Ø Normalisation erronée -> blocage à 23/48 patients. -> intérêt de tester « à blanc » toutes les étapes avec le véritable nombre de patients. Ø Installation du nouveau protocole « normalisation » . Ø Problème de format du fichier « feuille de route » -> caractères spéciaux. Ø Plaque PCR défectueuse / Echec technique Intervention Agilent de 48 patients perdue. 1 ->Série passage à 48 patients pas encore possible. Lyon le 10 Septembre 2014 32

Suite séries de patients Mai – Juin – Juillet Problèmes à résoudre Ø Programmation -> Bulles -> Répartition mix digestion : inégale -> rajout manuel -> Déplacement du bras Ø Gestion des erreurs -> Problème position des « Tips » Intervention Agilent Série de 48 patients validée suite à l’intervention d’Agilent Depuis juillet : 2 séries de 48 sans problème : Passage en routine Lyon le 10 Septembre 2014 33

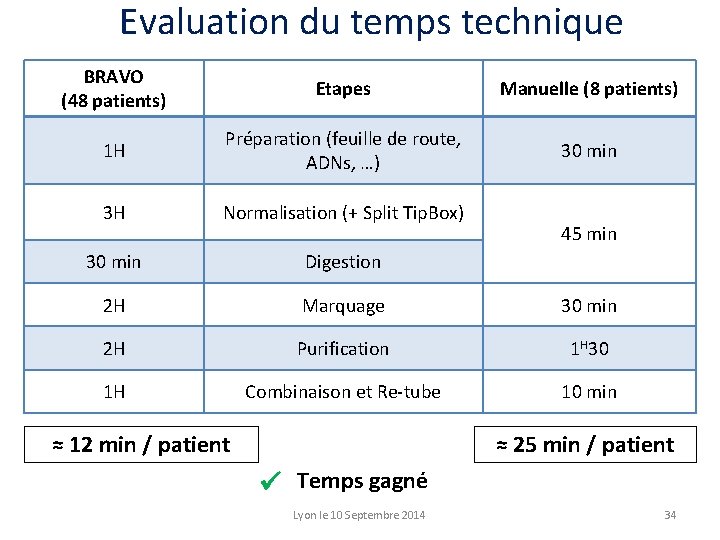
Evaluation du temps technique BRAVO (48 patients) Etapes Manuelle (8 patients) 1 H Préparation (feuille de route, ADNs, …) 30 min 3 H Normalisation (+ Split Tip. Box) 30 min Digestion 2 H Marquage 30 min 2 H Purification 1 H 30 1 H Combinaison et Re-tube 10 min ≈ 12 min / patient 45 min ≈ 25 min / patient Temps gagné Lyon le 10 Septembre 2014 34

Avantages / Limites de la technique Avantages Limites Ø Préparation en amont -> 48 dossiers Ø Vitesse -> tps technique/patient réduit Ø Tests « à blanc » obligatoires Ø Applicable pour 4 x 180 K pour l’instant Ø Reproductibilité -> démarche qualité Ø Volume d’ADN mini (+5µL) et microtubes compatibles avec « Racks » -> aliquots reçus extraits/échantillons précieux Ø Qualité des résultats Ø Réactivité du support technique Ø Traçabilité (réactifs et patients) -> démarche qualité Ø Formation logiciel et problèmes informatiques Ø Consommables (quantité, colonnes de purifications non utilisées) Lyon le 10 Septembre 2014 35

Conclusions et perspectives Ø Réorganisation du service -> 1 technicien/Bravo -> hybridations « en série » par autres techniciens. ØTests « à blanc » sur toutes les étapes et pour chaque programme (nombre patients – formats lames)-> après chaque modification -> temps + consommables Perspectives : Ø Automatisation plus globale du processus « ACPA » : - Extraction ADN - Passage à Cytogenomics -> possibilité d’autoprocessing Ø Refaire quelques tests-> « Validation des méthodes » -> Accréditation Ø ACPA en acquis : ADN patients / ADN Témoin -> reprogrammation Intervention Agilent Lyon le 10 Septembre 2014 36

Remerciements Automatisation du marquage des ADN pour l’Analyse Chromosomique sur Puces à ADN (ACPA): validation de la station BRAVO au CHU de Lyon. Laboratoire Caroline Perbet Emmanuelle Banquart Christine Bel Anne Fautrelle Catherine Hempel Brigitte Jelassi Sylvie Josué Chantal Lavert Michelle Martin Christine Valex Corinne Buis Azim Rafat Patrick Edery ACPA Damien Sanlaville Marianne Till Audrey Labalme Nicolas Chatron Caroline Schluth Eudeline Alix Chantal Beche Christelle Angei Laurence Caine Hélène Guilbert Isabelle Morin Clément Bonnefille Cassandra Nivou Jessica Michel Lyon le 10 Septembre 2014 Réseau AChro. Puce Support Agilent 37

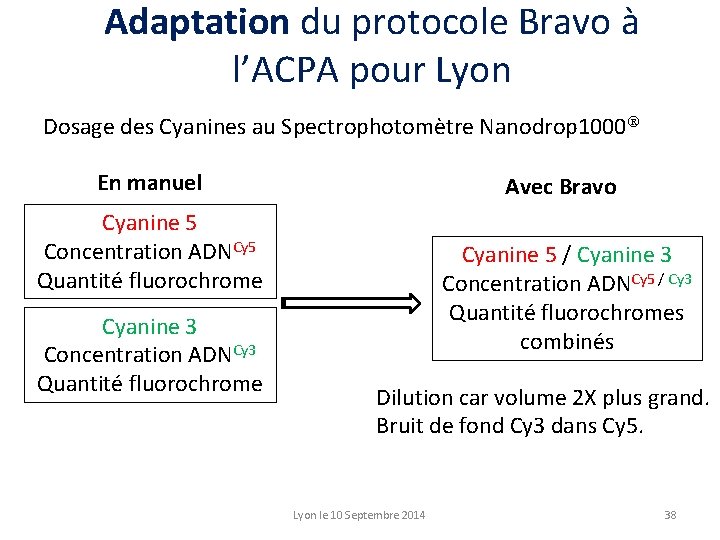
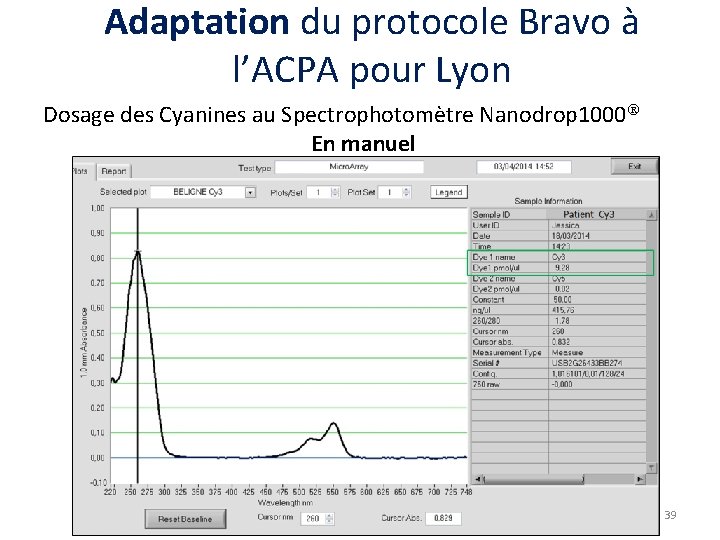
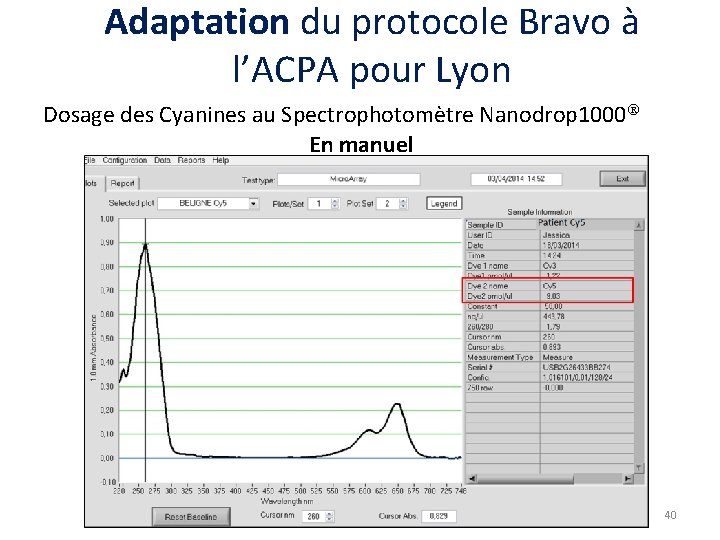
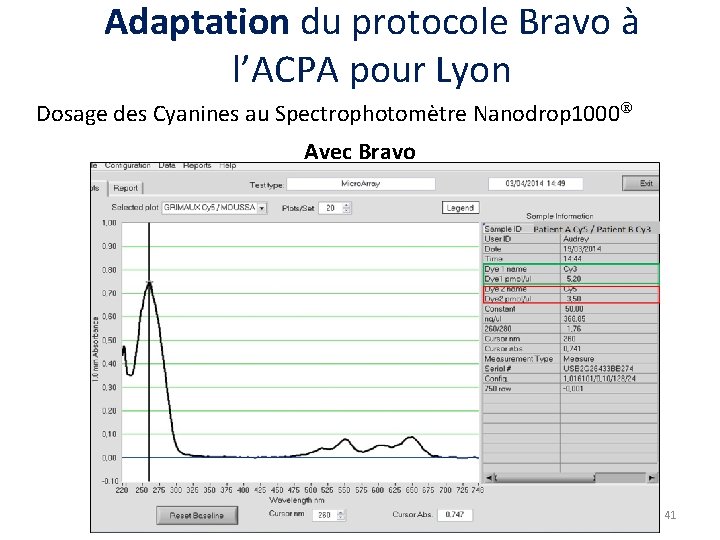
Adaptation du protocole Bravo à l’ACPA pour Lyon Dosage des Cyanines au Spectrophotomètre Nanodrop 1000 En manuel Avec Bravo Cyanine 5 Concentration ADNCy 5 Quantité fluorochrome Cyanine 3 Concentration ADNCy 3 Quantité fluorochrome Cyanine 5 / Cyanine 3 Concentration ADNCy 5 / Cy 3 Quantité fluorochromes combinés Dilution car volume 2 X plus grand. Bruit de fond Cy 3 dans Cy 5. Lyon le 10 Septembre 2014 38

Adaptation du protocole Bravo à l’ACPA pour Lyon Dosage des Cyanines au Spectrophotomètre Nanodrop 1000 En manuel 39

Adaptation du protocole Bravo à l’ACPA pour Lyon Dosage des Cyanines au Spectrophotomètre Nanodrop 1000 En manuel 40

Adaptation du protocole Bravo à l’ACPA pour Lyon Dosage des Cyanines au Spectrophotomètre Nanodrop 1000 Avec Bravo 41

Modifications supplémentaires demandées Modifications Conséquences Ø Digestion – Marquage : Possibilité d’introduire un « STOP » entre la digestion et le marquage Ø Digestion : Suppression de l’étape de transfert de la plaque « ADN normalisés » vers une 2 nde plaque « digestion » Ø Répartir la technique sur plusieurs jours Ø Gain de temps Ø Gain de quantité d’ADN Ø Economie de consommables Ø Gain de quantité d’ADN marqué Ø Re-tube : Ø Etape de concentration Récupérer tout l’ADN marqué/combiné « speedvacc » supplémentaire Lyon le 10 Septembre 2014 42
 Non-reciprocal translocation
Non-reciprocal translocation Fibre polaire et fibre chromosomique
Fibre polaire et fibre chromosomique Il existe des personnes qui sont des lumières pour tous
Il existe des personnes qui sont des lumières pour tous Coop mazout
Coop mazout Des des des
Des des des Expressions avec le subjonctif
Expressions avec le subjonctif 13 conseil de la vie
13 conseil de la vie Des cartes pour comprendre le monde
Des cartes pour comprendre le monde Reconstitue les phrases ci dessous
Reconstitue les phrases ci dessous Jesus roi des rois qui mourut pour moi
Jesus roi des rois qui mourut pour moi Provision pour dépréciation des titres
Provision pour dépréciation des titres Toc toc toc quelqu'un frappe à ma porte
Toc toc toc quelqu'un frappe à ma porte Il fait beau temps je t'ai cueilli un cadeau
Il fait beau temps je t'ai cueilli un cadeau La diffusion des idées des lumières
La diffusion des idées des lumières Volume correspondant à une division
Volume correspondant à une division Des attacks
Des attacks Affiche propagande guerre froide
Affiche propagande guerre froide Les temps verbaux et leurs valeurs
Les temps verbaux et leurs valeurs Cartographie des risques gestion des stocks
Cartographie des risques gestion des stocks Budget des ventes méthode des moindres carrés
Budget des ventes méthode des moindres carrés Diversification des espaces et des acteurs de la production
Diversification des espaces et des acteurs de la production Je t'offrirai des fleurs et des nappes en couleurs
Je t'offrirai des fleurs et des nappes en couleurs Volume des liquides et des solides
Volume des liquides et des solides Robin des bois des alpes
Robin des bois des alpes Tipos de acidos ribonucleicos
Tipos de acidos ribonucleicos Adn y ambiente
Adn y ambiente Interfase adn
Interfase adn Adn
Adn Retículo endoplasmático rugoso función
Retículo endoplasmático rugoso función Elongación transcripción
Elongación transcripción Lonestar nursing application
Lonestar nursing application Cuadro comparativo adn y arn
Cuadro comparativo adn y arn Funcion del adn
Funcion del adn Diferencias del adn y arn
Diferencias del adn y arn Polinucleotido
Polinucleotido A t g c adn
A t g c adn Que costilla le falta al hombre
Que costilla le falta al hombre Dominância incompleta
Dominância incompleta Movilidad electroforética
Movilidad electroforética Entrecruzamiento cromosomas
Entrecruzamiento cromosomas