ANIONES MONOATMICOS La Qumica Descriptiva de los elementos
















- Slides: 19

ANIONES MONOATÓMICOS La Química Descriptiva de los elementos trata de su comportamiento como átomos, iones o moléculas, en diferentes condiciones de temperatura, presión y medio ambiente Los aniones monoatómicos (AM), partículas cargadas negativamente, tienen en común muchas propiedades químicas y físicas, debido principalmente a que todos los AM presentan la estructura electrónica simétrica de un átomo de gas noble. Sin embargo, presentan diferencias de comportamiento debido a las diferencias en otras carcaterísticas fundamentales, tales como tamaño y carga iónica. 1

ANIONES MONOATÓMICOS Formación Los AM se forman por reducción de los no metales La reducción está en términos de: • Afinidad electrónica, energía desprendida ó absorbida en el proceso • Electronegatividad, cantidad empírica que representa la tendencia relativa de las partículas a atraer electrones X(g) + e- X-(g) • Potencial de reducción normal, describe un proceso que se presenta en solución acuosa y en que intervienen en el cambio total de energía, tanto el calor de hidratación del anión y otras energías, como la afinidad elctrónica ½ X 2(g) + e- X-(ac) 2

ANIONES MONOATÓMICOS Propiedades Las propiedades de los AM se pueden correlacionar considerando: • Tamaño • Carga • Electronegatividad • Polarizabilidad Las propiedades anteriores están relacionadas entre sí, ya que tanto la polarizabilidad como la electronegatividad dependen del tamaño del ion y, a su vez, el tamaño depende, en parte, de la carga iónica 3

H 2. 08 C 42. 60 N 31. 71 O 21. 35 F 1. 34 Si 42. 71 P 32. 12 S 21. 84 Cl 1. 80 As 32. 22 Se 21. 98 Br 1. 90 Sb 32. 45 Te 22. 21 I 2. 16 Radios iónicos cristalinos ( en Å) 4

ANIONES MONOATÓMICOS Propiedades Para los iones que tienen una estructura electrónica común, se observa un aumento en el radio iónico al aumentar la carga iónica negativa, sin embargo y por ejemplo, el tamaño relativamente grande del ion hidruro, con una relación entre electrones y protones de 2 a 1, ilustra el efecto de la falta de equilibrio entre las cargas sobre el tamaño iónico La polarizabilidad de un ion es una medida de la facilidad con la cual se puede distorsionar su nube electrónica bajo la influencia de un campo eléctrico + - + NO POLARIZADO d- d+ POLARIZADO Polarización de un anión 5

ANIONES MONOATÓMICOS Propiedades • Para los AM, esta propiedad proporcional al volumen iónico es directamente Durante el proceso de polarización: • No se crea una nueva carga • El grado de polarización, depende del campo eléctrico aplicado, de los cationes presentes; mientras más pequeño sea el catión y más grande sea su carga, mayor será su fuerza de polarización Una vez polarizado: • El centro de la carga negativa de un anión no coincide con el centro de carga positiva del mismo • La nube electrónica se distorsiona hacia el catión y el núcleo se distorsiona en la dirección opuesta 6

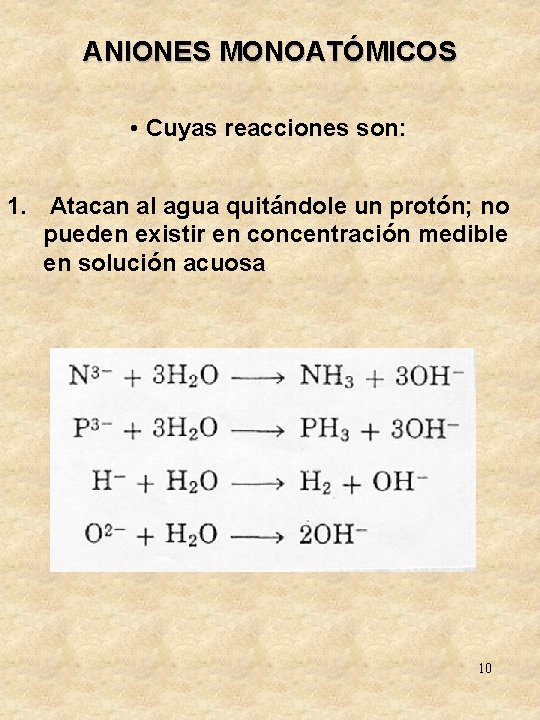
ANIONES MONOATÓMICOS Soluciónes acuosas Solo 7 aniones monoatómicos pueden existir en solución acuosa Los otros iones separan los protones del agua formando uno o más enlaces covalentes con ellos, y dejando al ion oxhidrilo de agua, según la Ec. General: An- + n. H 2 O AHn + n. OHAplicando el concepto ácido-base de Brönsted-Lowry, se concluye que estos iones que reaccionan frente al 7 agua son bases más fuertes que el ion oxhidrilo

ANIONES MONOATÓMICOS Soluciones acuosas En solución ácida también se debe considerar la reactividad de estos iones frente al ion hidronio H 3 O+ Las reacciones de los AM con agua y con el ion hidronio son funciones del acomodo periódico de los no metales 8

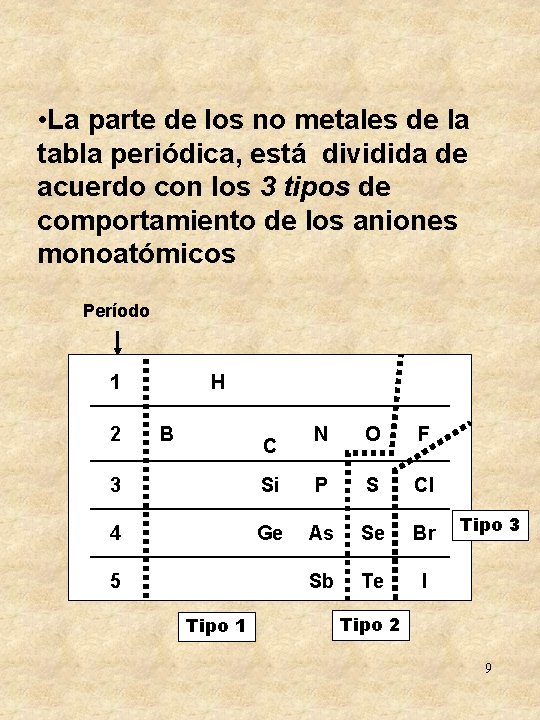
• La parte de los no metales de la tabla periódica, está dividida de acuerdo con los 3 tipos de comportamiento de los aniones monoatómicos Período 1 2 H B C N O F 3 Si P S Cl 4 Ge As Se Br Sb Te I 5 Tipo 1 Tipo 3 Tipo 2 9

ANIONES MONOATÓMICOS • Cuyas reacciones son: 1. Atacan al agua quitándole un protón; no pueden existir en concentración medible en solución acuosa 10

ANIONES MONOATÓMICOS Soluciónes acuosas 2. No reaccionan apreciablemente con el agua en solución básica, pero atacan al ion hidronio por eliminación de protones; en soluciones básicas existen como iones libres, y en soluciones ácidas casi totalmente como ácidos no disociados S 2 - + H 2 O = S 2 - + X H 3 O+ = HS- + H 2 O HS- + H 3 O+ = H 2 S + H 2 O 3. No reaccionan notablemente con el agua o con el ion hidronio Cl- + H 2 O = Cl- + H 3 O+ = X X 11

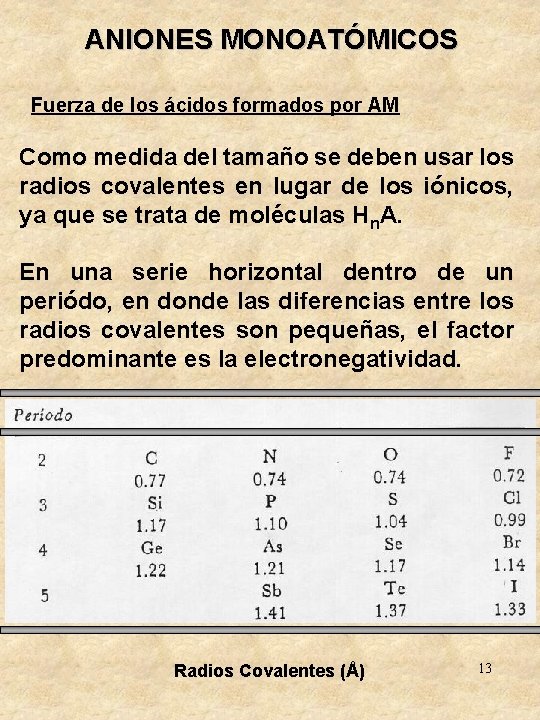
ANIONES MONOATÓMICOS Fuerza de los ácidos formados por AM La fuerza de un ácido protónico se mide según el grado hasta el cual la reacción Hn. A + H 2 O H 3 O+ + Hn-1 Ase lleva a cabo hacia la derecha o según la facilidad con la cual se transfiere un protón hacia el agua La facilidad con la cual las moléculas del tipo Hn. A pierden sus protones es directamente proporcinal a dos factores: • El carácter iónico del enlace H – A • El tamaño del no metal A 12

ANIONES MONOATÓMICOS Fuerza de los ácidos formados por AM Como medida del tamaño se deben usar los radios covalentes en lugar de los iónicos, ya que se trata de moléculas Hn. A. En una serie horizontal dentro de un periódo, en donde las diferencias entre los radios covalentes son pequeñas, el factor predominante es la electronegatividad. Radios Covalentes (Å) 13

ANIONES MONOATÓMICOS Preparación de los AM Si los AM representan los estados de oxidación mínimos de sus respectivos elementos, se pueden preparar por reducción de los elementos a partir de su estado libre o de algún estado de oxidación positivo. Se usa comúnmente la reacción de combinación de un metal y un no metal Metales activos como agentes reductores frente a todos los no metales: • Grupo alcalino (1) • Grupo alcalinotérreo (2) (1) (2) 14

ANIONES MONOATÓMICOS Preparación de los AM Ejemplos: Todas las reacciones citadas son exotérmicas. Formación de óxidos y peróxidos 15

ANIONES MONOATÓMICOS Preparación de los ácidos de los AM Para los AM de fórmula general Hn. A, se tienen los siguientes métodos de preparación: 1. Combinación directa del hidrógeno gaseoso con el elemento no metálico 2. n. H 2 + 2 A (ó A 2) 2 Hn. A 2. Reacción del anión de una sal con alguna fuente de protones n. H + + An- Hn. A Método 1. 16

17

ANIONES MONOATÓMICOS Preparación de los ácidos de los AM Método 2. 18

ANIONES MONOATÓMICOS Oxidación de los AM Los aniones monoatómicos se pueden oxidar a elementos libres o, en algunos casos, a estados de oxidación positivos. Como se señaló, sólo el cloruro, el bromuro y el yoduro existen como iones libres en soluciones acuosas ácidas; en este medio los otros aniones se hidrolizan a los correspondientes hidruros. En el caso de los no metales muy activos, flúor, cloro y oxígeno, la oxidación electrolítica sirve efectivamente para la obtención de los elementos a partir de los aniones y sus hidruros. - Obtención de flúor - Obtención de cloro 19
 Cuáles son los elementos de un texto narrativo
Cuáles son los elementos de un texto narrativo Aula sobre paisagem natural e modificada
Aula sobre paisagem natural e modificada Lista de cotejo diacronica
Lista de cotejo diacronica Textos no literarios expositivos
Textos no literarios expositivos Tipos de marco
Tipos de marco Investigacion proyectiva definicion
Investigacion proyectiva definicion Secventa narativa si descriptiva
Secventa narativa si descriptiva Correlacional
Correlacional Que es una investigacion
Que es una investigacion Fases de la investigación descriptiva
Fases de la investigación descriptiva Texto expositivo deductivo
Texto expositivo deductivo Oraciones constatativas y realizativas
Oraciones constatativas y realizativas Texto expositivo con introducción desarrollo y conclusión
Texto expositivo con introducción desarrollo y conclusión Frecuencia relativa porcentual acumulada
Frecuencia relativa porcentual acumulada Estadistica descriptiva e inferencial
Estadistica descriptiva e inferencial Estadística descriptiva e inferencial
Estadística descriptiva e inferencial Diagrama de tallo y hoja
Diagrama de tallo y hoja Capacidad descriptiva explicativa y predictiva
Capacidad descriptiva explicativa y predictiva ¿qué es la investigación descriptiva ejemplos?
¿qué es la investigación descriptiva ejemplos? Nivel correlacional de la investigacion
Nivel correlacional de la investigacion