ANALISIS KATION GOLONGAN II dan III 31 Maret







- Slides: 11

ANALISIS KATION GOLONGAN II dan III 31 Maret 2016

Kation Golongan II • Tidak bereaksi dengan HCl, tetapi membentuk endapan dengan H 2 S dalam suasana asam encer. • Pereaksi golongan : H 2 S bentuk endapan garam sulfida. • Kation golongan II dibagi menjadi 2 sub-golongan berdasarkan kelarutan endapan sulfida terhadap ammonium polisulfida. II A (gol. Tembaga) : Hg 2+, Cu 2+, Bi 3+, Cd 2+, Pb 2+ II B (gol. Arsenik) : As 3+, As 5+, Sb 3+, Sb 5+, , Sn 2+, Sn 4+ • Sulfida dari sub-golongan II A tidak dapat larut dalam amonium polisulfida, sedangkan pada sub-golongan II B dapat larut.

Kation Golongan II • Sulfida golongan II memiliki nilai Ksp yang sangat kecil, oleh sebab itu konsentrasi ion sulfida harus dijaga relatif rendah, agar menghindarkan pengendapan dari sulfida-sulfida yang diharapkan tetap larut (golongan III atau IV). • Konsentrasi ion sulfida diatur hanya sampai mampu mengendapkan Sn. S 2. Konsentrasi ion sulfida dapat dikontrol dengan pengaturan konsentrasi H+, kemudian dipisahkan kelarutan sulfidanya. • Kondisi p. H penting : jika konsentrasi asam ↑ maka Cu 2+, Cd 2+, Pb 2+ tidak sempurna pengendapannya, namun jika konsentrasi asam ↓ maka sulfida dari golongan III akan ikut mengendap.

Kation Golongan II • Reaksi yang terjadi: Cu 2+ + S 2 - 2 Cu. S (↓endapan hitam) Endapan kation lainnya : Cd. S (kuning), Bi 2 S 3 (coklat), Sn. S 2 (kuning), Sb 2 S 3 (jingga), Hg. S (hitam), Pb. S (hitam), As 2 S 3 (kuning), As 2 S 5 (kuning), Sb 2 S 5 (jingga), Sn. S (coklat).

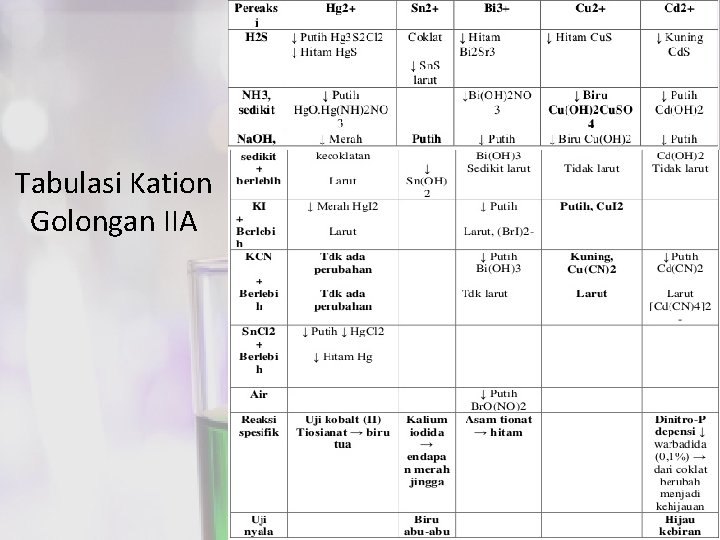
Tabulasi Kation Golongan IIA

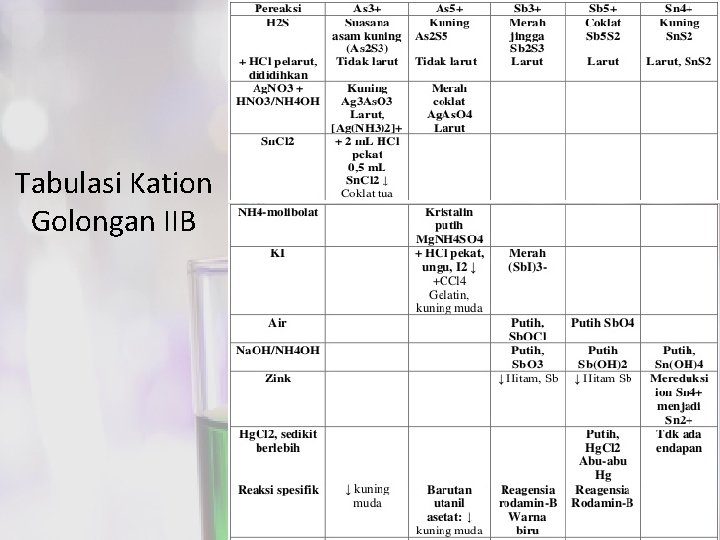
Tabulasi Kation Golongan IIB

Kation Golongan III • Kation golongan III membentuk sulfida yang lebih larut dibanding golongan II Tidak bereaksi dengan HCl, tetapi membentuk endapan dengan H 2 S dalam suasana asam encer. • Pereaksi golongan : (NH 4)2 S bentuk endapan garam sulfida. • Kation golongan III dibagi menjadi 2 sub-golongan. III A (gol. Besi) : Fe 2+, Fe 3+, Al 3+, Cr 3 III B (gol. Zink) : Ni 2+, Co 2+, Mn 2+, Zn 2+ • Pereaksi golongan : (NH 4)2 S • Endapan kation yang terbentuk : Fe. S (hitam), Al(OH)3 (putih), Cr(OH)3 (hijau), Ni. S (hitam), Cu. S (hitam), Mn. S (pink), Zn. S (putih)

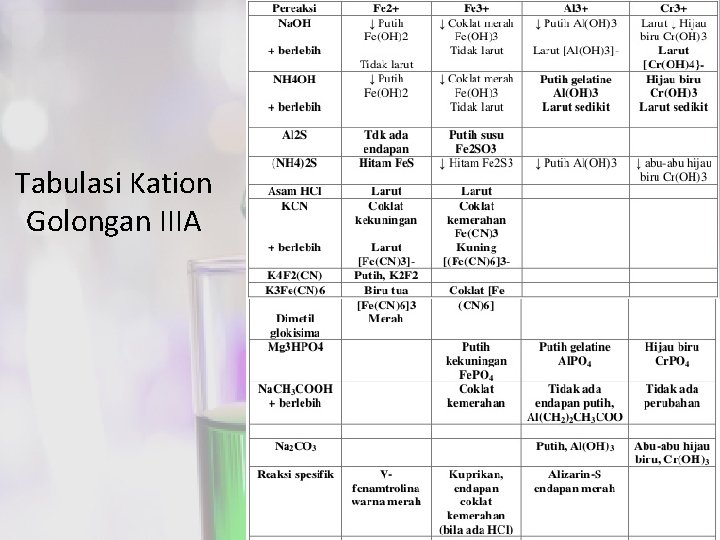
Tabulasi Kation Golongan IIIA

Besi (II): • Dengan Na. OH + H 2 O 2 endapan besi (II) hidroksida (endapan hijau) yang teroksidasi menjadi besi (III) hidroksida. • Fe 2+ + 2 OH- Fe(OH)2 • 4 Fe(OH)2 + 2 H 2 O + O 2 4 Fe(OH)3 • 2 Fe(OH)3 + H 2 O 2 2 Fe(OH)3

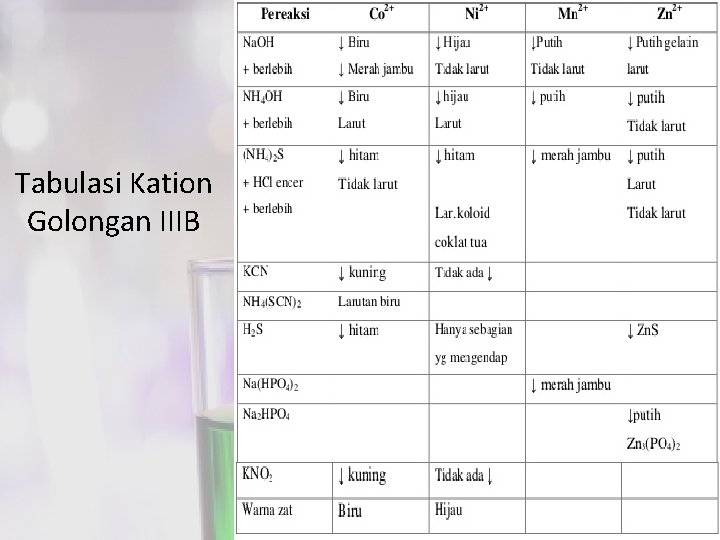
Tabulasi Kation Golongan IIIB