Analisa Kualitatif Analisa Kation Kationkation Golongan 1 Golongan

























- Slides: 29

Analisa Kualitatif (Analisa Kation) Kation-kation : Golongan 1, Golongan 2, Golongan 3

Pendahuluan n n Analisa Kualitatif adalah suatu analisa yang digunakan untuk memisahkan dan mendeteksi sejumlah kation dan anion dalam suatu bahan sampel Merupakan cabang ilmu kimia yang berhubungan dengan identifikasi unsur atau golongan yang terdapat dalam sampel. Teknik-teknik yang digunakan dalam analisis kualitatif berbeda-beda dalam kompleksitas, tergantung pada sifat sampel. Dalam beberapa kasus untuk membuktikan adanya unsur-unsur atau golongan tertentu diperlukan tes spesifik dari sampel

n Pertama, ion akan dipisahkan dalam kelompok dari larutan awal. Setelah masing kelompok telah terpisah, maka pengujian dilakukan untuk ion individu dalam setiap kelompok. Kation - kelompok ion atau ion memiliki muatan positif. - merupakan atom yang kehilangan elektron menjadi bermuatan positif. Misalnya, Natrium memiliki satu elektron valensi, satu elektron pada tingkat energi terluarnya, sehingga cenderung kehilangan satu elektron, dan menjadi sebuah ion dengan muatan +

Menurut sifatnya, kation diklasifikasikan menjadi 5 golongan. n n Kation Golongan 1 Ag+ Pb 2+ Hg 22+ (Golongan kation yg tidak larut dalam klorida ) Mengendap in HCl 6 M

n n n Kation golongan 2 Golongan yang tidak larut dalam asam sulfida Cd 2+ Bi 3+ Cu 2+ As 3+ As 5+ Mengendap larutan dalam Sb 3+ H 2 S 0, 1 M pada p. H 0. 5 Sb 5+ Sn 2+ Sn 4+ Hg 2+ Pb 2+

n n n n n Kation golongan 3 Zn 2+ Ni 2+ Co 2+ Mn 2+ Fe 3+ Al 3+ Cr 3+ Golongan ini tidak larut dalam basa sulfida Mengendap dalam H 2 S 0, 1 M pada p. H 9

n n n n n Kation golongan 4 Ba 2+ Ca 2+ Sr 2+ Kation golongan 5 Mg 2+ Li+ Na+ K+ NH 4+ Golongan ini tidak larut dalam larutan Carbonat Kation golongan ini mengendap dalam larutan (NH 4)2 CO 3 1 M pada p. H 10 Tidak larut dalam klorida Tidak membentuk endapan

C. Persiapan Larutan uji n n n Sejumlah sampel-> larutkan dalam pelarut yang sesuai. Gunakan ini sebagai larutan uji Ingat: selalu mengasumsikan bahwa semua kation masih belum diketahui Catatan: Diagram skematis termasuk di lab Halaman manual-terakhir

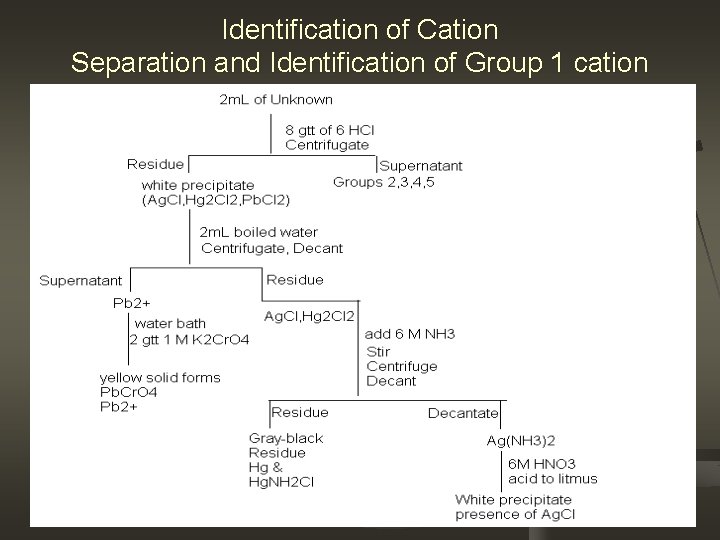
Identification of Cation Separation and Identification of Group 1 cation

Diskusi Mengapa ditambahkan 6 M HCl? Golongan 1 terdiri dari kation bentuk ion klorida yang tidak larut dan HCl adalah sarana kita untuk memiliki Cl dalam reaksi membentuk presipitat. Reaksinya adalah sbb: Ag(l) + HCl(l) Ag. Cl(s) + H+(g) Pb+2(l)+ 2 HCl(l) Pb. Cl 2(s) + 2 H+(g) Hg 22+(l) + 2 HCl(l) Hg 2 Cl 2(s) + 2 H+(g) n

n Mengapa harus dihindari penambahan HCl secara berlebih? Krn kelebihan HCL akan membentuk kompleks ion-ions yg larut Ag. Cl(s)+ Cl(aq) [Ag. Cl 2]- dikloroargentat Pb. Cl 2 (s)+ 2 Cl(aq) [Pb. Cl 4]2 - tetrakloroplumbat Hg 2 Cl 2 (s)+ 2 Cl(aq) [Hg 2 Cl 4]2 - tetrakloro hidrat n Mengapa harus ditambahkan air mendidih? n Ini dapat dijelaskan melalui Ksp dan pengaruh suhu. produk kelarutan. Ksp perak klorida dan timbal masing -masing 1, 8 x 10 -10 dan 1, 7 x 10 -5, . Ini berarti tidak ada satu garam pun yg larut dan Ag. Cl kurang larut dibandingkan dengan Pb. Cl 2. Peningkatan suhu akan menyebabkan kelarutan lebih besar untuk Pb n Simak n Baca secara fonetik. .

Mengapa ditambahkan K 2 Cr. O 4 1 M? K 2 Cr. O 4 akan memberikan gugus Cr. O 4 yg akan bereaksi dg Pb. Cl 2 membentuk endapan kuning dg reaksi sbb: Pb. Cl 2+Cr. O 4 Pb. Cr. O 4(s) + 2 Cl n

Mengapa ditambahkan NH 3 6 M? Utk membentuk endapan yg dikehendaki NH 3 digunakan sbg senyawa pengkompleks. Ini dpt dijelaskan melalui reaksi sbb: Ag. Cl + 2 NH 3→[Ag(NH 3)2]++Cl. Hg 2 Cl 2 + NH 3 → Hg(s) + Hg. NH 2 Cl + Cln Mengapa ditambahkan HNO 3 6 M sampai asam (gunakan lakmus) ? Penambahan HNO 3 ke dlm larutn akan mengubah konpleks [Ag(NH 3)2] menjadi Ag and NH 3 dan penambahan sampai mjd asam utk meyakinkan bahwa jumlah HNO 3 dalm larutan telah cukup. Sesuai dengan reaksi sbb: [Ag(NH 3)2]++ HNO 3→ Ag+ NH 3 ↓Cl. Ag. Cl(white) n

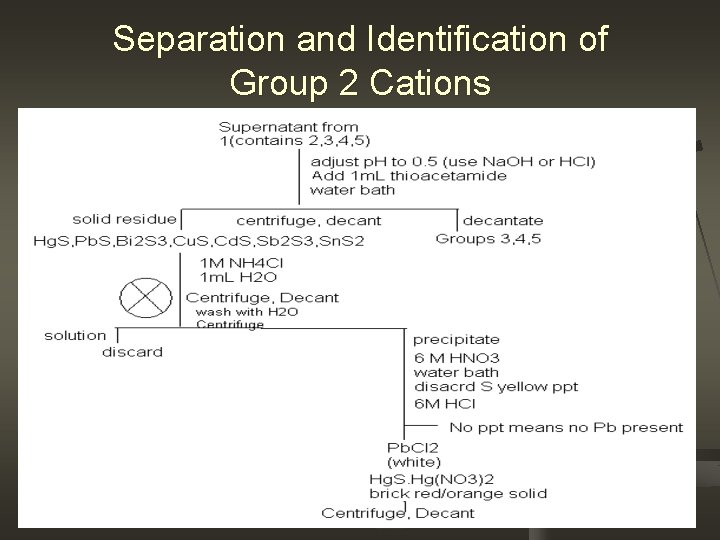
Separation and Identification of Group 2 Cations



Diskusi n Mengapa p. H harus disesuaikan sampai 0. 5? Kation Gol. 2 adalah gol yg tidak larut dalam kelompok sulfida. Jd penurunan p. H akan membuat kation gol 2 tetap dlm bentuk larutan. Jika penyusuaian tidak tercapai, ada kemungkinan kation gol 3 akan mengendap juga dlm larutan. Selain itu juga, pd pengendapan gol. 2 dg H 2 S, penambahan H+ akan mengubah arah reaksi ke kiri sehingga S 2+ menjadi rendah. So, only fairly insoluble sulfide groups will precipitate in the sol’n. Consider the reaction H 2 S(aq) 2 H+(aq) + S 2 -(aq)

Mengapa ditambahkan thioacetamide? Thioacetamide (CH 3 CSNH 2), mrpkn sumber H 2 S krn ia akam terurai membentuk hidrogen sulfida dengan adanya asam menrt reaksi berikut CH 3 CSNH 2 + 2 H 2 O CH 3 CO 2 - + NH 4+ + H 2 S Hasil reaksi yg terjadi: Pb+2+H 2 S Pb. S(s) + 2 H+ Bi+3+3 H 2 S Bi 2 S 3(s) + 6 H+ Cu+2+H 2 S Cu. S(s) + 2 H+ Cd+2+H 2 S Cd. S(s) + 2 H+ Hg+2+H 2 S Hg. S(s) + 2 H+ 2 Sb+3+3 H 2 S Sb 2 S 3(s)+6 H+ Sn+2+2 H 2 S Sn. S(s) + 4 H+ n

Mengapa ditambahkan HNO 3 6 M? Untuk menghasilkan kation yg dikehendaki. Ini dpt dijelaskan melalui reaksi berikut : Ex. Pb. S+4 H++NO-3 Pb+2+S(s) + NO(g)+2 H 2 O n Mengapa endapan kuning harus dibuang? Krn hanya merupakan produk dr belerang Mengapa ditambahkan HCl 6 M? Utk menghasilkan endapan Pb, Pb+2 Cl- Pb. Cl 2(white) n Mengapa ditambahkan Na. OAc dan K 2 Cr. O 4 ke dalam endapan putih? Uji utk keberadaan Pb

Utk Hg, Mengapa ditambahkan HCl 6 M, HNO 3 6 M, dan 0. 1 M Sn. Cl 2? Uji identifikasi Hg. Menurut reaksi Hg(NO 3)2 + HCl Hg. Cl+HNO 3 Hg(NO 3) 2 + HCl Hg. NO 3+Sn. Cl 2 Hg 2 Cl 2+Sn(NO 3)2 n Mengapa ditambahkan 6 M NH 3 utk mendekantasi? Utk memperoleh endapan yg dikehendaki spt pd reaksi berikut: Bi+3+3 NH 3+3 H 2 O Bi(OH)3(white)+NH 4 Cu+2+2 NH 3+2 H 2 O Cu(OH)2(light blue)+2 NH 4 n +2

Mengapa ditambahkan 6 M CH 3 COOH dan K 4 Fe(CN)6? Uji identifikasi utk Cu, penambahan CH 3 COOH akan membuat larutan mjd asam. Pembentukan Fe(CN)6 dari K 4 Fe(CN)6 digunakan utk mereaksikan Cu. Tembaga(II) bereaksi dg kalium ferrocyanida dan asam (HCl encer) mjd endapan tembaga ferosianida merah bata : Cu 2+ + K 4 Fe(CN)6 → Cu 2[Fe(CN)6] Mengapa ditambahkan Na 2 S 2 O 4 dan thioacetamide? Utk uji identifikasi Cd, Na 2 S 2 O 4 bereaksi dg Cd(OH)2 melalui reaksi Cd(OH)2 + Na 2 S 2 O 4 → Cd(S 2 O 4)2+ Na. OH n

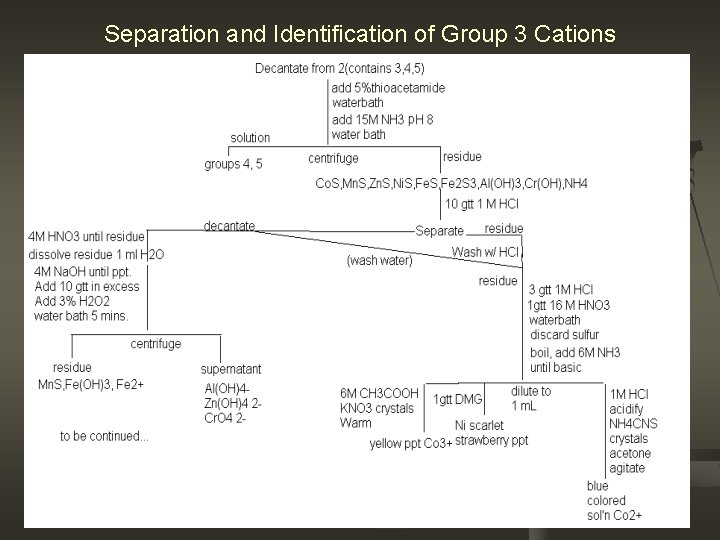
Separation and Identification of Group 3 Cations

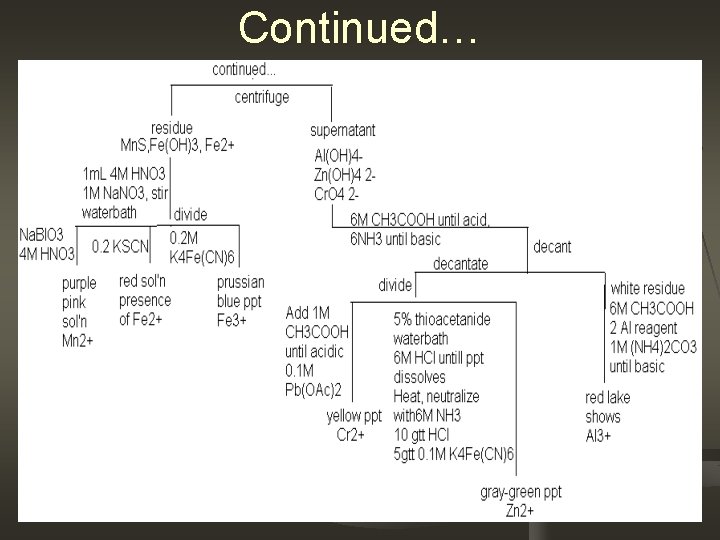
Continued…

Diskusi Mengapa ditambahkan 5% thioacetamide dan NH 3? Kation gol. III ions form sulfides that are more soluble than those of Group II, but they may be precipitated as sulfides if the sulfide concentration is sufficiently large. Addition of conc. NH 3 (aq) to the thioacetamide insures that the necessary sulfide concentration will be reached. Consider this reactions: Fe 3+ +H 2 S → Fe 3+ +S+2 H+ 2 NH 3 +H 2 S → 2 NH 4+S Ni 2+ +H 2 S → Ni. S+2 H Fe 2+ +H 2 S → Fe. S+2 H+ Mn 2+ +H 2 S → Mn. S+2 H+ Al 3+ +3 NH 3+3 H 2 O → Al(OH)3+3 NH 4 Co 2+ +H 2 S → Co. S+2 H+ Zn 2+ +H 2 S → Zn. S+2 H+ Cr 3+ +3 NH 3+3 H 2 O→ Cr(OH)3 +3 NH 4 n

Why add 1 M HCl? To separate Ni. S and Co. S to the rest because they are insoluble in HCl n Why add 1 M HCl and 16 M HNO 3? To achieve the desired cation and they are soluble in it. Consider this reaction: 3 Co. S+8 H++2 NO 3 → 3 Cu+2+3 S+2 No+4 H 2 O 3 Ni. S+8 H++2 NO 3 → 3 Ni+2+3 S+2 No+4 H 2 O n Why add DMG or dimethylgloxime? To confirm the presence of Ni. The free Ni 2+ that results is first complexed with ammonia and then detected as an insoluble, scarlet coordination compound of dimethylglyoxime (DMGH 2). The structures of DMGH 2 and the coordination compound are shown below. Note that DMGH 2 is weakly acidic and loses one of its two acidic protons in order to form an electrically neutral complex. This DMGH 2 conjugate base anion can be abbreviated DMGH- in your net reactions. Ni(NH 3)6+2 H 2 DMG →Ni(HDMG)2+4 NH 3+2 NH 4 n

Mengapa ditambahkan HCl 1 M , NH 4 CNS dan aseton? Untuk membentuk larutan yg berwarna biru sesuai dengan reaksi berikut Co 2++4 SCN- Co(SCN)42 -(lar. biru) n Mengapa ditambahkan 6 M CH 3 COOH dan KNO 3 n Utk membentuk endapan kuning yg menunjuukan adanya Co. Sesuai dg reaksi berikut Co 3++6 KNO 2 K 3 Co(NO 2)6(yellow ppt) n

Why add 4 M Na. OH and 3% H 2 O 2 To separate cations based on their properties. Consider reactions n Fe 3+ +3 OH- → Fe(OH)3 Mn 2+ +2 OH- → Mn(OH)2 Al 3+ +3 OH- → Al(OH)3 Cr 3+ +3 OH- → Cr(OH)3 Zn 2+ +2 OH- → Zn(OH)2 Adding H 2 O 2 will separate Mn and Fe from the rest Consider example reaction: Mn(OH)2+H 2 O 2→ Mn. O 2+H 2 O 2

Why add Na. BIO 3 and HNO 3? To confirm the presence of Mn. Consider reaction n Na. Bi. O 3+6 H+2 e-→Bi+Na+3 H 2 O 2 Mn 2++5 Na. Bi. O 4+14 H+→ 2 Mn. O 4+5 Bi+5 Na+7 H 2 O Why add KSCN? To confirm presence Fe 2+. Consider reaction Fe 2++2 SCN- Fe(SCN)2(red) n Why add K 4 Fe(CN)6? To confirm presence of Fe 3+ n 4 Fe 3++Fe(CN)6 Fe 4[Fe(CN)6]

Why add 6 M CH 3 COOH, Al reagent, (NH 4)2 CO 3? To form red lake which shows the presence of Al Al(OH)3+3 H →Al+3 H 2 O (NH 4)2 CO 3 → NH 3 + H 2 O + CO 2 n Why add 1 M CH 3 COOH, 0. 1 M Pb(OAc)2 To form yellow precipitate that will show the presence of Cr. Consider the reaction Pb(C 2 H 3 O 2)2+Cr. O 4→Pb. Cr. O 4+2 C 2 H 3 O 2 n Why add 5% thioacetamide, 6 M NH 3, HCl and K 4 Fe(CN)6 To show the presence of Zn. Consider the reaction 4 Zn+2 K+[Fe(CN)6]4 -→K 2 Zn 4[Fe(CN)6] n
 Analisis kation golongan 1
Analisis kation golongan 1 Tabulasi kation golongan 2
Tabulasi kation golongan 2 Golongan golongan psikotropika
Golongan golongan psikotropika Retencja
Retencja Wizanie
Wizanie Uranil magnesium asetat
Uranil magnesium asetat Diammin-dichloropalladnatý komplex
Diammin-dichloropalladnatý komplex Mechanizm sulfonowania
Mechanizm sulfonowania Kation ditunjukkan oleh
Kation ditunjukkan oleh Kwas lewisa
Kwas lewisa Ionestørrelse
Ionestørrelse Rangkaian sekuensial
Rangkaian sekuensial Analisis tows
Analisis tows Analisa gas darah
Analisa gas darah Analisis vitamin larut air
Analisis vitamin larut air Metode analisa gravimetri
Metode analisa gravimetri Analisis persoalan potensial
Analisis persoalan potensial Rumus clapeyron
Rumus clapeyron Contoh soal analisis perubahan laba kotor
Contoh soal analisis perubahan laba kotor Contoh kasus analisis komparatif
Contoh kasus analisis komparatif Pengertian analisis situasi
Pengertian analisis situasi Example of syntax analysis
Example of syntax analysis Siklus analisa keputusan
Siklus analisa keputusan Contoh tabel univariat
Contoh tabel univariat Perhitungan titrimetri
Perhitungan titrimetri Analisa multivariat adalah
Analisa multivariat adalah Kurva expansion path
Kurva expansion path Analisa dan desain rangkaian sekuensial
Analisa dan desain rangkaian sekuensial Ruang lingkup analisa pasar
Ruang lingkup analisa pasar Laporan sumber dan penggunaan kas
Laporan sumber dan penggunaan kas