WYKAD VI A Odwracalne i nieodwracalne ogniwa elektryczne












- Slides: 22

WYKŁAD VI A. Odwracalne i nieodwracalne ogniwa elektryczne (baterie, akumulatory). Magazynowanie dużych gęstości energii. B. B. Materiały magazynujące ładunek elektryczny. Magazynowanie dużych gęstości ładunków. Superkondensatory i ferroelektryki. Membrany i superprzewodniki jonów. C. C. Rodzaje elektrycznych właściwości materii: izolatory, półprzewodniki, metale, półmetale, nadprzewodniki. D. D. Nadprzewodnictwo nisko– i wysokotemperaturowe. Oporność materii dla stałego i zmiennego prądu. Procesory komputerów przyszłości. Magazynowanie energii w postaci pola magnetycznego.

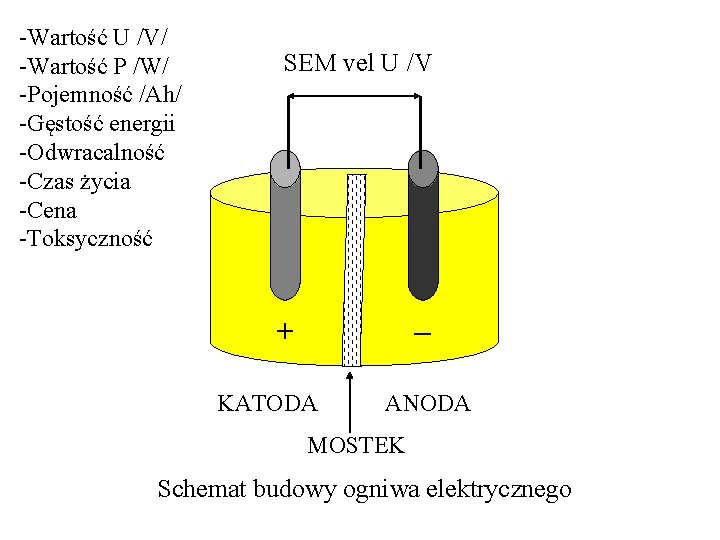
-Wartość U /V/ -Wartość P /W/ -Pojemność /Ah/ -Gęstość energii -Odwracalność -Czas życia -Cena -Toksyczność SEM vel U /V + – KATODA ANODA MOSTEK Schemat budowy ogniwa elektrycznego

Ogniwa nieodwracalne koniec XVIII w. – Luigi Galvani, Alessandro Volta, pierwsze doświadczenia elektrycznością zwierzęcą i ludzką 1800 –Volta, stos elektrod: Ag|wilgotny karton nasączony solanką|Zn 1800 – Humphrey Bartholomew Davy, H 2 SO 4 zamiast solanki 1802 – Johann Wilhelm Ritter, suche ogniwo galwaniczne (ogniwo Volty wysychało!), następcza elektroliza wody 1833 -34 – Michael Faraday, prawa elektrolizy 1835 – John Daniell, klasyczne ogniwo Cu|Cu. SO 4||Zn. SO 4|Zn 1841 – Robert Wilhelm Bunsen, Zn|Zn. SO 4, HNO 3|C 1872 – Josiah Latimer Clark, Zn(Hg)|Zn. SO 4|Hg. SO 4, Hg 1877 – Leclanche, modyfikacje Fery’ego, ogniwo C|Mn. O 2, NH 4 Cl|Zn 1893 – E. Weston, Cd(Hg)|Cd. SO 4|Hg. SO 4, Hg 1912 – Gilbert Newton Lewis, ogniwo litowe: Li|S(c)|Cu. S; k. Wh na 1 kg ogniwa 1967 – Ford Motor Co. ogniwo Na(c) (100 o. C)|S(c) (120 o. C), (Na 2 O x 11 Al 2 O 3) Dzisiaj – Li|SOCl 2|C, 3. 6 V, 1. 86 k. Wh/kg, 25 lat życia (rozruszniki serca), XXI w. – ? ? ? nad

Ogniwa odwracalne 1859 – Gaston Planté, akumulator ołowiowy Pb|H 2 SO 4|Pb. O 2 1899 – Waldemar Junger, akumulator Ni/Cd: Ni, Ni. O(OH)|Na. OH|Cd(OH)2, Cd 1904 – Thomas Alva Edison, akumulator Fe/Ni: Fe|KOH|Ni(OH)3 1988 – Akumulator wanadowy, V(V)+V(II) V(III)+V (IV) Australia (patent USA) 1990 – Akumulator Ni/MH, komercjalizacja Sanyo Electric, La. Ni 5 1991 – Akumulator Lit/jon, komercjalizacja Sony, interkalacja Li w tlenki metali przejściowych 1997 – Akumulator organiczny (polifenylotiofen) 1999 – Akumulator Li/polimer, komercjalizacja Valence Technology XXI w. – ? ? ?

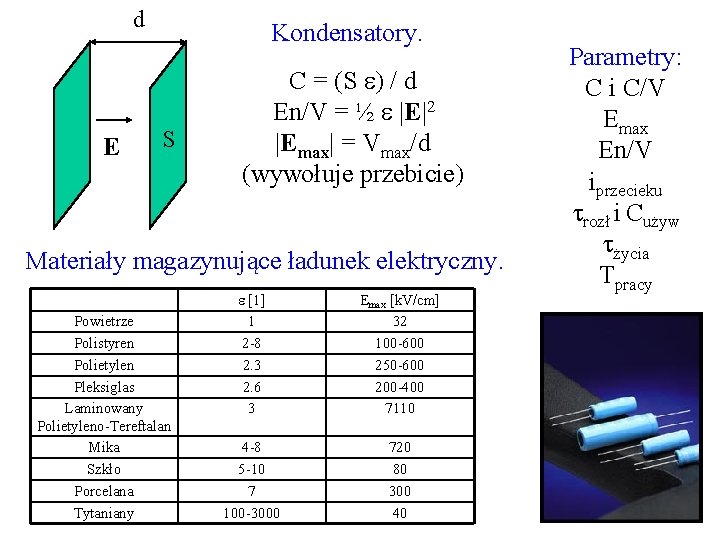
d E Kondensatory. S C = (S ) / d En/V = ½ |E|2 |Emax| = Vmax/d (wywołuje przebicie) Materiały magazynujące ładunek elektryczny. Powietrze Polistyren Polietylen Pleksiglas Laminowany Polietyleno-Tereftalan Mika Szkło Porcelana Tytaniany [1] 1 2 -8 2. 3 2. 6 3 Emax [k. V/cm] 32 100 -600 250 -600 200 -400 7110 4 -8 5 -10 7 100 -3000 720 80 300 40 Parametry: C i C/V Emax En/V iprzecieku rozł i Cużyw życia Tpracy

Magazynowanie dużych ładunków i dużych gęstości obj. ład. Superkondensatory (> 1 F). - Magazynują do 2000 x więcej dużych gęstości obj. ładunków niż tradycyjne aluminiowe kondensatory elektrolityczne. - “Supercapacitors” są zdolne do szybkiego ładowania i rozładowania, i znoszą wiele takich cykli bez szkody dla pojemności. - Służą w wojsku do rozruchu silników, a nawet jako backup do zasilania rakiet - Służą jako UPS, oraz dla telefonów komórkowych

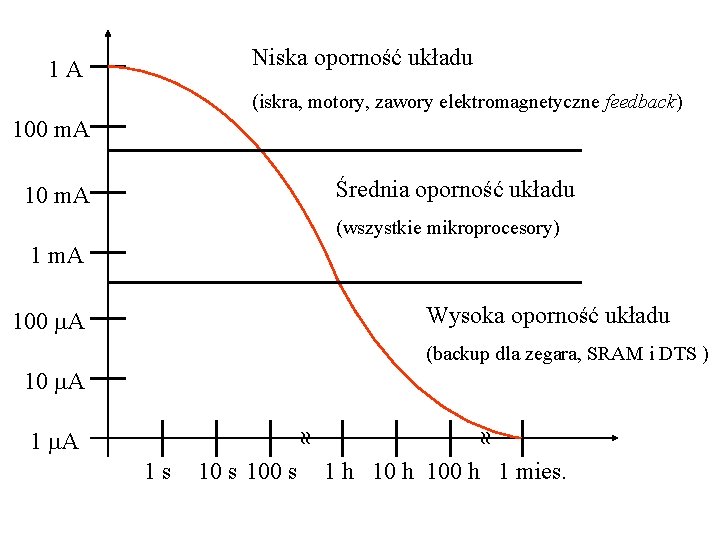
Niska oporność układu 1 A (iskra, motory, zawory elektromagnetyczne feedback) 100 m. A Średnia oporność układu 10 m. A (wszystkie mikroprocesory) 1 m. A Wysoka oporność układu 100 A (backup dla zegara, SRAM i DTS ) 10 A 1 s 100 s 1 A 1 h 100 h 1 mies.

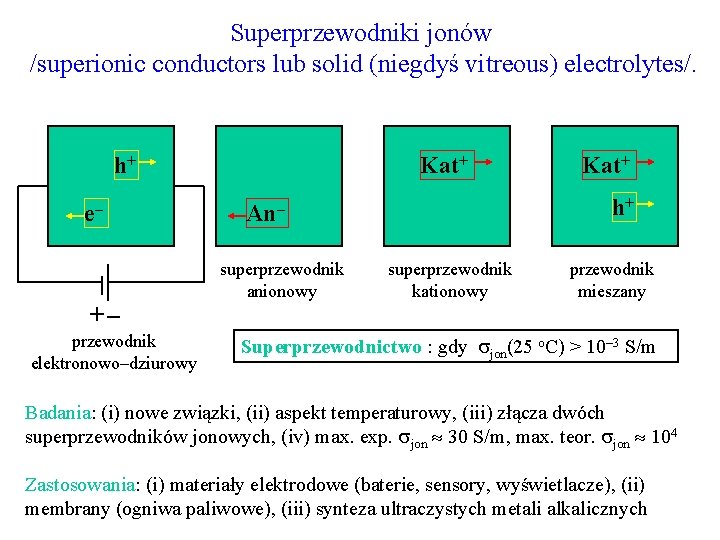
Superprzewodniki jonów /superionic conductors lub solid (niegdyś vitreous) electrolytes/. h+ e– Kat+ h+ An– superprzewodnik anionowy Kat+ superprzewodnik kationowy przewodnik mieszany +– przewodnik elektronowo–dziurowy Superprzewodnictwo : gdy jon(25 o. C) > 10– 3 S/m Badania: (i) nowe związki, (ii) aspekt temperaturowy, (iii) złącza dwóch superprzewodników jonowych, (iv) max. exp. jon 30 S/m, max. teor. jon 104 Zastosowania: (i) materiały elektrodowe (baterie, sensory, wyświetlacze), (ii) membrany (ogniwa paliwowe), (iii) synteza ultraczystych metali alkalicznych

H+ : KHSO 4, Cs 2(HSO 4)(H 2 PO 4), HPb 2 Nb 3 O 10 F– : Pb. F 2, Cs. Pb. F 3, Tl. F, Ag. F, Pb. Sn. F 4 and KBi. F 4, Ca. F 2: Y O 2–: M 4+O 2 oraz perowskity A 2+M 4+O 3, M = Ti, Zr, Ce, Ba 2 In 2 O 5, La 0. 9 Sr 0. 1 Ga 0. 8 Mg 0. 8 O 2. 85, domieszkowany Bi 4 V 2 O 11 and Sr. Fe. Co 0. 5 Ox, Ba. Bi 3 O 5. 5, Bi 2 WO 6 Li+: Li 3 N, Li 3 M 2(PO 4)3 (M=Sc, Fe), Lix. Co. O 2 (elektronowo–jonowy) Na+: Na 3 Zr 2 Si 2 PO 12, Na 5 YSi 4 O 12, Na. Ti 2 Al 5 O 12 K+ : KTi. OPO 4: Nb NH 4+: NH 4 Ta. WO 6 Mg 2+: Mg 3 Bi 2 Ag+: Ag. X (X = Cl, Br, I), Ag 4 Rb. I 5 intrinsic anion lattice soft disorder & intrinsic defects KTi. OPO 4: Nb = K 1–x. Ti 1–x. Nbx. OPO 4, brakujące (K+) Ca. F 2: Y = (Ca. F 2)1–x(YF 3)x, nadmiarowe F–

Nadprzewodnictwo /superconductivity/ Nadprzewodnik – pierwiastek lub związek chemiczny który przewodzi prąd stały (DC) bez żadnych strat (oporność jest zerowa lub tak mała, ze niemierzalna) poniżej pewnej temperatury zwanej temperaturą krytyczną (TC); oporność dla prądu zmiennego jest bardzo mała, lecz mierzalna, i zwiększa się ze wzrostem częstości prądu AC

Efekt Meissnera–Ochsenfelda – wypychanie zewnętrznego pola magnetycznego poza objętość nadprzewodnika (nazwywana często idealnym diamagnetyzmem), z powodu istnienia powierzchniowych prądów nadprzewodzacych; to może prowadzić do lewitacji nadprzewodnika nad magnesem isurf BSC Bext

Zwięzła Historia Nadprzewodnictwa • 1911 Holenderski fizyk Heike Kamerlingh Onnes z Leiden odkrywa nadprzewodnictwo w Hg @ 4 K (NN 1913) • 1933 Walter Meissner i Robert Ochsenfeld odkrywają efekt idealnego diamagnetyzmu (efekt M-O) • 1941 Nb. N nadprzewodzi w 16 K • 1957 John Bardeen, Leon Cooper, i John Schrieffer formułują teorię BCS (NN 1972) • 1962 • 1964 • 1973 • 1980 Brian D. Josephson, student z Uniw. Cambridge, przewidział efekt prądów tunelowych (efekt Josephsona) (NN 1973) Bill Little z Uniw. Stanford zasugerował istnienie organicznych nadprzewodników Art Sleight z f-my Du. Pont odkrywa Ba(Pb, Bi)O 3 (TC = 13 K) Klaus Bechgaard z Uniw. w Kopenhadze zsyntezował nadprzewodzący (TMTSF)2 PF 6, potwierdzając przewidywania Little’a

• 1986 • 1987 • 1989 • 1991 Alex Müller i Georg Bednorz (IBM, Szwajcaria) odkryli ceramiczny tlenek Cu z TC = 30 K (NN 1987) Zespół z Uniw. Alabama-Huntsville odkrywa YBCO (92 K) Odkrycie domieszkowanego elektronami (n-) a nie dziurami (p-) NCCO (10 K) Robert Haddon (Bell Labs) odkrył K 3 C 60 (18 K) Smith et al. oraz Er et al. odkrywają dopowane elektronami związki infinite-layer Sr 1–x. Lax. Cu. O 2 (40 K) oraz Sr 1–x. Lax. Cu. O 2 (43 K) • 1992 Azuma et al. odkrywają pierwszy dopowany dziurami i-l Ca 1–x. Srx. Cu. O 2 (110 K) • 1994 C. W. Chu et al. : Hg. Ba 2 Cu 3 O 8+x @ 166 K (– 107 o. C) (aktualny rekord pod wysokim ciśnieniem) • 1994 Almamouri et al. odkrywa Sr 2 Cu. O 2 F 2+x (46 K) (apical O) • 1995 Hg 0. 8 Tl 0. 2 Ba 2 Cu 3 O 8. 33 @ 138 K (aktualny rekord pod normalnym ciśnieniem) • 2001 -2 Mg. B 2 nadprzewodzi w 39 K (J. Akimitsu et al. ) • 2002 Li nadprzewodzi w 20 K w ciśnieniach GPa (V. Struzhkin et al. ) • 2002 Afera Schön’a: SCs ze “wstrzykniętym ładunkiem” i inne “nano–odkrycia” … • 2011 RT SC ? Nobel Prize ? temperature–enforced SC ? Non–crystalline materials ?



Dlaczego to jest ważne? Użycie nadprzewodników. Sny ludzkości i wizja futurystyczna. • Transport dużych gęstości prądu: (i) Linie przesyłowe (straty energii od 30% do 50% przy użyciu standardowych kabli), silniki elektryczne, transformatory (ii) Czystsza planeta (iii) Roczne oszczędności $ 250 mld USA i $ 6 mld Polska • Wytwarzanie silnych pól magentycznych (spektroskopia, medycyna, transport kolejowy) • Magazynowanie energii (stabilizatory mocy) • Ultraszybkie procesory (do 1000 GHz); pierwszy SC procesor nadprzewodzący 1 GHz 1988, klasyczny 2000 • SQUID do detekcji ultramałych pól magnetycznych $$$ rez=(R 2+L 2 C 2)–½ R=0


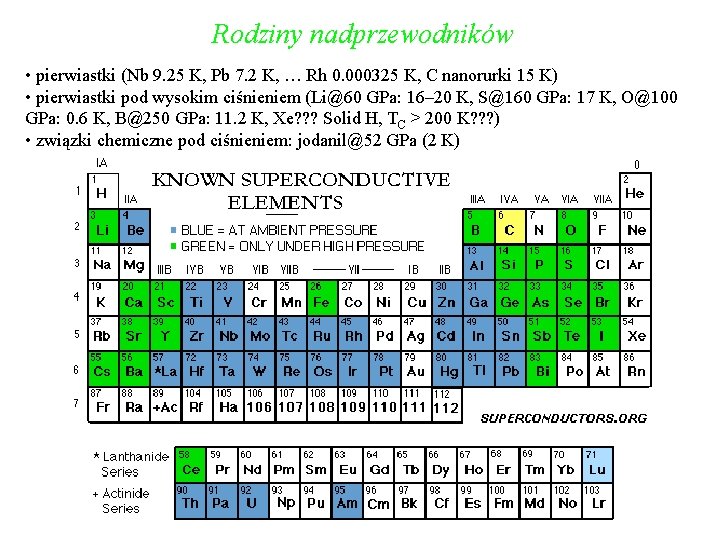
Rodziny nadprzewodników • pierwiastki (Nb 9. 25 K, Pb 7. 2 K, … Rh 0. 000325 K, C nanorurki 15 K) • pierwiastki pod wysokim ciśnieniem (Li@60 GPa: 16– 20 K, S@160 GPa: 17 K, O@100 GPa: 0. 6 K, B@250 GPa: 11. 2 K, Xe? ? ? Solid H, TC > 200 K? ? ? ) • związki chemiczne pod ciśnieniem: jodanil@52 GPa (2 K)

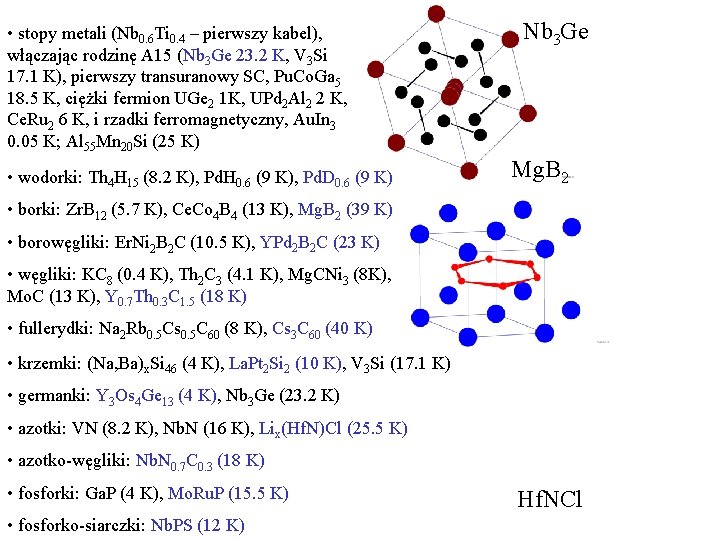
• stopy metali (Nb 0. 6 Ti 0. 4 – pierwszy kabel), włączając rodzinę A 15 (Nb 3 Ge 23. 2 K, V 3 Si 17. 1 K), pierwszy transuranowy SC, Pu. Co. Ga 5 18. 5 K, ciężki fermion UGe 2 1 K, UPd 2 Al 2 2 K, Ce. Ru 2 6 K, i rzadki ferromagnetyczny, Au. In 3 0. 05 K; Al 55 Mn 20 Si (25 K) • wodorki: Th 4 H 15 (8. 2 K), Pd. H 0. 6 (9 K), Pd. D 0. 6 (9 K) Nb 3 Ge Mg. B 2 • borki: Zr. B 12 (5. 7 K), Ce. Co 4 B 4 (13 K), Mg. B 2 (39 K) • borowęgliki: Er. Ni 2 B 2 C (10. 5 K), YPd 2 B 2 C (23 K) • węgliki: KC 8 (0. 4 K), Th 2 C 3 (4. 1 K), Mg. CNi 3 (8 K), Mo. C (13 K), Y 0. 7 Th 0. 3 C 1. 5 (18 K) • fullerydki: Na 2 Rb 0. 5 Cs 0. 5 C 60 (8 K), Cs 3 C 60 (40 K) • krzemki: (Na, Ba)x. Si 46 (4 K), La. Pt 2 Si 2 (10 K), V 3 Si (17. 1 K) • germanki: Y 3 Os 4 Ge 13 (4 K), Nb 3 Ge (23. 2 K) • azotki: VN (8. 2 K), Nb. N (16 K), Lix(Hf. N)Cl (25. 5 K) • azotko-węgliki: Nb. N 0. 7 C 0. 3 (18 K) • fosforki: Ga. P (4 K), Mo. Ru. P (15. 5 K) • fosforko-siarczki: Nb. PS (12 K) Hf. NCl

• siarczki: Pb. Mo 6 S 8 (14. 6 K), Pb. Mo. S 3 (15 K) • selenki: Nb 2 Se 3 (2 K), Mo 3 Se 4 (5. 8 K) • tellurki: Cu. Te 2 (1. 2 K), Pd. Te (4 K) • fluorki: Ag 2 F (0. 06 K, warstwy Ag są SC), Hgn. As. F 6 (4 K, łańcuchy Hg czy metaliczna Hg? ) • chlorki, bromki: Y 2 C 2 X 2 (10 K) • jodki: Sm. I 2 (2 K) • tlenki: Sr 1–x. Ti. O 3 (0. 2 K), Ti. O (0. 8 K), Sr 2 Ru. O 4 (1. 35 K), Mx. WO 3 (do 5. 4 K), Ba(Pb, Sb)O 3 (2. 8 K), Ba (Pb, Bi)O 3 (13 K), (Ba, K)Bi. O 3 (26 K), Sr 2 YRu 0. 85 Cu 0. 15 O 6–x (30 K) i tlenki miedzi (oxocuprates): A. h+-doped La 1. 85 Ba. 15 Cu. O 4 36 K, Hg 0. 8 Tl 0. 2 Ba 2 Cu 3 O 8. 33 138 K, Tl 2 Ba 2 Cu 3 O 10 127 K, Bi 2 Sr 2 Ca 2 Cu 3 O 10 110 K, Hg. Ba 2 Cu. O 4+x 94 -98 K B. e–-doped (Nd, Ce)2 Cu. O 4 10 K, (Nd, Sr, Ce)2 Cu. O 4 35 K, C. infinite layer (Ba, Sr)Cu. O 2 90 K, Ca 1 -x. Srx. Cu. O 2 110 K (h+); Sr 0. 9 La 0. 1 Cu. O 2 43 K (e–) D. oxochlorki, oxofluorki (bez apical O’s): (Sr, Ca)3 Cu 2 O 4+delta. Cl 2–y 80 K, (Ca, Na)2 Cu. O 2 Cl 2 28 K, Sr 2 Cu. O 2 F 2+x 46 K • organiczne: Me. Se. Fulvalene (1. 2 K), (BEDT-TTF)Cu[N(CN)2]Br (12 K), poly-(SN) 0. 33 K

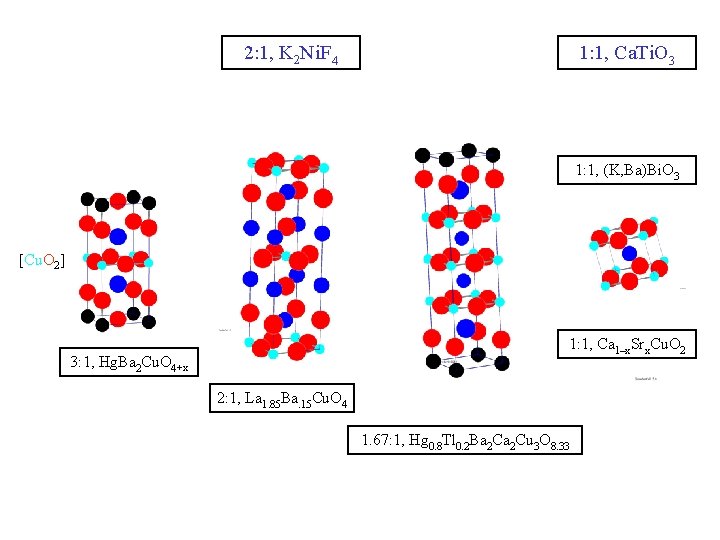
2: 1, K 2 Ni. F 4 1: 1, Ca. Ti. O 3 1: 1, (K, Ba)Bi. O 3 [Cu. O 2] 1: 1, Ca 1–x. Srx. Cu. O 2 3: 1, Hg. Ba 2 Cu. O 4+x 2: 1, La 1. 85 Ba. 15 Cu. O 4 1. 67: 1, Hg 0. 8 Tl 0. 2 Ba 2 Cu 3 O 8. 33

Intuicja Müller’a – propagujące się zabrzenie (tzw. polaron Jahna–Tellera, h+) La. III 2 Cu. IIO 4 La. III(2–x)Ba. IIx. Cu. II(1 – x)Cu. IIIx. O 4 W rzeczywistości…dziury wchodzą do pasma tlenowego i parują się w parę Coopera, ale… Dokonano cudownego odkrycia na bazie złego założenia!