Vstup VY52INOVACECH 8 21 Vukov materil zpracovan v








- Slides: 11

Výstup: VY_52_INOVACE_CH. 8. 21 Výukový materiál zpracovaný v rámci projektu INTERAKTIVNÍ VÝUKA V ZŠ KOVÁŘOV Registrační číslo projektu: CZ. 1. 07/1. 4. 00/21. 1035 Šablona: Přírodní vědy Vzdělávací oblast: Člověk a příroda Sada: 2 A Ročník: 8. Vzdělávací obor: Chemie CHEMICKÁ VAZBA Cíl: seznámení se vznikem, druhy vazeb Autor: Mgr. Marcela Timoranská Škola: ZŠ Kovářov, okres Písek

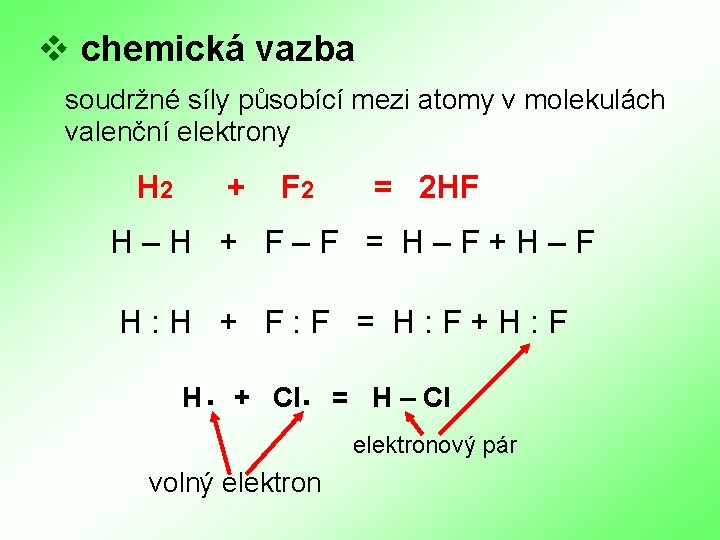
v chemická vazba soudržné síly působící mezi atomy v molekulách valenční elektrony H 2 + F 2 = 2 HF H – H + F – F = H – F + H – F H : H + F : F = H : F + H : F H . + Cl. = H – Cl elektronový pár volný elektron

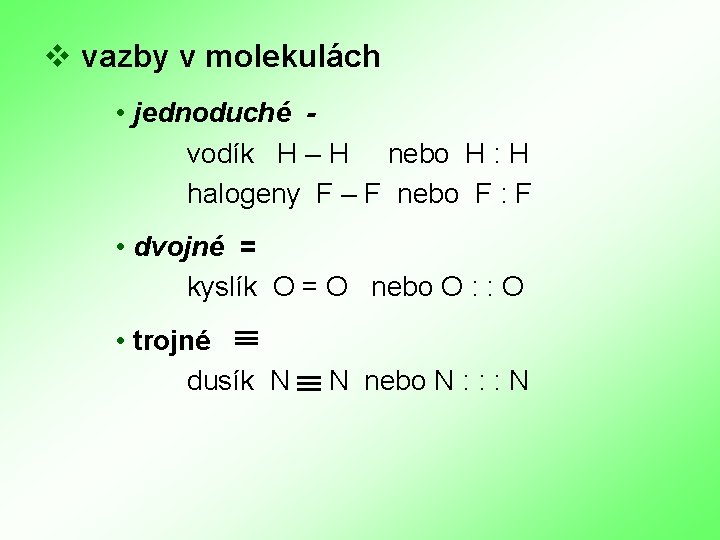
v vazby v molekulách • jednoduché vodík H – H nebo H : H halogeny F – F nebo F : F • dvojné = kyslík O = O nebo O : : O • trojné dusík N N nebo N : : : N

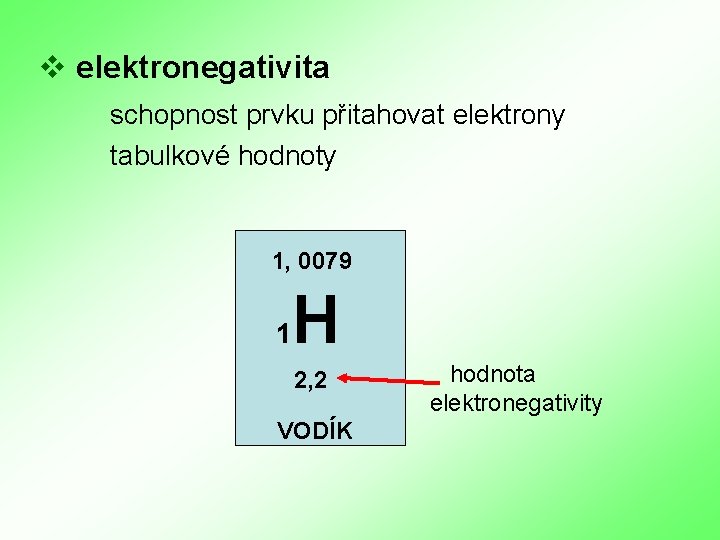
v elektronegativita schopnost prvku přitahovat elektrony tabulkové hodnoty 1, 0079 1 H 2, 2 VODÍK hodnota elektronegativity

v dohledejte hodnoty elektronegativty: fluor 4, 1 kyslík 3, 5 dusík 3, 1 uhlík 2, 5 chlor 2, 8 síra 2, 4

v druhy vazeb ü kovalentní (nepolární) vazba mezi atomy téhož prvku nebo rozdíl elektronegativity od 0 do 0, 4 př. molekula fluoru F 2 elektonový pár leží uprostřed mezi atomy F – F F :

ü polární vazba elektronový pár je přitahován atomem s větší elekronegativitou atom s větší elektronegativitou = záporný náboj atom s menší elektronegativitou = kladný náboj rozdíl elektronegativity od 0, 4 do 1, 7 př. molekula vody H 2 O elektonový pár se posouvá ke kyslíku + - + H : O : H

üiontová vazba rozdíl elektronegativity je větší než 1, 7 př. molekula chloridu sodného Na. Cl elektonový pár se posouvá do elektronového pole chloru + Na : Cl -

v výpočet druhy vazby dopočti druh vazby v molekule kys. chlorovodíkové HCl H = 2, 2 Cl = 2, 8 HCl = 2, 8 – 2, 2 = 0, 6 vazba polární dopočti druh vazby v molekule amoniaku NH 3 H = 2, 2 N = 3, 1 NH 3 = 3, 1 – 2, 2 = 0, 9 vazba polární

dopočti druh vazby v molekule: CS 2 = 2, 5 – 2, 4 = 0, 1 vazba kovalentní KCl = 2, 8 – 0, 9 = 1, 9 vazba iontová HBr = 2, 7 – 2, 2 = 0, 5 vazba iontová Ca. F 2 = 4, 1 – 1, 0 = 3, 1 vazba iontová O 2 = 3, 5 – 3, 5 = 0 vazba kovalentní CO 2 = 3, 5 – 2, 5 = 1, 0 vazba polární

POUŽITÉ ZDROJE: • BENEŠ, Pavel; PUMPR, Václav; BANÝR, Jiří. Základy chemie 1. Praha : RORTUNA, 1993. Co spojuje atomy prvků? s. 140.




















