UNIVERSIDAD AUTNOMA DEL ESTADO DE MXICO Unidad Acadmica



















- Slides: 31

UNIVERSIDAD AUTÓNOMA DEL ESTADO DE MÉXICO Unidad Académica Profesional Acolman Licenciatura en Ingeniería Química Unidad de aprendizaje: Química Analítica Instrumental MTRA. BLANCA GABRIELA CUEVAS GONZALEZ Agosto 2018

Objetivos de la unidad de aprendizaje • Aplicar los fundamentos del funcionamiento de las técnicas tradicionales del análisis instrumental, para la selección de los métodos instrumentales de análisis más frecuentes en la resolución de problemas relacionados con las ciencias de la ingeniería y aplicables a la industria; promoviendo el desarrollo de habilidades para el uso de TIC´s y software y trabajo en el laboratorio, así como la calidad en el trabajo, actuando con responsabilidad social y con una visión de sustentabilidad.

UNIDAD II : Metodos electroqumicos Objetivo de la unidad Examinar los fundamentos de los métodos analíticos electroquímicos, los conceptos que establecen su clasificación y las aplicaciones que tienen dentro de la industria química

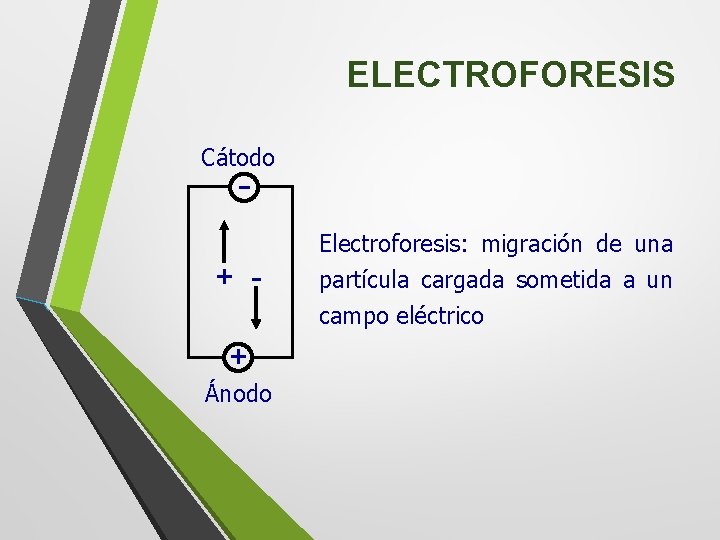
2. 1. 4 Electroforesis Presentación: Técnica mediante la cual se separan las biomoléculas en disolución cuando se ven sometidas a un campo eléctrico. Cada molécula se desplaza por efecto del campo, alcanzando rápidamente una velocidad constante al equilibrarse la fuerza impulsora (fuerza del campo eléctrico) con la resistencia al avance (fuerza de fricción o rozamiento) impuesta por el medio en el que se desplaza.

ELECTROFORESIS Cátodo - + + Ánodo Electroforesis: migración de una partícula cargada sometida a un campo eléctrico

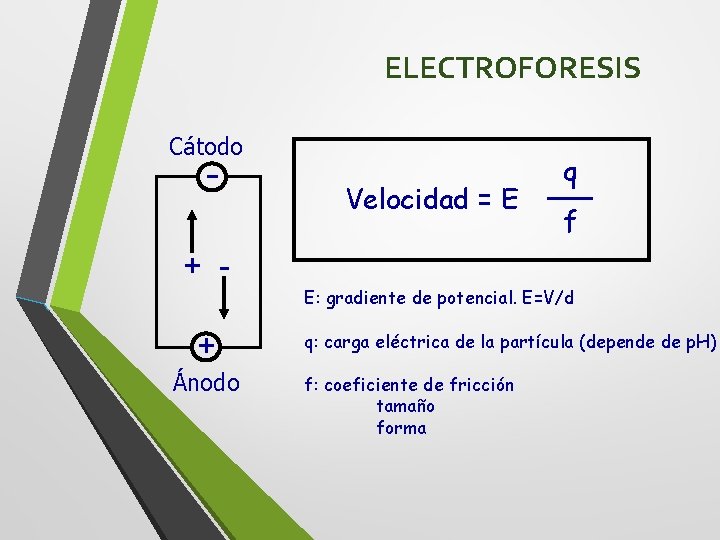
ELECTROFORESIS Cátodo - Velocidad = E q f + E: gradiente de potencial. E=V/d + Ánodo q: carga eléctrica de la partícula (depende de p. H) f: coeficiente de fricción tamaño forma

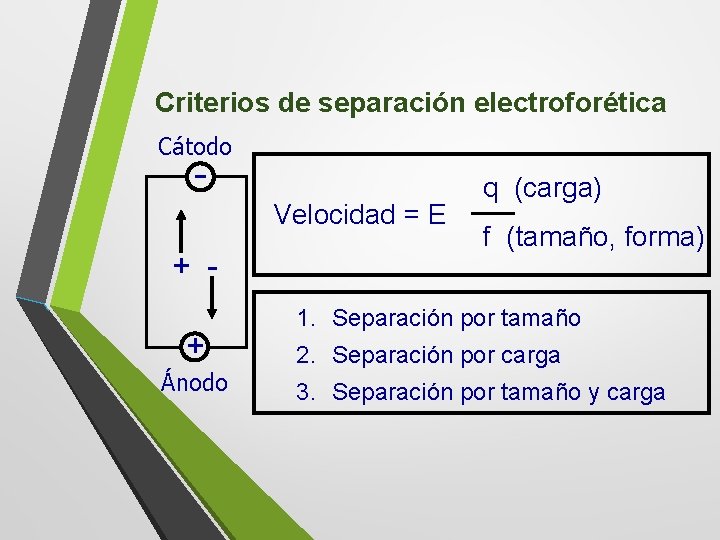
Criterios de separación electroforética Cátodo - Velocidad = E + + Ánodo q (carga) f (tamaño, forma) 1. Separación por tamaño 2. Separación por carga 3. Separación por tamaño y carga

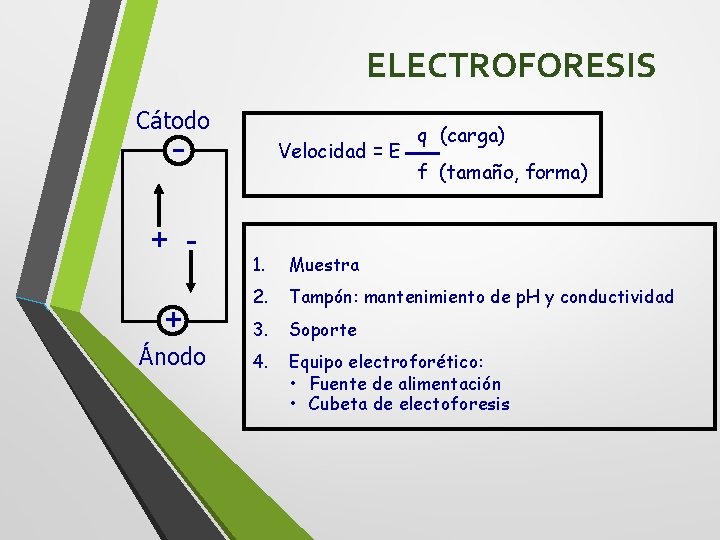
ELECTROFORESIS Cátodo - + + Ánodo Velocidad = E q (carga) f (tamaño, forma) 1. Muestra 2. Tampón: mantenimiento de p. H y conductividad 3. Soporte 4. Equipo electroforético: • Fuente de alimentación • Cubeta de electoforesis

EQUIPOS ELECTROFORÉTICOS

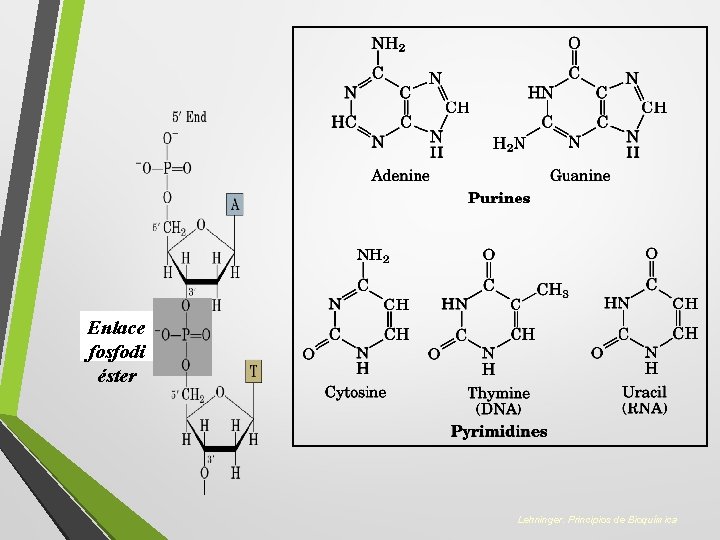
Carga eléctrica de la biomoléculas 1. Ácidos nucleicos 2. Proteínas

Enlace fosfodi éster Lehninger. Principios de Bioquímica


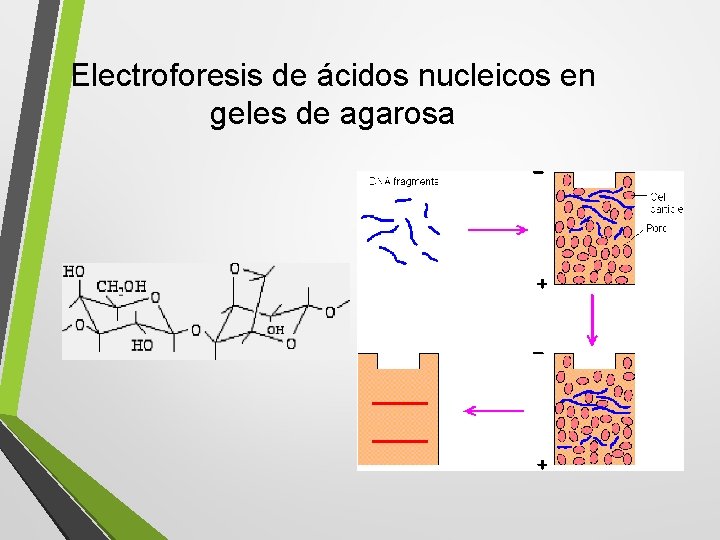
Electroforesis de ácidos nucleicos en geles de agarosa

Electroforesis de ácidos nucleicos en geles de agarosa DNA viral DNA genómico RNA

ELECTROFORESIS MICROCAPILAR (bioanalyzer(r)) Lab-on-a-Chip: electroforesis miniaturizada y automatizada

ELECTROFORESIS MICROCAPILAR (Bioanalyzer(R))

Electroforesis de ácidos nucleicos en geles de agarosa 1. 2. DNA hebra doble: condiciones no desnaturalizantes • Tampón: Tris/Borato/EDTA (TBE) o Tris/Acetato/EDTA (TAE) • Muestra: TBE o TAE, Glicerol, Azul de bromofenol RNA, DNA hebra simple: condiciones desnaturalizantes • Tampón: MOPS + formaldehído • Muestra: Formamida, Azul de bromofenol

Electroforesis de DNA en geles de agarosa SSCP: single-strand conformation polymorphism

ELECTROFORESIS DE CAMPO PULSANTE (PFGE) Rotating gel electrophoresis (RGE) separation of 3000 to 6000 kb DNA Schizosaccharomyces pombe chromosomes. Run conditions: 50 V, 1. 4 V/cm, 100 hrs, 100 angle, concatamated multiple runs: 2500 sec. /50 hrs, 3000 sec. /50 hrs, 0. 5 X TBE, 0. 8% megarose (Clontech), 10 C.

ELECTROFORESIS DE CAMPO PULSANTE (PFGE) Rotating gel electrophoresis (RGE) separation Saccharomyces cercevisiae chromosomes (245 -2190 kb). Run conditions: 180 V, 5. 1 V/cm, 34 hrs. , 120 angle, 60 -120 sec. pulse ramp, 0. 5 X TBE, 1. 2% GTG agarose, 10 C. Two combs were used on the same gel to load 32 samples, a maximum of 72 are possible

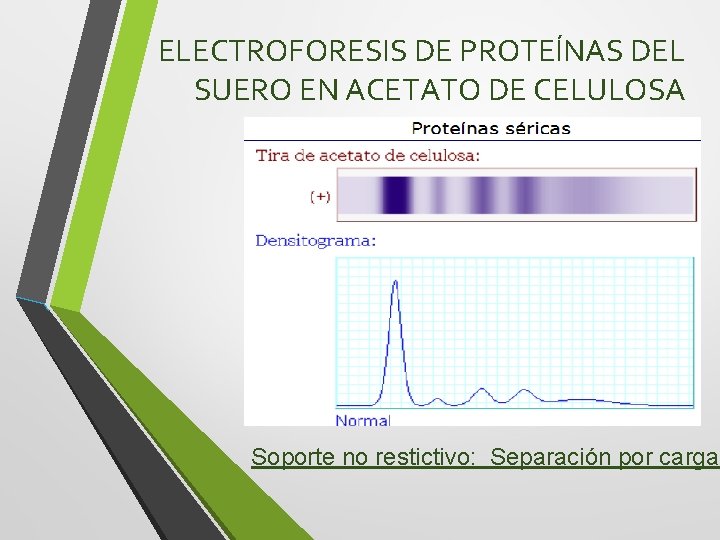
ELECTROFORESIS DE PROTEÍNAS DEL SUERO EN ACETATO DE CELULOSA Soporte no restictivo: Separación por carga

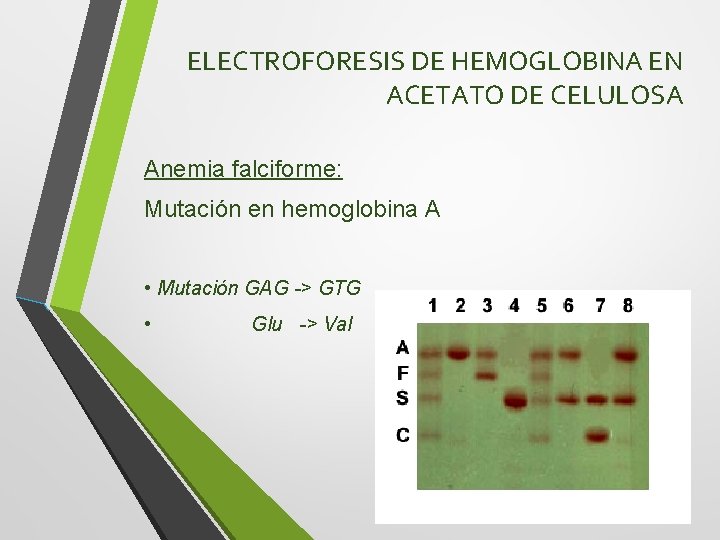
ELECTROFORESIS DE HEMOGLOBINA EN ACETATO DE CELULOSA Anemia falciforme: Mutación en hemoglobina A • Mutación GAG -> GTG • Glu -> Val

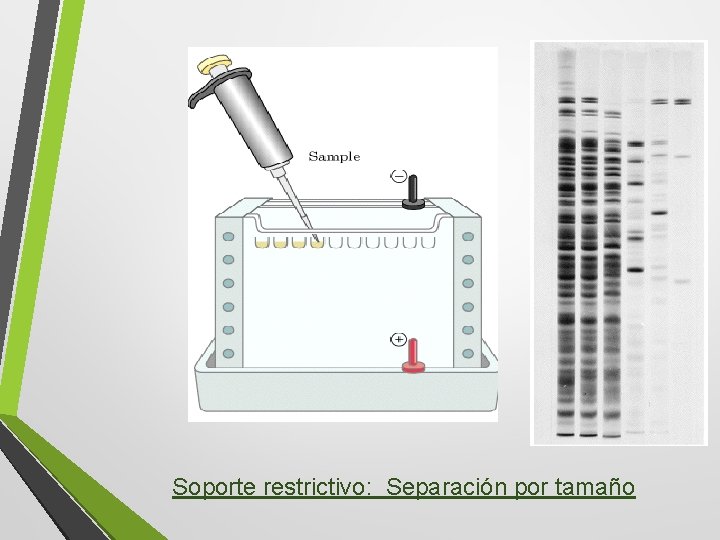
Soporte restrictivo: Separación por tamaño


ELECTROFORESIS DE PROTEÍNAS EN GELES DE POLIACRILAMIDA CON SDS (SDS-PAGE) • Concentración de poliacrilamida • Homogénea • Gradiente • Tampón de muestra • Reductor (2 -mercaptoetanol) • No reductor • Detección de las proteínas separadas • Tinción (Azul Coomassie, sales de plata) • Fluorescencia • Inmunodetección


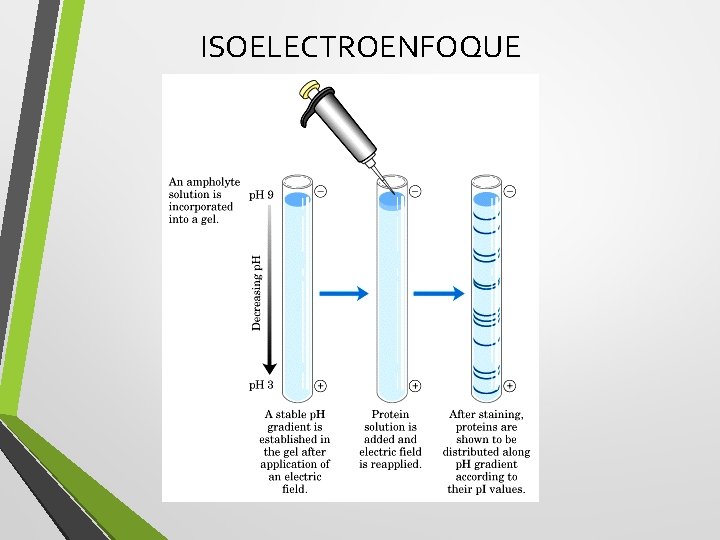
ISOELECTROENFOQUE

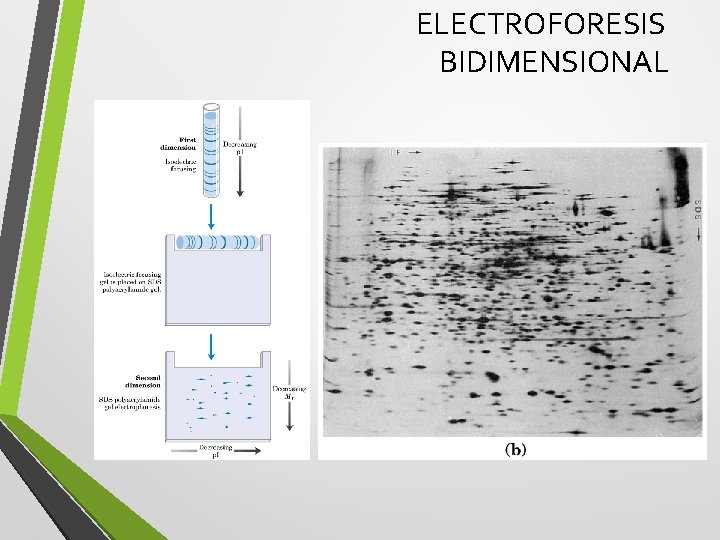
ELECTROFORESIS BIDIMENSIONAL


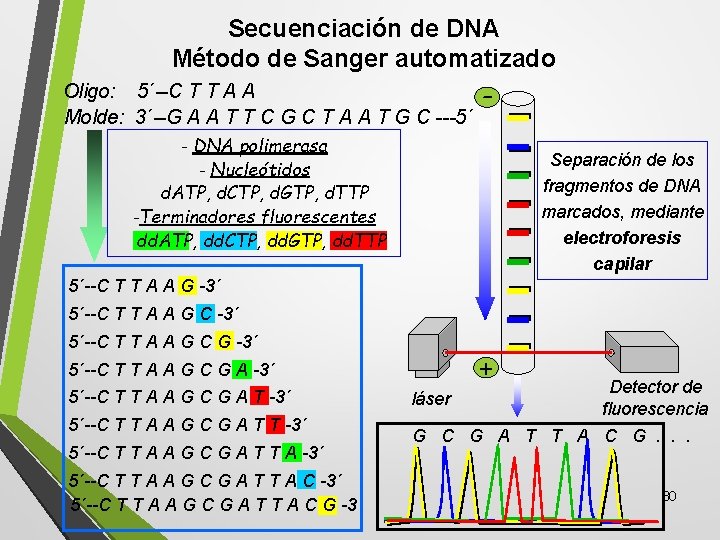
Secuenciación de DNA Método de Sanger automatizado Oligo: 5´--C T T A A Molde: 3´--G A A T T C G C T A A T G C ---5´ - - DNA polimerasa - Nucleótidos d. ATP, d. CTP, d. GTP, d. TTP -Terminadores fluorescentes dd. ATP, dd. CTP, dd. GTP, dd. TTP Separación de los fragmentos de DNA marcados, mediante electroforesis capilar 5´--C T T A A G -3´ 5´--C T T A A G C G -3´ + 5´--C T T A A G C G A -3´ 5´--C T T A A G C G A T T A C -3´ 5´--C T T A A G C G A T T A C G -3´ láser Detector de fluorescencia G C G A T T A C G. . . 30

Referencias Willard H. H. , Merritt L. L. , Dean J. A. y Settle, F. A. . , Métodos Instrumentales de Análisis, Continental, 1999 Rubinson K. A. Y Rubinson J. F. , Análisis Instrumental Editorial Prentice Hall, 2000 http: //biomodel. uah. es/tecnicas/elfo/inicio. htm http: //biomodel. uah. es/biomodel-misc/anim/elfo/electrof. html
 Estadio azteca mapa virtual
Estadio azteca mapa virtual Google academico
Google academico Acadmica
Acadmica Tudo dentro do estado nada fora do estado
Tudo dentro do estado nada fora do estado Decena centena unidad
Decena centena unidad Fuerzas impulsoras
Fuerzas impulsoras Maqueta del estado del agua
Maqueta del estado del agua Fase hermeneutica del estado del arte
Fase hermeneutica del estado del arte Universidad del este cabo rojo
Universidad del este cabo rojo Universidad tecnologica del usumacinta
Universidad tecnologica del usumacinta Universidad europea biblioteca
Universidad europea biblioteca Clasificacion histologica de nefritis lupica
Clasificacion histologica de nefritis lupica Logo universidad maritima del caribe
Logo universidad maritima del caribe Universidad del cema
Universidad del cema Universidad latinoamericana colonia del valle sur
Universidad latinoamericana colonia del valle sur Universidad del pacifico
Universidad del pacifico Universidad católica agropecuaria del trópico seco
Universidad católica agropecuaria del trópico seco Universidad católica agropecuaria del trópico seco
Universidad católica agropecuaria del trópico seco Escuela de postgrado universidad andina del cusco
Escuela de postgrado universidad andina del cusco Palabras para describir una universidad
Palabras para describir una universidad Universidad central del ecuador
Universidad central del ecuador Logo universidad maritima del caribe
Logo universidad maritima del caribe Universidad estatal del valle de ecatepec
Universidad estatal del valle de ecatepec Universidad del este santa isabel
Universidad del este santa isabel Coreducacion sia
Coreducacion sia Universidad del atlantico reynosa
Universidad del atlantico reynosa Unidad derivada del sistema internacional
Unidad derivada del sistema internacional Unidad de la trabajo
Unidad de la trabajo Ue privada del sur
Ue privada del sur Deportiva valle del sol
Deportiva valle del sol Sistema muscular funciones
Sistema muscular funciones Sistema montañoso andino
Sistema montañoso andino