TERMODINMICA Y TERMOQUMICA ASPECTOS ENERGTICOS EN PROCESOS FSICOS








- Slides: 13

TERMODINÁMICA Y TERMOQUÍMICA. ASPECTOS ENERGÉTICOS EN PROCESOS FÍSICOS Y QUÍMICOS PRIMERA PARTE

REQUISITOS PREVIOS. ENERGÍA: ØCapacidad para realizar trabajo. ØUnidad S. I. Joule 1 J = 1 Kg. m 2 / s 2 ØTipos de energía Sistema, entorno y frontera ØConcepto de sistema y entorno. Proceso Ø Tipos de procesos ØTipos de sistemas • Isóbaros ØEstados del sistema • Isotérmicos ØVariables de estado • Isócoros. ØFunciones de estado • Adiabáticos ØFunciones de trayectoria.

TRABAJO Tipos de trabajo. MECÁNICO: ELÉCTRICO Forma de intercambiar energía entre el sistema y su ambiente por un efecto mecánico. Se produce en la frontera del sistema W= F. d W = - n. F. ɛ W = - P. ∆V Para un proceso químico: W = - ∆n R T CALOR: Forma de intercambiar energía entre dos cuerpos por una diferencia de temperatura, hasta alcanzar el EQUILIBRIO TÉRMICO. Q = m. c. ∆t Q = n. C. ∆t EXPANSIÓN Y COMPRESIÓN para gases.

PRIMER PRINCIPIO DE LA TERMODINÁMICA “ La energía del universo es constante”. ENERGÍA INTERNA: U ∆U = Q + W La suma de todas las formas de energía de un sistema se denomina energía interna. La energía interna representa la energía molecular de un sistema (energía de las moléculas, sus interacciones, energía de protones, etc. ). VARIACIÓN DE ENERGÍA INTERNA ∆U ∆U = Uf - Ui No se puede determinar directamente.

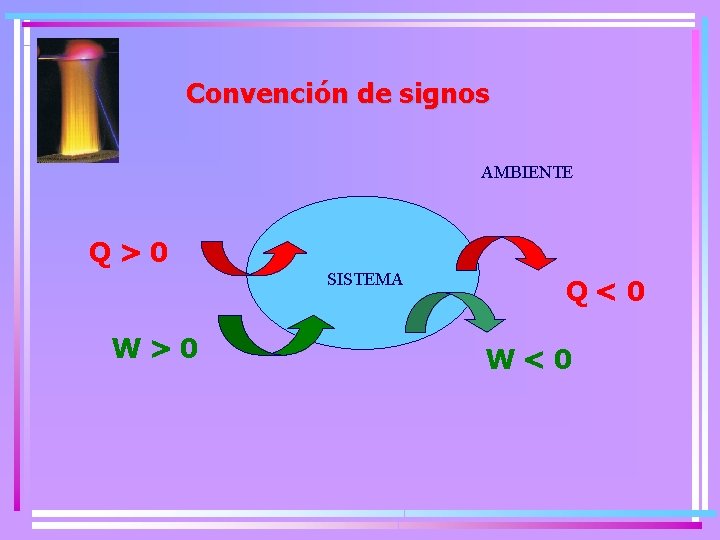
Convención de signos AMBIENTE Q>0 SISTEMA W>0 Q˂0 W˂0

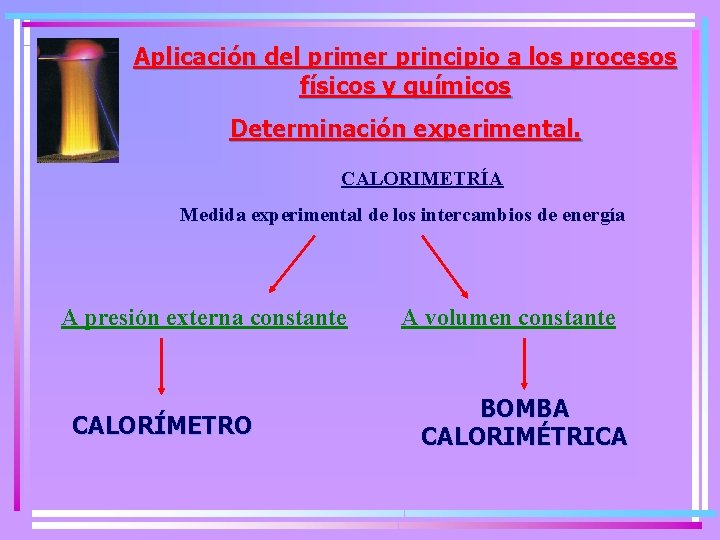
Aplicación del primer principio a los procesos físicos y químicos Determinación experimental. CALORIMETRÍA Medida experimental de los intercambios de energía A presión externa constante CALORÍMETRO A volumen constante BOMBA CALORIMÉTRICA

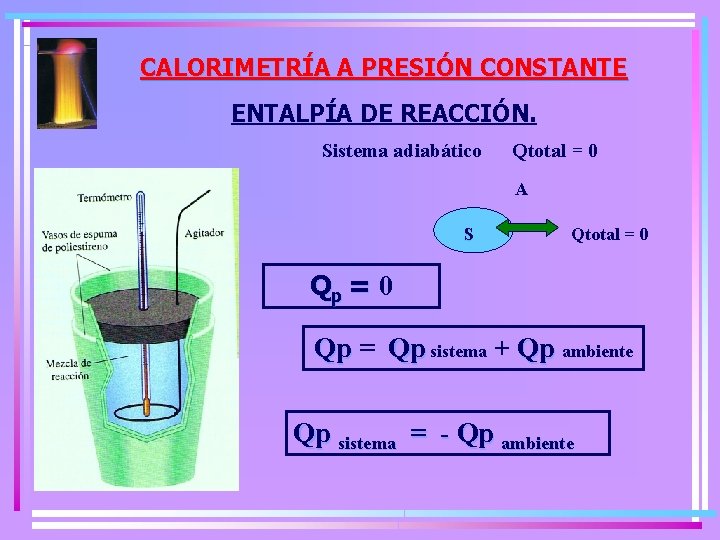
CALORIMETRÍA A PRESIÓN CONSTANTE ENTALPÍA DE REACCIÓN. Sistema adiabático Qtotal = 0 A S Qtotal = 0 Qp = Qp sistema + Qp ambiente Qp sistema = - Qp ambiente

CALORIMETRÍA A VOLUMEN CONSTANTE Sistema adiabático Qtotal = 0 A S Qv total = 0 Qv = Qvsistema + Qvambiente Qv sistema = - Qv ambiente ∆U = Q + W Volumen constante ∆V = 0 Qv = ∆U W=0

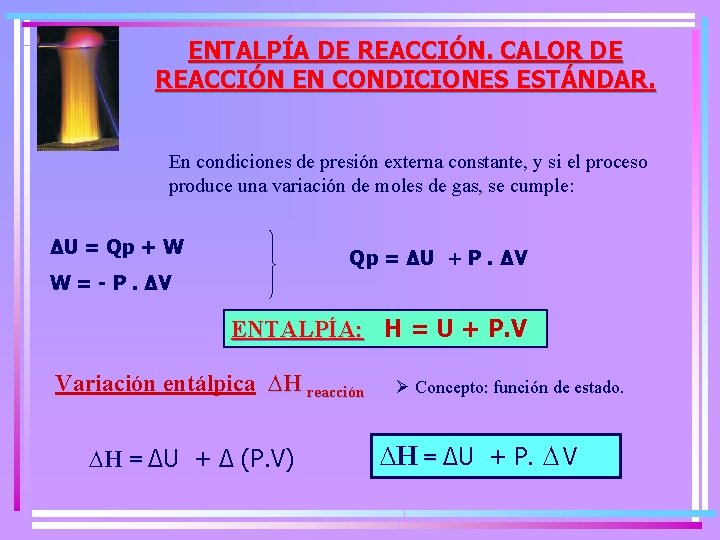
ENTALPÍA DE REACCIÓN. CALOR DE REACCIÓN EN CONDICIONES ESTÁNDAR. En condiciones de presión externa constante, y si el proceso produce una variación de moles de gas, se cumple: ∆U = Qp + W Qp = ∆U + P. ∆V W = - P. ∆V ENTALPÍA: H = U + P. V Variación entálpica ∆H reacción ∆H = ∆U + ∆ (P. V) Ø Concepto: función de estado. ∆H = ∆U + P. ∆ V

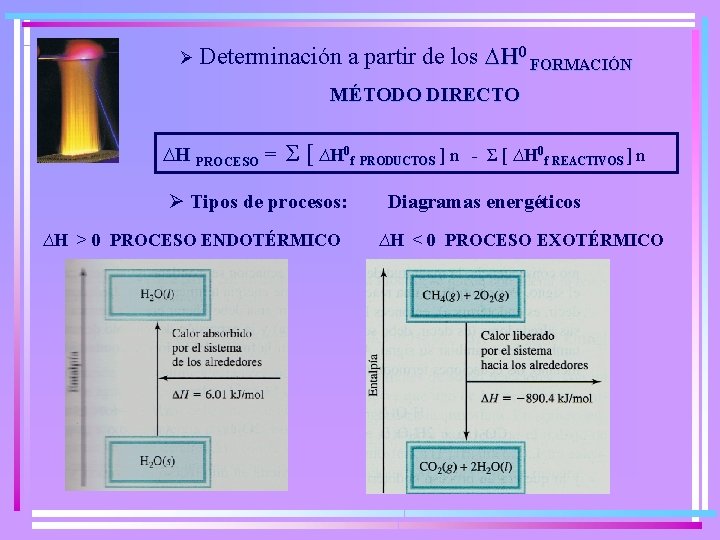
Ø Determinación a partir de los ∆H 0 FORMACIÓN MÉTODO DIRECTO ∆H PROCESO = Σ [ ∆H 0 f PRODUCTOS ] n Ø Tipos de procesos: ∆H > 0 PROCESO ENDOTÉRMICO - Σ [ ∆H 0 f REACTIVOS ] n Diagramas energéticos ∆H ˂ 0 PROCESO EXOTÉRMICO

ENTALPÍA DE FORMACIÓN ∆H 0 formación Energía intercambiada en forma de calor, a presión constante, para la formación de un mol de compuesto a partir de sus elementos en condiciones estándar. E E H 2(G) + ½ O 2(G) ∆H 0 f = - 241, 8 Kj/mol ∆H 0 f = - 285, 8 Kj/mol H 2 O(L) H 2 O(G)

Determinación del ∆H reacción por el MÉTODO INDIRECTO. LEY DE HESS “ Cuando los reactivos se convierten en productos, el cambio de entalpía es el mismo, independientemente, de que se efectúe la reacción en una etapa o una serie de etapas” Ø Aplicación de la propiedad de H estado. de ser función de Ø ∆H reacción sólo depende del estado energético inicial y final del proceso

Ejemplos.