TERMODINMICA UNIDAD 6 ENTROPA PARTE A Indice Deduccin


- Slides: 13

TERMODINÁMICA UNIDAD 6: ENTROPÍA PARTE A

Indice • Deducción físico-matemática • Cambio de entropía para procesos reversibles • Ecuaciones Tds • Diagrama de Mollier • Generación de entropía

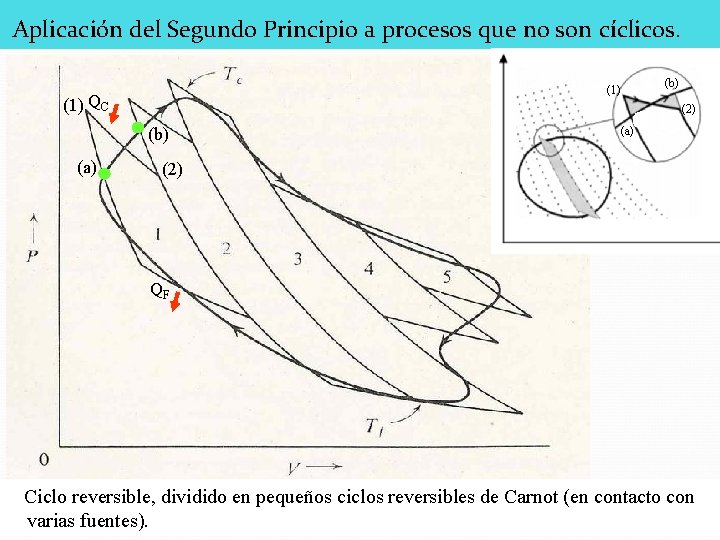
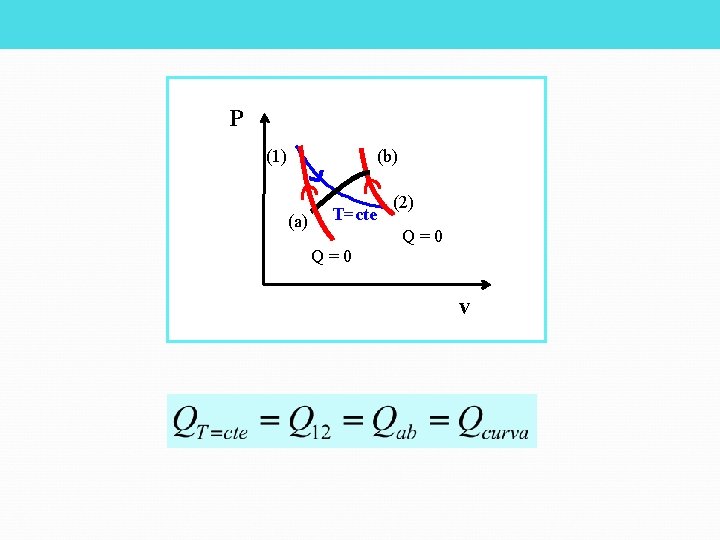
Aplicación del Segundo Principio a procesos que no son cíclicos. (1) QC (2) (b) (a) (2) Q=0 QF Ciclo reversible, dividido en pequeños ciclos reversibles de Carnot (en contacto con varias fuentes).

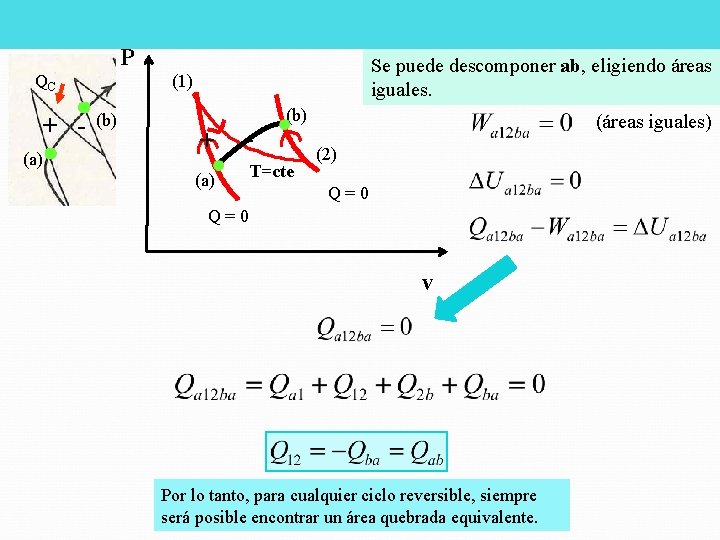
P QC + (a) Se puede descomponer ab, eligiendo áreas iguales. (1) (b) + - (a) (b) T=cte (áreas iguales) (2) Q=0 v Por lo tanto, para cualquier ciclo reversible, siempre será posible encontrar un área quebrada equivalente.

P (1) (b) (a) T=cte Q=0 (2) Q=0 v

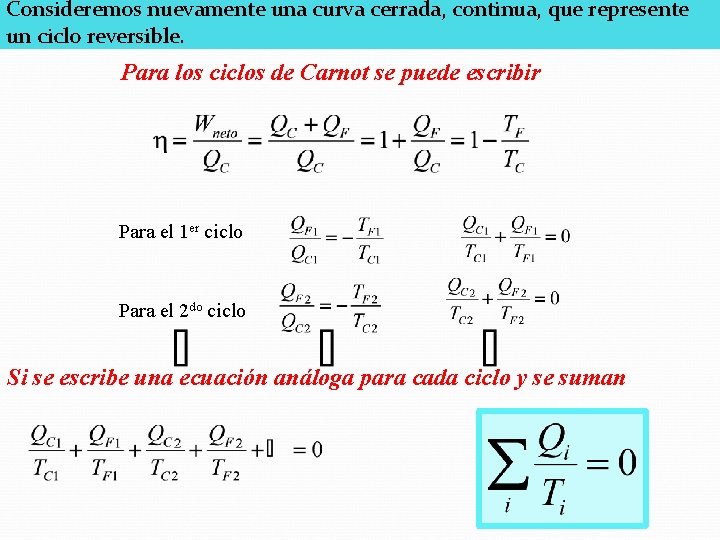
Consideremos nuevamente una curva cerrada, continua, que represente un ciclo reversible. Para los ciclos de Carnot se puede escribir Para el 1 er ciclo Para el 2 do ciclo Si se escribe una ecuación análoga para cada ciclo y se suman

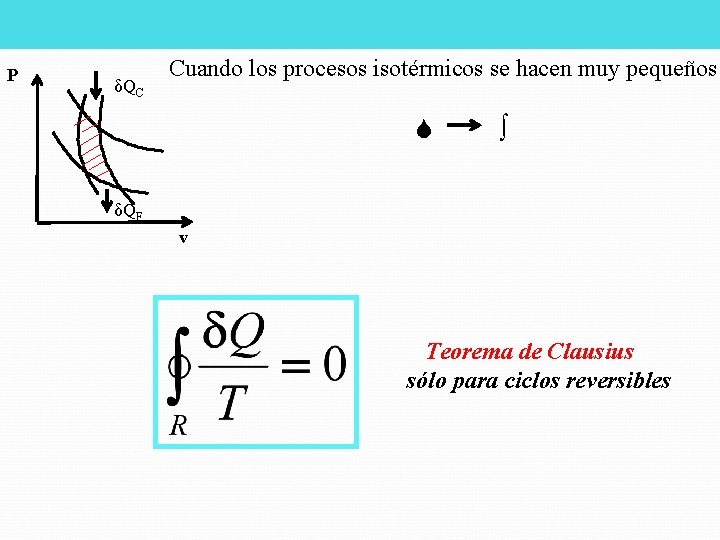
P δQC Cuando los procesos isotérmicos se hacen muy pequeños δQF v Teorema de Clausius sólo para ciclos reversibles

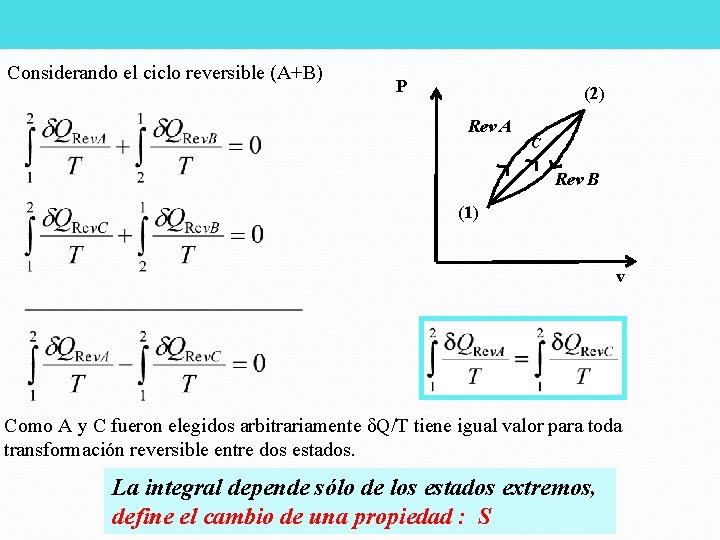
Considerando el ciclo reversible (A+B) P (2) Rev A C Rev B (1) v Como A y C fueron elegidos arbitrariamente δQ/T tiene igual valor para toda transformación reversible entre dos estados. La integral depende sólo de los estados extremos, define el cambio de una propiedad : S

ENTROPÍA: S

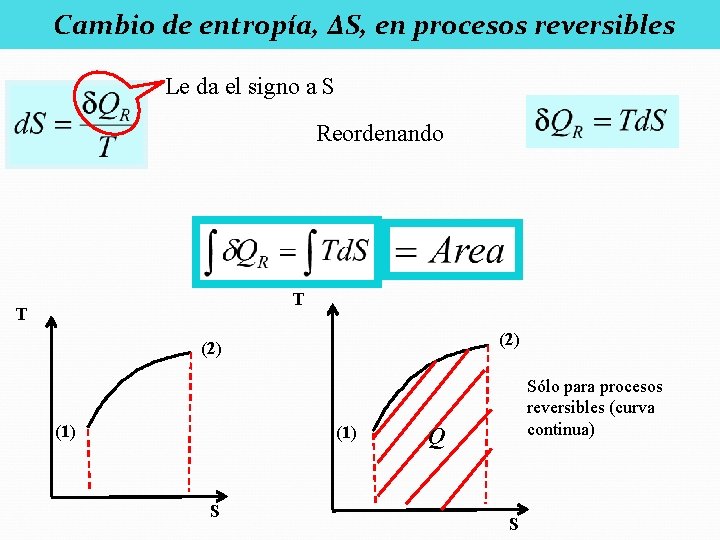
Cambio de entropía, ΔS, en procesos reversibles Le da el signo a S Reordenando T T (2) (1) S Sólo para procesos reversibles (curva continua) Q S

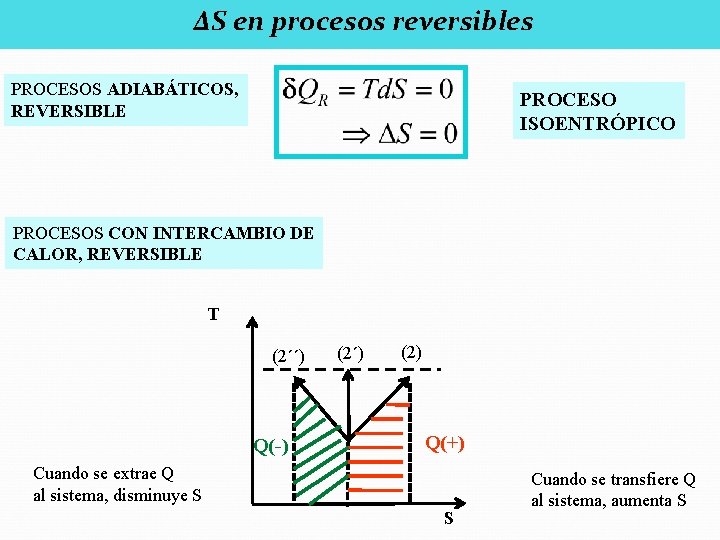
ΔS en procesos reversibles PROCESOS ADIABÁTICOS, REVERSIBLE PROCESO ISOENTRÓPICO PROCESOS CON INTERCAMBIO DE CALOR, REVERSIBLE T (2´´) Q(-) (2´) (2) Q(+) Cuando se extrae Q al sistema, disminuye S S Cuando se transfiere Q al sistema, aumenta S

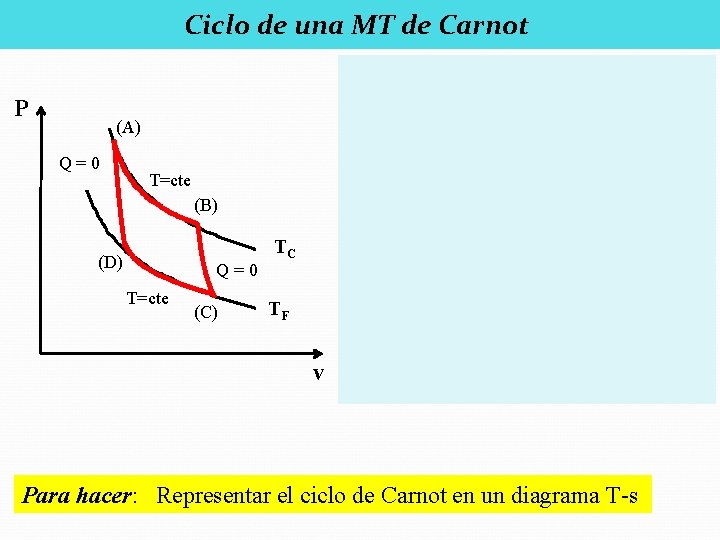
Ciclo de una MT de Carnot T P QC = TC ΔS (A) Q=0 (A) T=cte Q=0 (B) (D) Q=0 T=cte (C) (D) TC (C) QF = TF ΔS TF v Para hacer: Representar el ciclo de Carnot en un diagrama T-s s

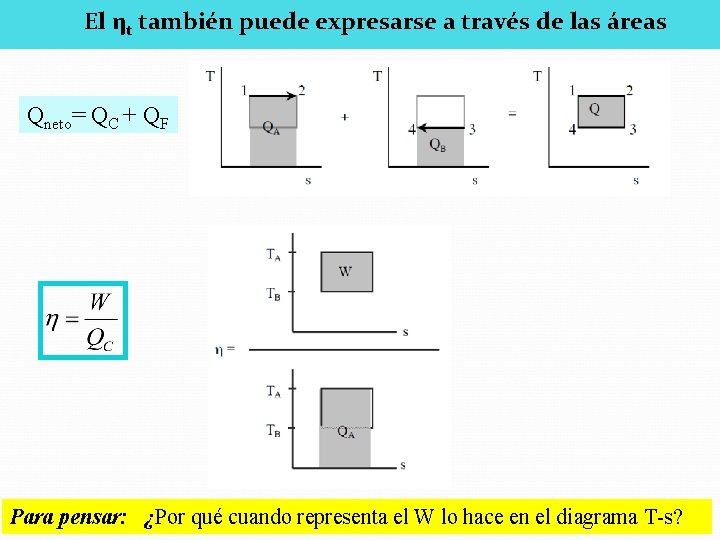
El ηt también puede expresarse a través de las áreas Qneto= QC + QF Para pensar: ¿Por qué cuando representa el W lo hace en el diagrama T-s?