Stoffwechsel von Aminogruppen Katja Arndt 30 10 2006






- Slides: 23

Stoffwechsel von Aminogruppen Katja Arndt, 30. 10. 2006

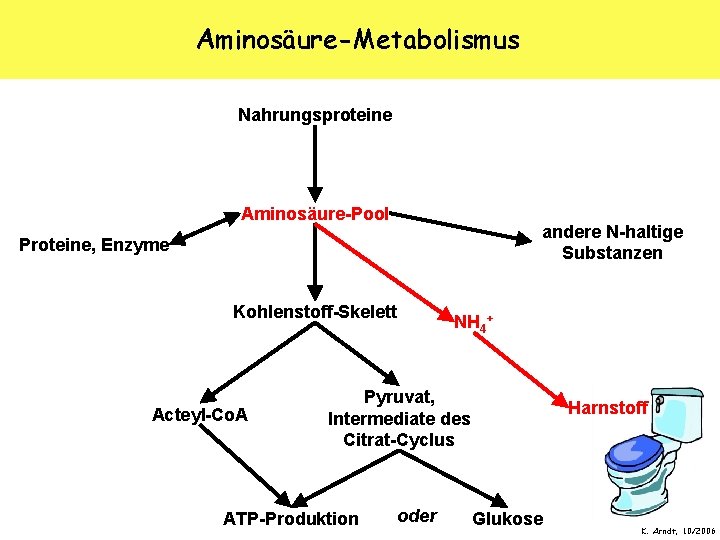
Aminosäure-Metabolismus Nahrungsproteine Aminosäure-Pool andere N-haltige Substanzen Proteine, Enzyme Kohlenstoff-Skelett Acteyl-Co. A NH 4+ Pyruvat, Intermediate des Citrat-Cyclus ATP-Produktion oder Harnstoff Glukose K. Arndt, 10/2006

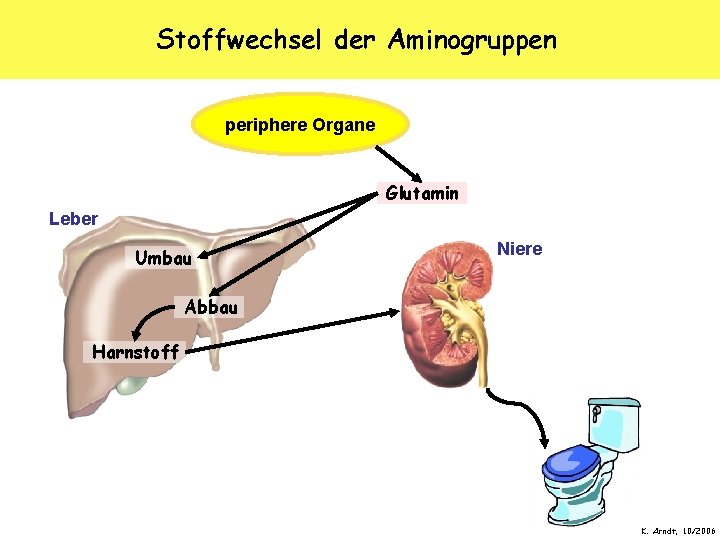
Stoffwechsel der Aminogruppen periphere Organe Glutamin Leber Umbau Niere Abbau Harnstoff K. Arndt, 10/2006

Warum Aminostoffwechsel ? • Aminosäuren wichtig für Protein-Biosynthese. • Zellen können Amino-Gruppe nicht vollständig zu N 2 oxidieren. • Primäres Abbauprodukt ist Ammoniak (= NH 3) – toxisch! • Umwandlung in nicht-toxisches, gut wasserlösliches Molekül: Harnstoff K. Arndt, 10/2006

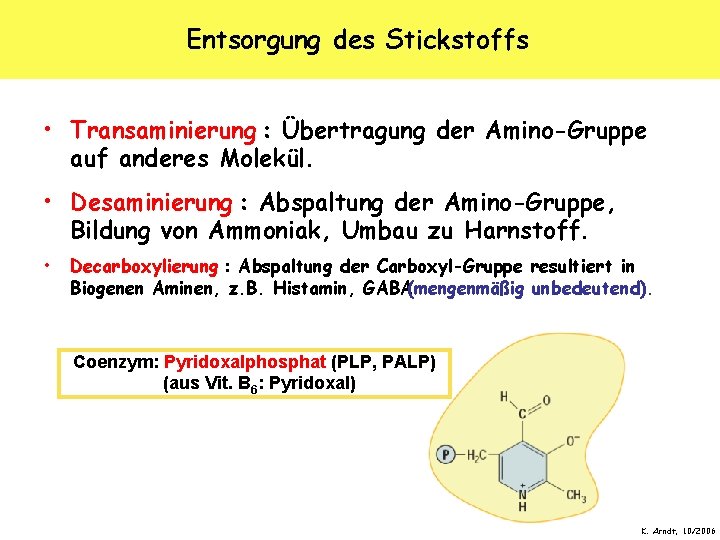
Entsorgung des Stickstoffs • Transaminierung : Übertragung der Amino-Gruppe auf anderes Molekül. • Desaminierung : Abspaltung der Amino-Gruppe, Bildung von Ammoniak, Umbau zu Harnstoff. • Decarboxylierung : Abspaltung der Carboxyl-Gruppe resultiert in Biogenen Aminen, z. B. Histamin, GABA(mengenmäßig unbedeutend). Coenzym: Pyridoxalphosphat (PLP, PALP) (aus Vit. B 6: Pyridoxal) K. Arndt, 10/2006

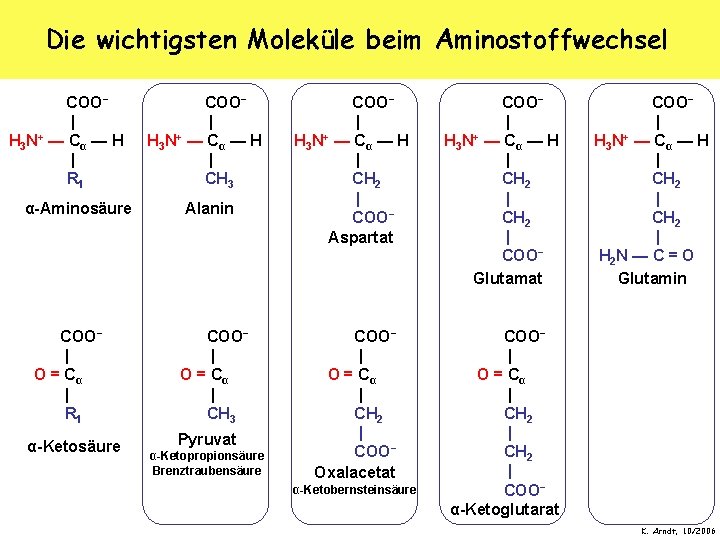
Die wichtigsten Moleküle beim Aminostoffwechsel COO− | H 3 N+ — C α — H | R 1 α-Aminosäure COO− | O = Cα | R 1 α-Ketosäure COO− | H 3 N+ — C α — H | CH 3 Alanin COO− | O = Cα | CH 3 Pyruvat α-Ketopropionsäure Brenztraubensäure COO− | H 3 N+ — C α — H | CH 2 | COO− Aspartat COO− | H 3 N+ — C α — H | CH 2 | COO− Glutamat COO− | O = Cα | CH 2 | COO− Oxalacetat COO− | O = Cα | CH 2 | COO− α-Ketoglutarat α-Ketobernsteinsäure COO− | H 3 N+ — C α — H | CH 2 | H 2 N — C = O Glutamin K. Arndt, 10/2006

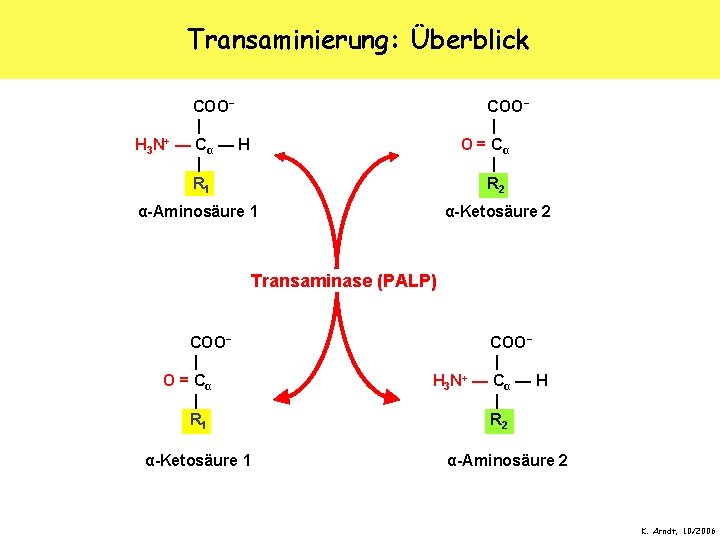
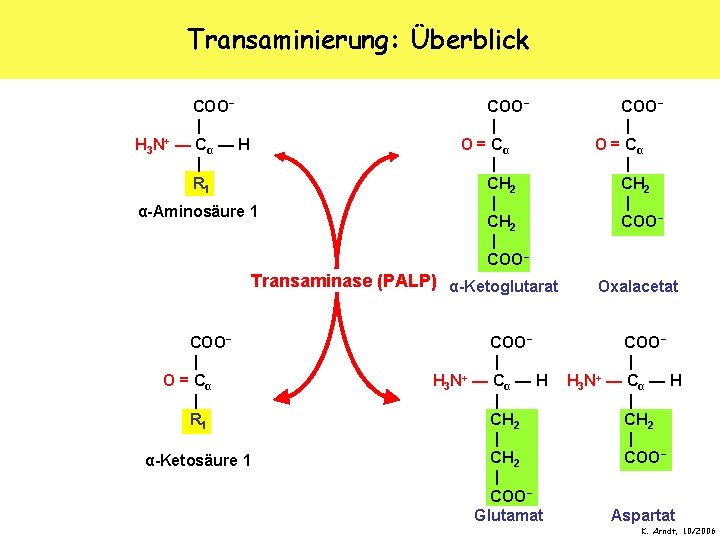
Transaminierung: Überblick COO− | H 3 N+ — C α — H | R 1 COO− | O = Cα | R 2 α-Aminosäure 1 α-Ketosäure 2 Transaminase (PALP) COO− | O = Cα | R 1 α-Ketosäure 1 COO− | H 3 N+ — C α — H | R 2 α-Aminosäure 2 K. Arndt, 10/2006

Transaminierung: Überblick COO− | H 3 N+ — C α — H | R 1 α-Aminosäure 1 COO− | O = Cα | CH 2 | COO− Transaminase (PALP) α-Ketoglutarat COO− | O = Cα | R 1 α-Ketosäure 1 COO− | H 3 N+ — C α — H | CH 2 | COO− Glutamat COO− | O = Cα | CH 2 | COO− Oxalacetat COO− | H 3 N+ — C α — H | CH 2 | COO− Aspartat K. Arndt, 10/2006

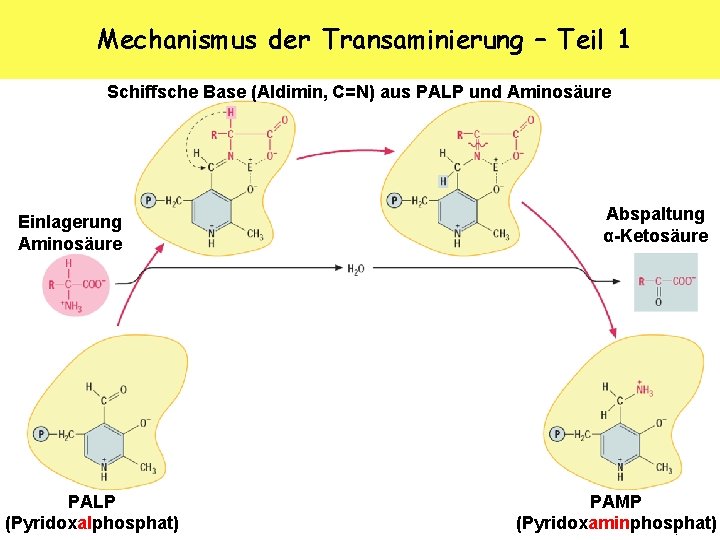
Mechanismus der Transaminierung – Teil 1 Schiffsche Base (Aldimin, C=N) aus PALP und Aminosäure Einlagerung Aminosäure PALP (Pyridoxalphosphat) Abspaltung α-Ketosäure PAMP (Pyridoxaminphosphat) K. Arndt, 10/2006

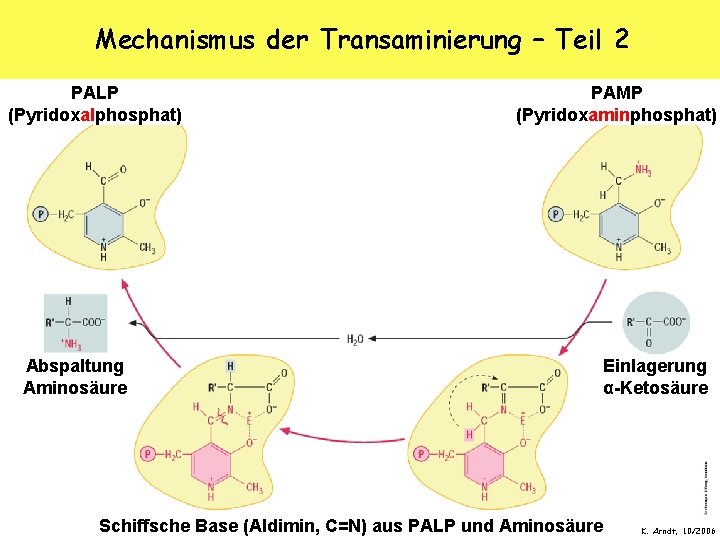
Mechanismus der Transaminierung – Teil 2 PALP (Pyridoxalphosphat) Abspaltung Aminosäure PAMP (Pyridoxaminphosphat) Einlagerung α-Ketosäure Schiffsche Base (Aldimin, C=N) aus PALP und Aminosäure K. Arndt, 10/2006

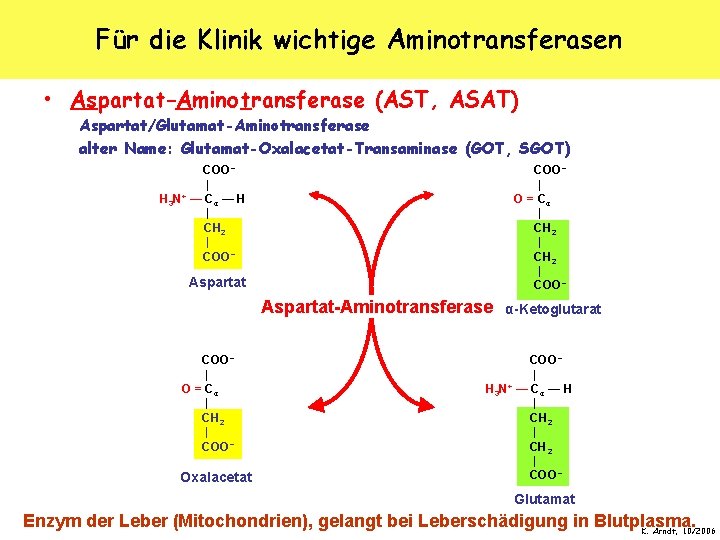
Für die Klinik wichtige Aminotransferasen • Aspartat-Aminotransferase (AST, ASAT) Aspartat/Glutamat-Aminotransferase alter Name: Glutamat-Oxalacetat-Transaminase (GOT, SGOT) COO − | O = Cα | CH 2 | COO − | H 3 N+ — Cα — H | CH 2 | COO − Aspartat-Aminotransferase COO − | O = Cα | CH 2 | COO − Oxalacetat α-Ketoglutarat COO − | + H 3 N — Cα — H | CH 2 | COO − Glutamat Enzym der Leber (Mitochondrien), gelangt bei Leberschädigung in Blutplasma. K. Arndt, 10/2006

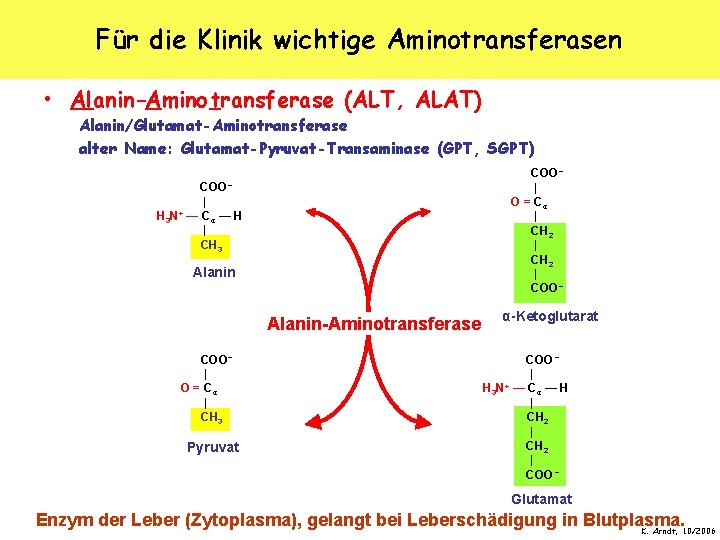
Für die Klinik wichtige Aminotransferasen • Alanin-Aminotransferase (ALT, ALAT) Alanin/Glutamat-Aminotransferase alter Name: Glutamat-Pyruvat-Transaminase (GPT, SGPT) COO − | O = Cα | CH 2 | COO − H 3 N+ | — Cα — H | CH 3 Alanin-Aminotransferase COO − | O = Cα | CH 3 Pyruvat α-Ketoglutarat COO − | + H 3 N — Cα — H | CH 2 | COO − Glutamat Enzym der Leber (Zytoplasma), gelangt bei Leberschädigung in Blutplasma. K. Arndt, 10/2006

Bedeutung in der Diagnostik K. Arndt, 10/2006

Bedeutung in der Diagnostik K. Arndt, 10/2006

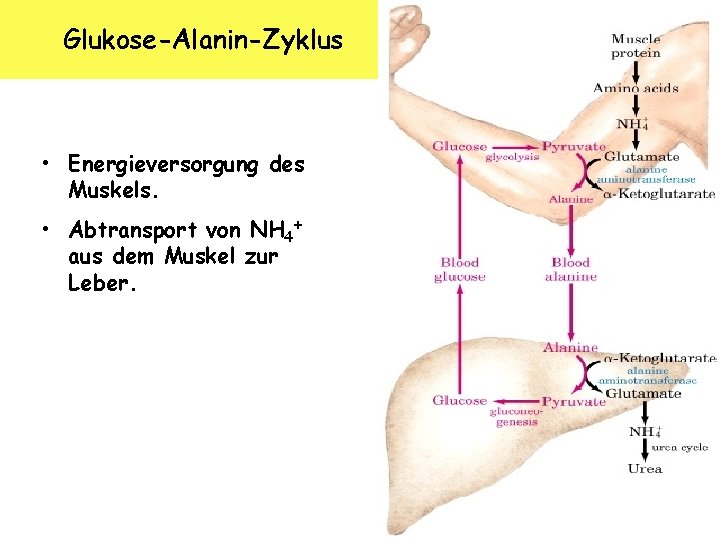
Glukose-Alanin-Zyklus • Energieversorgung des Muskels. • Abtransport von NH 4+ aus dem Muskel zur Leber. K. Arndt, 10/2006

Desaminierung • Entfernung der Aminogruppe, Bildung von Ammoniak. • Bis auf GLDH sind alle Desaminierungen irreversibel. • Oxidative Desaminierung – Aminogruppe oxidiert, dann hydrolysiert zu α-Ketosäure – Elektronen auf NAD+ oder NADP+ übertragen • Hydrolytisch Desaminierung – Abspaltung der Säureamidgruppe (Gln, Asn) • Eliminierende Desaminierung – Eliminierung von NH 3 und Ausbildung einer Doppelbindung – seltene Reaktion K. Arndt, 10/2006

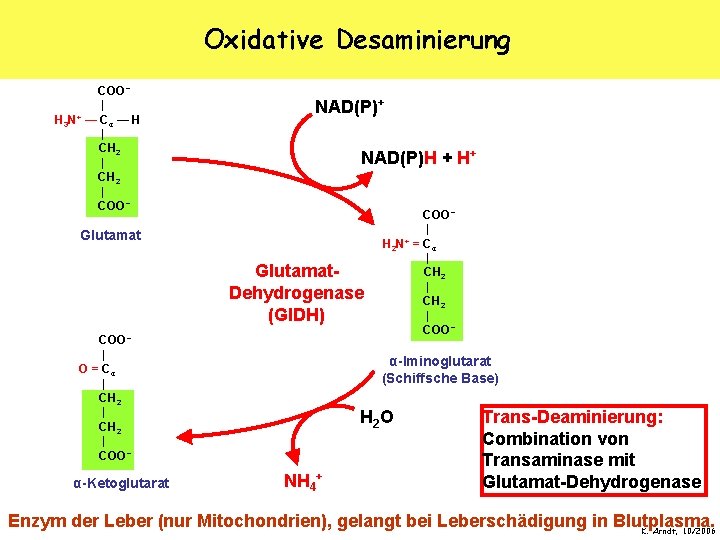
Oxidative Desaminierung COO − | H 3 N+ — Cα — H | CH 2 | COO − NAD(P)+ NAD(P)H + H+ Glutamat. Dehydrogenase (Gl. DH) COO − | O = Cα | CH 2 | COO − α-Ketoglutarat COO − | H 2 N+ = Cα | CH 2 | COO − α-Iminoglutarat (Schiffsche Base) H 2 O NH 4+ Trans-Deaminierung: Combination von Transaminase mit Glutamat-Dehydrogenase Enzym der Leber (nur Mitochondrien), gelangt bei Leberschädigung in Blutplasma. K. Arndt, 10/2006

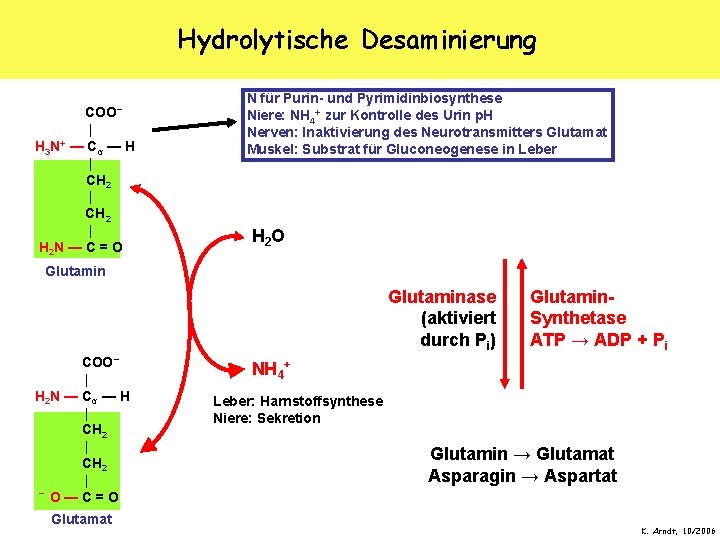
Hydrolytische Desaminierung COO− | — Cα — H | CH 2 | H 2 N — C = O H 3 N+ N für Purin- und Pyrimidinbiosynthese Niere: NH 4+ zur Kontrolle des Urin p. H Nerven: Inaktivierung des Neurotransmitters Glutamat Muskel: Substrat für Gluconeogenese in Leber H 2 O Glutaminase (aktiviert durch Pi) COO− | H 2 N — Cα — H | CH 2 | − O — C = O Glutamat Glutamin. Synthetase ATP → ADP + Pi NH 4+ Leber: Harnstoffsynthese Niere: Sekretion Glutamin → Glutamat Asparagin → Aspartat K. Arndt, 10/2006

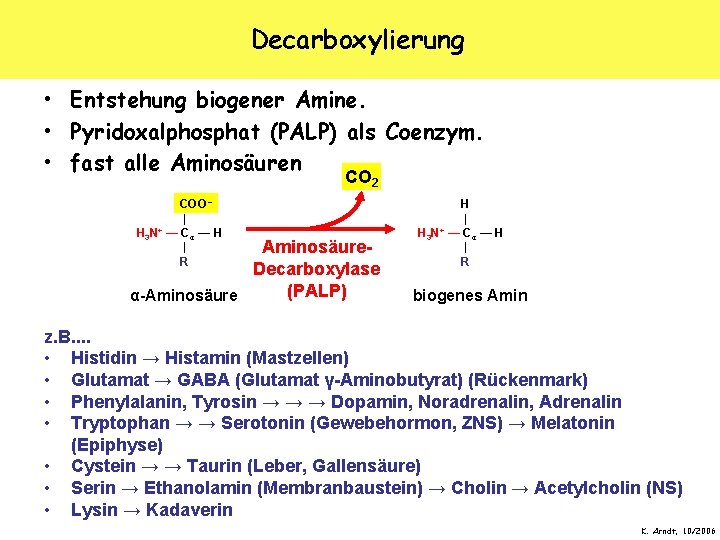
Decarboxylierung • Entstehung biogener Amine. • Pyridoxalphosphat (PALP) als Coenzym. • fast alle Aminosäuren CO 2 COO − | + H 3 N — Cα — H | R Aminosäure. Decarboxylase (PALP) α-Aminosäure H | + H 3 N — Cα — H | R biogenes Amin z. B. . • Histidin → Histamin (Mastzellen) • Glutamat → GABA (Glutamat γ-Aminobutyrat) (Rückenmark) • Phenylalanin, Tyrosin → → → Dopamin, Noradrenalin, Adrenalin • Tryptophan → → Serotonin (Gewebehormon, ZNS) → Melatonin (Epiphyse) • Cystein → → Taurin (Leber, Gallensäure) • Serin → Ethanolamin (Membranbaustein) → Cholin → Acetylcholin (NS) • Lysin → Kadaverin K. Arndt, 10/2006

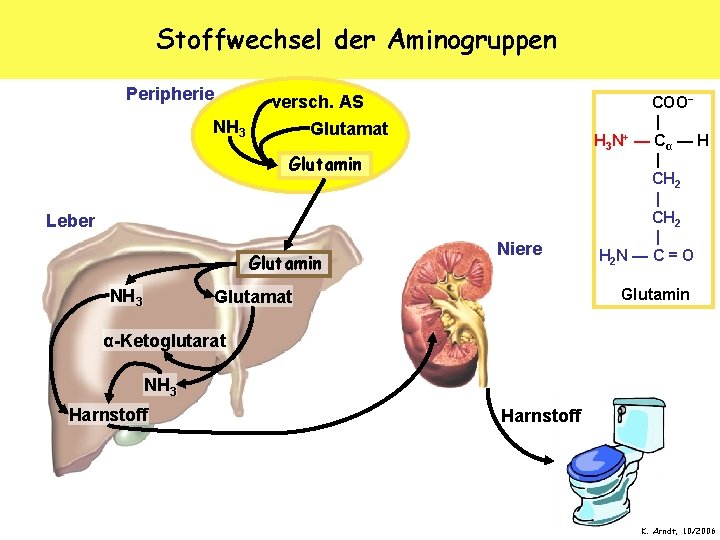
Stoffwechsel der Aminogruppen Peripherie NH 3 versch. AS Glutamat Glutamin Leber Glutamin NH 3 Niere COO− | H 3 N+ — C α — H | CH 2 | H 2 N — C = O Glutamin Glutamat α-Ketoglutarat NH 3 Harnstoff K. Arndt, 10/2006

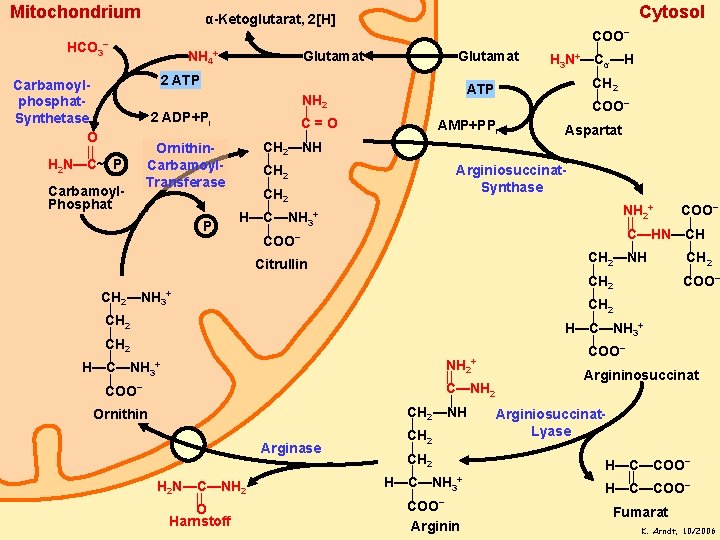
Mitochondrium HCO 3− Carbamoylphosphat. Synthetase O || H 2 N—C~ P Carbamoyl. Phosphat Cytosol α-Ketoglutarat, 2[H] NH 4+ Glutamat 2 ATP 2 ADP+Pi Ornithin. Carbamoyl. Transferase P NH 2 | C=O | CH 2—NH | CH 2 | H—C—NH 3+ | COO− Citrullin CH 2—NH 3+ | CH 2 | H—C—NH 3+ | COO− Ornithin Arginase H 2 N—C—NH 2 || O Harnstoff Glutamat ATP AMP+PPi COO− | H 3 N+—Cα—H | CH 2 | COO− Aspartat Arginiosuccinat. Synthase NH 2+ COO− || | C—HN—CH | | CH 2—NH CH 2 | | CH 2 COO− | CH 2 | H—C—NH 3+ | COO− NH 2+ Argininosuccinat || C—NH 2 | CH 2—NH Arginiosuccinat| Lyase CH 2 | CH 2 H—C—COO− | || H—C—NH 3+ − H—C—COO | COO− Fumarat Arginin K. Arndt, 10/2006

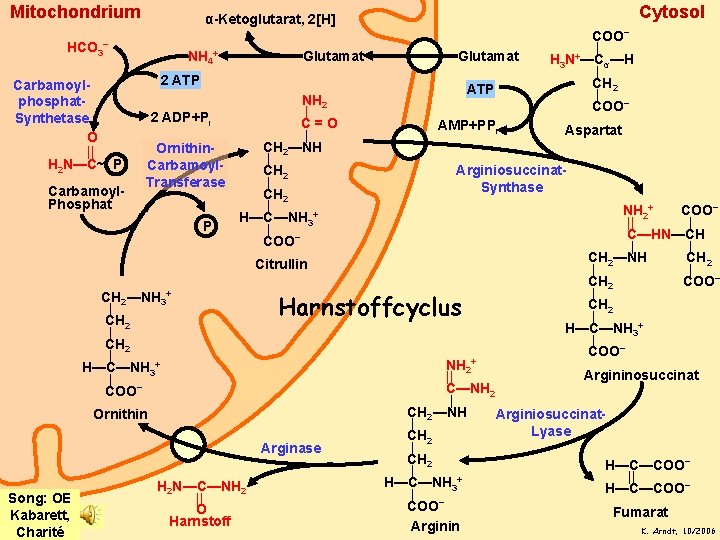
Mitochondrium HCO 3− Carbamoylphosphat. Synthetase O || H 2 N—C~ P Carbamoyl. Phosphat Cytosol α-Ketoglutarat, 2[H] NH 4+ Glutamat 2 ATP 2 ADP+Pi Ornithin. Carbamoyl. Transferase P NH 2 | C=O | CH 2—NH | CH 2 | H—C—NH 3+ | COO− ATP AMP+PPi Harnstoffcyclus Ornithin Arginase Song: OE Kabarett, Charité H 2 N—C—NH 2 || O Harnstoff Aspartat Arginiosuccinat. Synthase Citrullin CH 2—NH 3+ | CH 2 | H—C—NH 3+ | COO− | H 3 N+—Cα—H | CH 2 | COO− NH 2+ COO− || | C—HN—CH | | CH 2—NH CH 2 | | CH 2 COO− | CH 2 | H—C—NH 3+ | COO− NH 2+ Argininosuccinat || C—NH 2 | CH 2—NH Arginiosuccinat| Lyase CH 2 | CH 2 H—C—COO− | || H—C—NH 3+ − H—C—COO | COO− Fumarat Arginin K. Arndt, 10/2006

Literatur Bücher: • Löffler, Petrides: Biochemie & Pathobiochemie, Springer Verlag, 7. Auflage, 2003. • Horn, et al. : Biochemie des Menschen, Thieme Verlag, 3. Auflage, 2005. • Doenecke, Koolman, Fuchs, Gerok: Karlsons. Biochemie und Pathobiochemie, Thieme Verlag, 15. Auflage, 2005. • Berg, Tymoczko, Stryer: Biochemistry, W. H. Freeman & Co bzw. Spektrum Verlag, 5. Auflage, 2002/2003. (http: //www. ncbi. nlm. nih. gov/books oder http: //bcs. whfreeman. com/biochem 5/ ). www. molbiotech. uni-freiburg. de/ka/lehre/dat/Stoffwechsel_Aminogruppen. ppt K. Arndt, 10/2006
 Bauer danker arndt gingrich
Bauer danker arndt gingrich Bloqueador bronquial arndt
Bloqueador bronquial arndt Kirk arndt
Kirk arndt Kurshalter
Kurshalter Erasmus von rotterdam beeinflusst von
Erasmus von rotterdam beeinflusst von Examples of metonymy
Examples of metonymy Katja bähr
Katja bähr Katja škrubej
Katja škrubej Katja blatnik
Katja blatnik Katja vähäjärvi
Katja vähäjärvi Katja nikkari
Katja nikkari Katja hietanen
Katja hietanen Katja vanhanen
Katja vanhanen Katja drobnič
Katja drobnič Katja seltmann
Katja seltmann Laktaasientsyymin toiminta
Laktaasientsyymin toiminta Katja laitila
Katja laitila Katja tominec
Katja tominec Mestringsplan
Mestringsplan Katja vrabec
Katja vrabec Lab opintopsykologi
Lab opintopsykologi Mikaela tavio
Mikaela tavio Katja kuusela
Katja kuusela Katja
Katja