SOLUCIONES MEZCLAS HOMOGENEAS AGREGACIN DE DOS MS SUSTANCIAS











- Slides: 13

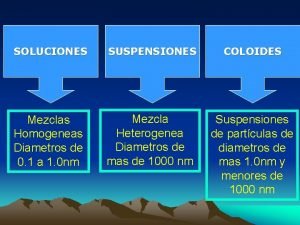
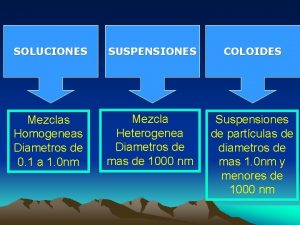
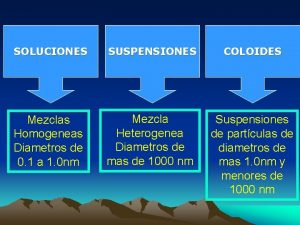
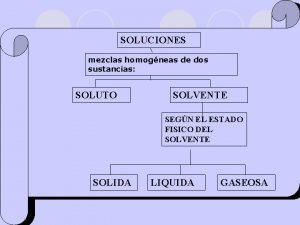
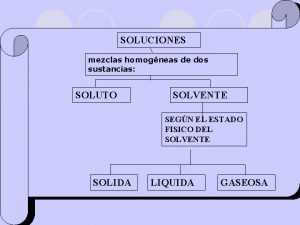
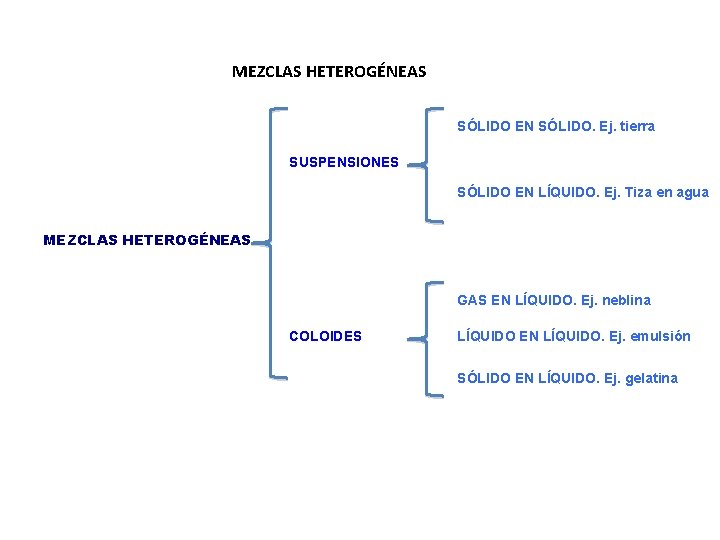
SOLUCIONES MEZCLAS HOMOGENEAS AGREGACIÓN DE DOS MÁS SUSTANCIAS, EN LA CUAL SE RECONOCE CADA PARTE O FASE CON PROPIEDADES DISTINTAS. LA PROPORCIÓN DE CADA COMPONENTE NO ES LA MISMA EN CUAL QUIER PORCIÓN DE ELLA. TIPOS: A) SUSPENSIONES: por ejemplo tiza en agua, aceite en agua, tierra, sangre, etc. Los componentes se separan por métodos mecánicos (filtración) B) COLOIDES: por ejemplo neblina, plasma de la sangre, etc. Los componentes separan por métodos físicos (centrifugación) MEZCLAS HETEROGENEAS AGREGACION DE DOS MÁS SUSTANCIAS EN LA CUAL CADA PARTE DE LA MEZCLA O PORCIÓN DE ELLA TIENE LA MISMA PROPORCIÓN Y LAS PROPIEDADES TAMBIÉN SON IGUALES. SE OBSERVA UNA SOLA FASE TIPO : LAS SOLUCIONES

MEZCLAS HETEROGÉNEAS SÓLIDO EN SÓLIDO. Ej. tierra SUSPENSIONES SÓLIDO EN LÍQUIDO. Ej. Tiza en agua MEZCLAS HETEROGÉNEAS GAS EN LÍQUIDO. Ej. neblina COLOIDES LÍQUIDO EN LÍQUIDO. Ej. emulsión SÓLIDO EN LÍQUIDO. Ej. gelatina

SOLUCIONES TIPO PARTICULAR DE MEZCLA HOMOGÉNEA, EN LA CUAL EXISTE INTERPOSICIÓN MOLECULAR EN ESTAS MEZCLAS, LOS COMPONENTES SEPARAN SÓLO POR CAMBIOS DE FASE O CAMBIOS DE ESTADO (EVAPORACIÓN, DESTILACIÓN, ETC)

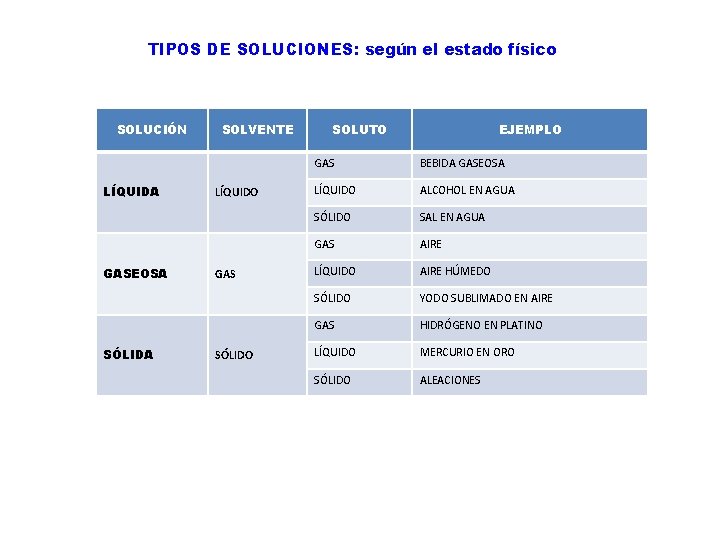
TIPOS DE SOLUCIONES: según el estado físico SOLUCIÓN LÍQUIDA GASEOSA SÓLIDA SOLVENTE LÍQUIDO GAS SÓLIDO SOLUTO EJEMPLO GAS BEBIDA GASEOSA LÍQUIDO ALCOHOL EN AGUA SÓLIDO SAL EN AGUA GAS AIRE LÍQUIDO AIRE HÚMEDO SÓLIDO YODO SUBLIMADO EN AIRE GAS HIDRÓGENO EN PLATINO LÍQUIDO MERCURIO EN ORO SÓLIDO ALEACIONES

En una solución, el medio dispersante, se llama SOLVENTE y es el componente que está mayor proporción. El medio disperso, se llama SOLUTO y son las sustancias disueltas y que están en menor proporción Ambos componentes se relacionan en base a la igualdad: SOLUCIÓN = SOLUTO + SOLVENTE La igualdad anterior es siempre válida para la masa: MASA SOLUCIÓN = MASA SOLUTO + MASA SOLVENTE Por ejemplo: Por ejemplo 20 g de limón mezclados con 250 g de agua forman 270 g de limonada = SOLUCIÓN 270 g = + SOLUTO 20 g + SOLVENTE 250 g Sin embargo esto no se cumple siempre para los volúmenes. Esta relación de volúmenes sólo se da en las soluciones ideales. SOLUCIÓN IDEAL: es aquella que al ser preparada no altera su volumen.

También según el soluto disuelto y el solvente usado tendremos SOLUCIONES ELECTROLÍTICAS Y NO ELECTROLÍTICAS LOS SOLUTOS Y SOLVENTES PUROS SON EN GENERAL MALOS CONDUCTORES DE LA CORRIENTE ELÉCTRICA. Por ejemplo, el agua pura NO conduce la corriente eléctrica. Si disolvemos en el agua una sal, un ácido o una base, la solución formada SI conduce la corriente eléctrica. Los ácidos, bases y sales se llaman electrólitos, pues conducen la corriente eléctrica fundidos o en solución acuosa. El solvente que con un electrólito forma soluciones conductoras de la corriente eléctrica se llama solvente polar, por ejemplo el agua. Los no-electrólitos son las sustancias que ni fundidas ni en solución conducen la corriente eléctrica. Por ejemplo, los compuestos orgánicos (alcoholes, azúcares, hidrocarburos, etc. ). Solvente apolar ( no polar) no forman soluciones conductoras. Por ejemplo, solventes orgánicos (acetona, alcohol, etc. ). SOLUCIÓN ELECTROLÍTICA: SON LAS SOLUCIONES QUE CONDUCEN LA CORRIENTE ELÉCTRICA SOLUCIÓN NO ELECTROLÍTICA: NO CONDUCEN LA CORRIENTE ELÉCTRICA

Entre la cantidad de soluto y la cantidad de solvente o de solución se establece una relación cuantitativa, que se llama CONCENTRACIÓN A medida que se disuelve mayor cantidad de soluto, en una misma cantidad de solvente, aumenta la concentración. Cuando alcanza un límite y es imposible disolver más soluto, se dice que la solución es SATURADA La concentración de una solución saturada, se llama SOLUBILIDAD Por ejemplo: la solubilidad de la sal en agua a 30°C es 96 g en 100 g de agua. ¿Cuándo tendremos una solución saturada de la sal en agua? SOLUCIÓN SATURADA: es aquella que contiene la cantidad de soluto correspondiente a la solubilidad Si contiene menos que la expresada en la solubilidad, la llamaremos SOLUCIÓN INSATURADA Si contiene más que la expresada en la solubilidad, la llamaremos SOLUCIÓN SOBRESATURADA Cuando contiene una pequeña cantidad de soluto, también se puede llamar SOLUCIÓN DILUÍDA Ejercicio: Se disuelven 72 g de sal en 75 g de agua a 30°C. ¿Cómo podría usted clasificar a la solución formada? ¿Por qué?

FACTORES QUE AFECTAN LA SOLUBILIDAD 1) La solubilidad depende de la naturaleza del solvente y del soluto( si es polar o no). Por ejemplo, se disuelve mayor cantidad de sal en agua (solvente polar) que en acetona (solvente apolar) 2) Temperatura: a mayor temperatura se facilita la disolución Por ejemplo, la solubilidad del KNO 3 en agua 20°C es 20 g de sal en 100 g de agua. Si aumentamos la temperatura a 40° C del agua, la solubilidad aumenta a 43 g de sal en los mismos 100 g de agua. 3) Presión: válido para solutos gaseosos, a mayor presión mayor solubilidad del gas. Por ejemplo, en las bebidas gaseosas al destaparlas el gas se escapa porque disminuye la presión 4) Agitación: a mayor agitación mayor interacción del soluto con el solvente 5) Estado de agregación: a mayor disgregación del soluto mayor solubilidad en el solvente

CONCENTRACIÓN EN SOLUCIONES RELACIÓN PROPORCIONAL ENTRE SOLUTO Y SOLVENTE O SOLUCIÓN LA CONCENTRACIÓN SE EXPRESA EN DISTINTAS UNIDADES DE CONCENTRACIÓN. LAS UNIDADES DE CONCENTRACIÓN SE CLASIFICAN EN : 1. - UNIDADES FÍSICAS O PORCENTUALES 2. - UNIDADES QUÍMICAS O MOLARES UNIDADES PORCENTUALES SON: %MASA/MASA; % MASA/VOLUMEN; % VOLUMEN/ VOLUMEN

CONCENTRACIONES MOLARES EN ESTAS UNIDADES SE USA EL MOL COMO CANTIDAD DE SUSTANCIA. ESTUDIAREMOS DE ESTAS UNIDADES: LA MOLARIDAD Y LA MOLALIDAD ¿QUÉ ES EL MOL

MOL : cantidad de sustancia que contiene la misma cantidad de partículas que hay en 0, 012 kg del isótopo de carbono 12 Se usa en forma sencilla: el mol representa un número equivalente a 6, 02 x 1023 partículas Este número se llama Número de Avogadro. Por ejemplo, para el H tenemos que su masa atómica es 1 g/mol; esto significa que: Por lo tanto, la masa molar (MM) es la masa en gramos correspondiente a 1 mol del elemento. Resolvamos algunos ejemplos de Molaridad (M) y molalidad (m)

1. - ¿Qué significa que una solución es 3 molar? 2. - Se disuelven 5 g de Na. Cl (masa molar o peso molecular= 58, 5 g/mol) en agua hasta obtener 150 m. L de solución. Calcular la molaridad de la solución. 3. - ¿Qué significa que una solución es 3 molal? 4. - Se disuelven 5 g de Na. Cl (masa molar o peso molecular= 58, 5 g/mol) 150 m. L de agua Calcular la molaridad de la solución. DILUCIÓN DE SOLUCIONES Es el proceso que ocurre al agregar solvente a una solución de concentración conocida. Se usa la fórmula: M 1 x V 1 = M 2 x V 2 M 1 : molaridad inicial de la solución V 1 : volumen inicial de la solución M 2 : molaridad final de la solución V 2 : volumen final de la solución Ejemplo: A 10 m. L de una solución acuosa de Na. Cl 5 M se agregan 10 m. L de agua. ¿Cuál será la nueva concentración de la solución?

ESTEQUIOMETRIA Un gran porcentaje de reacciones químicas ocurren en solución. Las reacciones químicas son transformaciones de sustancias iniciales (REACTANTES) en sustancias finales (PRODUCTOS). Las reacciones químicas se representan en forma de ECUACIONES QUÍMICAS. A + B REACTANTES C + D PRODUCTOS Las reacciones químicas respetan la Ley de Lavoisier Para igualar o equilibrar las ecuaciones químicas se usan coeficientes estequiométricos, que son números que ajustan la ecuación ¿Qué señalan los coeficientes estequiométricos en una ecuación?
 Proporción de agua en la tierra
Proporción de agua en la tierra Mezclas heterogéneas
Mezclas heterogéneas Sustancia
Sustancia Cobre sustancia
Cobre sustancia Mezclas
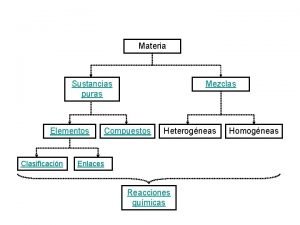
Mezclas Organizador grafico de sustancias puras y mezclas
Organizador grafico de sustancias puras y mezclas Imágenes de mezclas homogéneas
Imágenes de mezclas homogéneas Mezclas heterogéneas
Mezclas heterogéneas Juan tiene una mezcla homogenea de sal y agua
Juan tiene una mezcla homogenea de sal y agua Clasificación de la materia
Clasificación de la materia Mistura heterogênea
Mistura heterogênea Site:slidetodoc.com
Site:slidetodoc.com Ate disoluciones coloides y suspensiones
Ate disoluciones coloides y suspensiones Mezclas pediatricas
Mezclas pediatricas