QUMICA Professor Vilmar F Lorena Histrico Por volta








- Slides: 13

QUÍMICA Professor: Vilmar F. Lorena

Histórico. Por volta de 1807, Jons Jacob Freiherr Von Berzelius começou a defender a chamada teoria da força vital, segundo a qual somente o metabolismo de um organismo vivo seria capaz de sintetizar substâncias orgânicas. Contudo, a teoria da força vital caiu por terra em 1828, quando o químico alemão Friedrich Wöhler, então aluno de Berzelius, obteve em laboratório a ureia. Professor: Vilmar F. Lorena

Definição. August Von Kekulé acabou por definir a química orgânica como a parte da Química que estuda os compostos do elemento carbono. Começou a ser desvendada a partir da segunda metade do século XIX com os estudos de Couper e de Kekulé sobre o comportamento químico do carbono. Professor: Vilmar F. Lorena

Postulados de Kekulé. 1. Tetravalência do carbono: Em razão de sua estrutura com quatro elétrons na camada de valência, o carbono sempre efetua quatro ligações químicas sendo classificado como tetravalente (valentia = capacidade). Geometria: tetraédrica. Geometria: linear. Geometria: trigonal plana. Professor: Vilmar F. Lorena

Postulados de Kekulé. 2. Equivalência das ligações: Não importa a posição do ligante, ou seja, as quatro ligações funcionam da mesma maneira. Caráter anfótero: Combina-se tanto com átomos eletronegativos como átomos eletropositivos, Como só existe um composto com a fórmula CH 3 Cl as quatro representações apresentadas devem ser consideradas como iguais. Professor: Vilmar F. Lorena

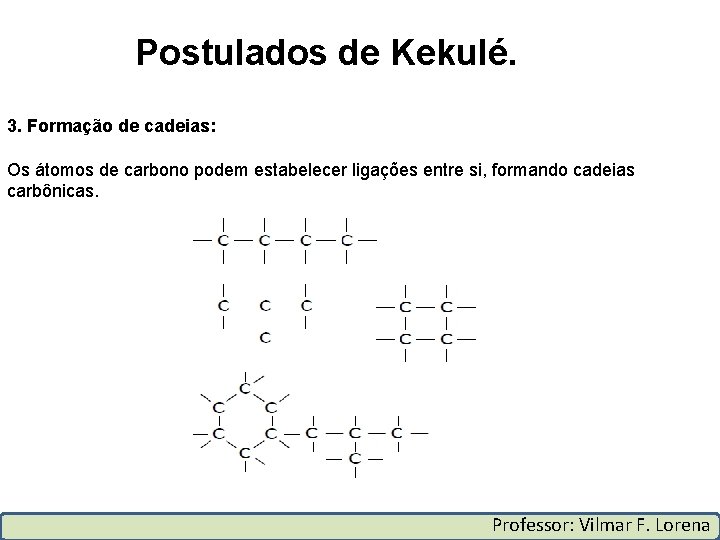
Postulados de Kekulé. 3. Formação de cadeias: Os átomos de carbono podem estabelecer ligações entre si, formando cadeias carbônicas. Professor: Vilmar F. Lorena

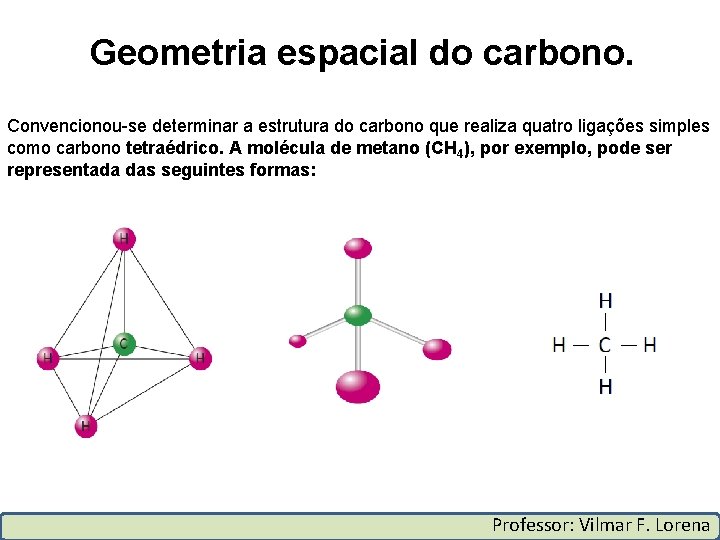
Geometria espacial do carbono. Convencionou-se determinar a estrutura do carbono que realiza quatro ligações simples como carbono tetraédrico. A molécula de metano (CH 4), por exemplo, pode ser representada das seguintes formas: Professor: Vilmar F. Lorena

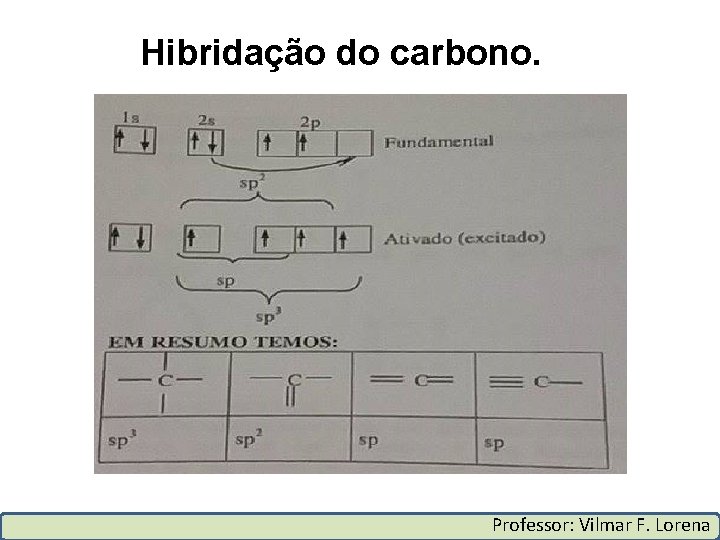
Hibridação do carbono. Professor: Vilmar F. Lorena

Elementos organógenos. Fundamentalmente: C, H, O e N; em menor frequência aparecem: Cl, Br, I, S e P. Todos esses elementos são de- nominados elementos organógenos, isto é, são os elementos que compõem as funções orgânicas. Professor: Vilmar F. Lorena

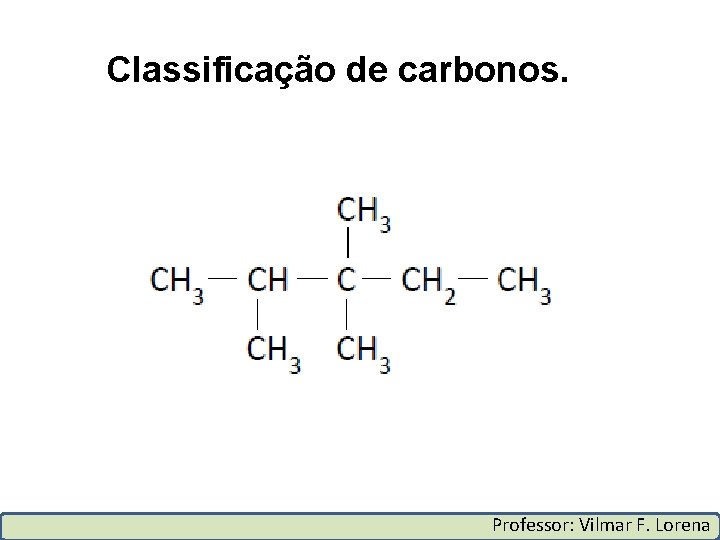
Classificação de carbonos. Carbono primário: É todo átomo de carbono ligado, no máximo, a um único átomo de carbono. Carbono secundário: É todo átomo de carbono ligado a dois outros átomos de carbono. Carbono terciário: É todo átomo de carbono ligado a três outros átomos de carbono. Carbono quaternário: É todo átomo de carbono ligado a quatro outros átomos de carbono. Professor: Vilmar F. Lorena

Classificação de carbonos. Professor: Vilmar F. Lorena

Exercícios. Professor: Vilmar F. Lorena

Exercícios. Professor: Vilmar F. Lorena

























