Por que a cor vai e volta Qumica














- Slides: 17


Por que a cor vai e volta? Química – 3ª Série – Ensino Médio Professora Jorgea Débora

Nas aulas anteriores. . . Você estudou: • Transformações químicas • Reações exotérmicas e endotérmicas • Entalpia • Energia de ligação

Agora é a sua vez! Uma floresta, após ser queimada, consegue retornar ao seu estado inicial em um tempo mínimo? A água, depois que evapora, pode voltar a ser o que era antes? Elaborado especialmente para o CMSP.

Experimento Vídeo extraído de: 3ª série EM – CMSP, 26/04/21 - 3ª série do EM - Química - Nitrogênio: Avaliação de produção consumo e utilização social. Autorizado Seduc. Disponível em: <https: //www. youtube. com/watch? v=-4 ay. L 77 l 2 L 8>. Acesso em: 3 maio 2021.

Experimento – Agora é a sua vez. . . Por que ocorre alteração na cor? Vídeo extraído de: 3ª série EM – CMSP, 26/04/21 - 3ª série do EM - Química - Nitrogênio: Avaliação de produção consumo e utilização social. Autorizado Seduc. Disponível em: <https: //www. youtube. com/watch? v=-4 ay. L 77 l 2 L 8>. Acesso em: 3 maio 2021.

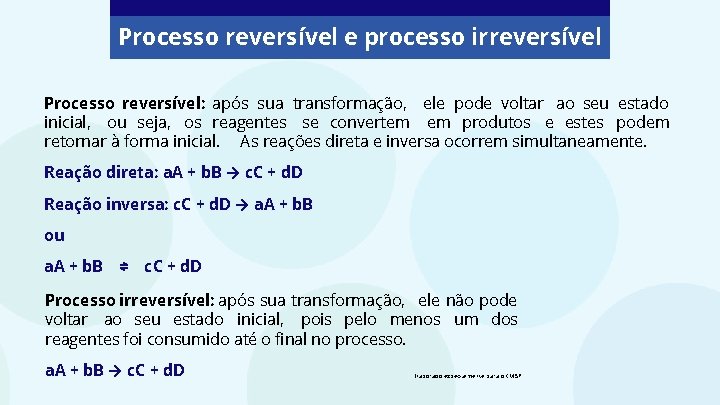
Processo reversível e processo irreversível Processo reversível: após sua transformação, ele pode voltar ao seu estado inicial, ou seja, os reagentes se convertem em produtos e estes podem retornar à forma inicial. As reações direta e inversa ocorrem simultaneamente. Reação direta: a. A + b. B → c. C + d. D Reação inversa: c. C + d. D → a. A + b. B ou a. A + b. B ⇌ c. C + d. D Processo irreversível: após sua transformação, ele não pode voltar ao seu estado inicial, pois pelo menos um dos reagentes foi consumido até o final no processo. a. A + b. B → c. C + d. D Elaborado especialmente para o CMSP

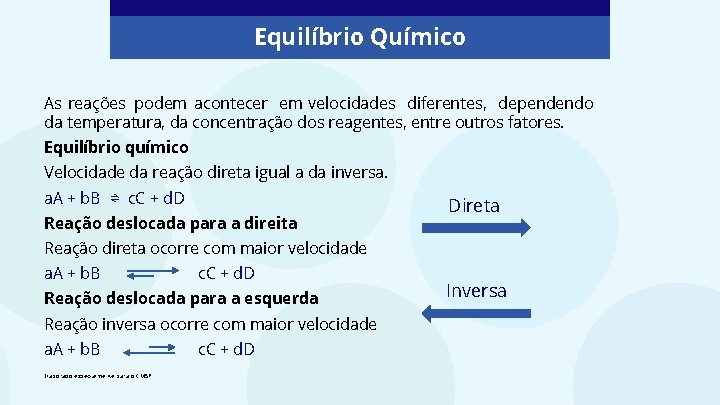
Equilíbrio Químico As reações podem acontecer em velocidades diferentes, dependendo da temperatura, da concentração dos reagentes, entre outros fatores. Equilíbrio químico Velocidade da reação direta igual a da inversa. a. A + b. B ⇌ c. C + d. D Reação deslocada para a direita Direta Reação direta ocorre com maior velocidade a. A + b. B c. C + d. D Reação deslocada para a esquerda Reação inversa ocorre com maior velocidade a. A + b. B Elaborado especialmente para o CMSP. c. C + d. D Inversa

Constante de Equilíbrio Não são observadas mudanças no sistema, pois as reações ocorrem na mesma velocidade. Coexistem em um mesmo sistema reagentes e produtos. Embora a velocidade da reação tenha atingido o equilíbrio químico, as concentrações de reagentes e produtos não são necessariamente iguais. Nesse caso, há uma relação entre eles chamada constante de equilíbrio químico (K). (CHANG e GLODSBY, 2013) *K = [produtos] n [reagentes] Em que n = coeficiente da equação química balanceada. Elaborado especialmente para o CMSP.

Constante de Equilíbrio Para a reação: a. A + b. B ⇌ c. C + d. D, temos a seguinte constante de equilíbrio: Exemplo Equação: 2 N 2 O 5 ⇔ 4 NO 2 + O 2 A expressão da constante de equilíbrio é: Elaborado especialmente para o CMSP.

Constante de Equilíbrio Como podemos interpretar a constante de equilíbrio? K > 1: haverá mais moléculas de produtos K < 1: haverá mais moléculas de reagentes Pode indicar se haverá maior concentração reagentes ou maior formação de produtos. de Pode ser determinada pela relação entre produtos e reagentes. Para Kp (em termos de pressão), participam apenas as concentrações em quantidade de matéria que podem sofrer variação, como em sistemas gasosos. Elaborado especialmente para o CMSP.

Constante de Equilíbrio – Calculando Determine o valor de Kp da reação a seguir, levando em consideração as pressões parciais dos gases que dela participam: 0, 8 atm de N 2, 2 atm de O 2 e 1 atm de NO. 1 o Passo: Montar a expressão do Kp. Kp = (p. NO) 2 (p. N 2) 1 · (p. O 2) 1 Elaborado especialmente para o CMSP. 2 o Passo: Utilizar os valores encontrados na expressão do Kp. Kp = (p. NO) 2 (p. N 2) 1 · (p. O 2) 1 Kp = (1) 2 (0, 8) 1 · (2) 1 Kp = 1 0, 8 · 2 Kp = 1 1, 6 Kp = 0, 625

Aprofundando a habilidade Aprender Sempre, 2021. Caderno do Estudante, Biologia, Física e Química, 3ª série EM, vol. 1, p. 79.

Retomada Hoje, estudamos: ©Pixabay • Processos reversíveis e irreversíveis • Velocidade no equilíbrio químico • Constante de Equilíbrio

Habilidades Interpretar a constante de equilíbrio como uma relação que indica as concentrações relativas de reagente e produtos que coexistem em equilíbrio dinâmico. Reconhecer que existem transformações químicas que não se completam, atingindo um estado chamado equilíbrio químico, em que reagentes e produtos coexistem.

Objeto do conhecimento Identificar transformações químicas como reversíveis ou não reversíveis por meio de experimento. Conceituar a constante de equilíbrio e saber aplicá-la na previsão da extensão das transformações.

Agradecimentos Obrigada a todos! ©Pixabay Bons estudos!