POTENSIAL KIMIA 7 Larutan Ideal Larutan Nonideal Potensial





- Slides: 10

POTENSIAL KIMIA 7 Larutan Ideal Larutan Nonideal

Potensial Kimia Willard Gibbs Yosia μ merupakan analog untuk potensial listrik dan potensial gravitasi , menggunakan ide yang sama dari medan gaya sebagai penyebab hal-hal yang bergerak, baik itu massa, atau, dalam hal ini, bahan kimia

Potensial kimia juga disebut sebagai energi Gibbs molar parsial Kimia potensial diukur dalam satuan energi / partikel atau, sama, energi / mol. Potensial kimia juga disebut sebagai Untuk menghitung nilainya, molar kita menggunakan energi Gibbs parsial kenyataan bahwa potensial kimia zat dalam bentuk uap encer adalah m = o + RT ln (p/po ) Harus sama dengan kesetimbangan potensial kimianya dalam cairan pada

Larutan Ideal i: Ciri-cir Homogen pada seluruh sistem mulai dari fraksi mol sampai 1. Tidak ada entalpi pencampuran pada waktu komponen dicampur membentuk larutan (ΔH Pencampuran = 0). Tidak ada beda volume pencampuran artinya volume larutan = jumlah volume komponen yang dicampur (ΔH Pencampuran = 0). Memenuhi Hukum Roult. Dalam larutan ideal, sifat komponen yang satu akan mempengaruhi sifat komponen yang lain, sehingga sifat larutan yang dihasilkan terletak diantara sifat-sifat komponenya. Contohnya sistem Benzen - Toluen

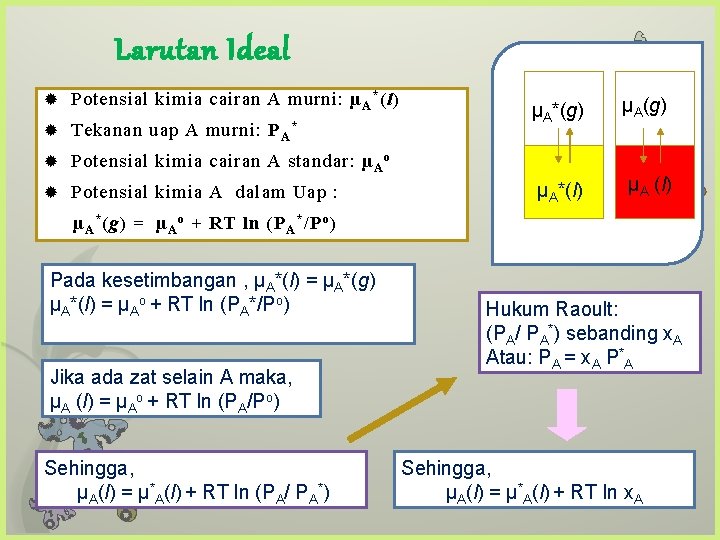
Larutan Ideal Potensial kimia cairan A murni: µ A * (l) Tekanan uap A murni: P A * Potensial kimia cairan A standar: µ A o Potensial kimia A dalam Uap : µA*(g) µA*(l) µA (l) µ A * (g) = µ A o + RT ln (P A * /P o ) Pada kesetimbangan , µA*(l) = µA*(g) µA*(l) = µAo + RT ln (PA*/Po) Jika ada zat selain A maka, µA (l) = µAo + RT ln (PA/Po) Sehingga, µA(l) = µ*A(l) + RT ln (PA/ PA*) Hukum Raoult: (PA/ PA*) sebanding x. A Atau: PA = x. A P*A Sehingga, µA(l) = µ*A(l) + RT ln x. A

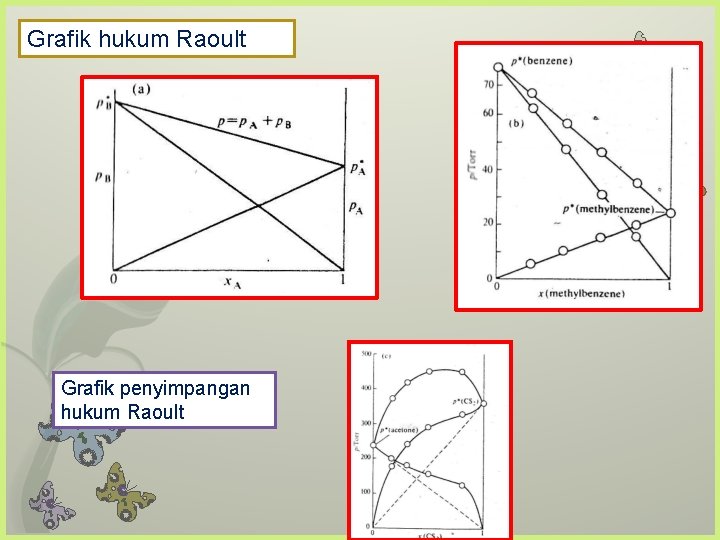
Grafik hukum Raoult Grafik penyimpangan hukum Raoult

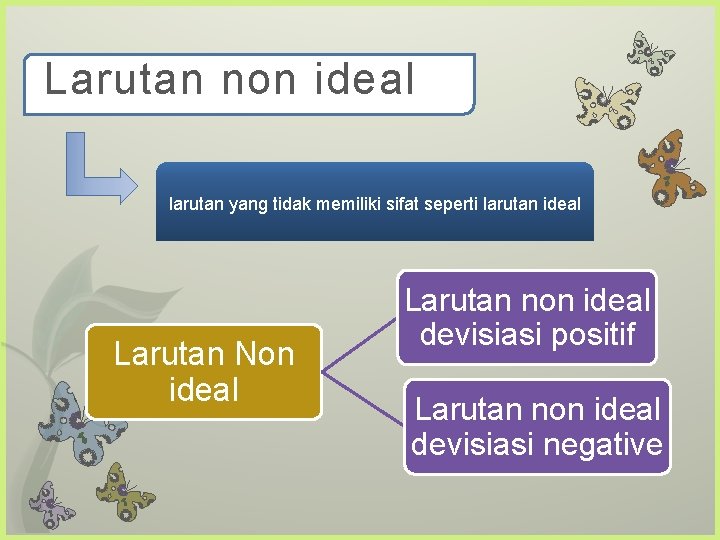
Larutan non ideal larutan yang tidak memiliki sifat seperti larutan ideal Larutan Non ideal Larutan non ideal devisiasi positif Larutan non ideal devisiasi negative

Larutan non ideal devisiasi positif • larutan yang mempunyai volume ekspansi, di mana akan menghasilkan titik didih maksimum pada sistem campuran. Contoh : Sistem aseton – karbondisulfida Sistem HCl – air Larutan non ideal devisiasi negatif • mempunyai volume kontraksi, di mana akan menghasilkan titik didih minimum pada sistem campuran. Contoh : Sistem benzen - etanol • Sistem aseton – chloroform

Tetapi Hukum Roult tak berlaku pada zat terlarut pada larutan tak ideal encer. Perbedaan ini bersumber pada kenyataan : molekul pelarut yang luar biasa banyaknya. Hal ini menyebabkan lingkungan molekul terlarut sangat berbeda dalam lingkungan pelarut murni. Zat terlarut dalam larutan tak ideal encer mengikuti Hukum Henry, bukan Hukum Roult

TERIMA KASIH


















