Post ASCO 2020 Quest ce qui va faire









- Slides: 25

Post ASCO 2020 Qu’est ce qui va faire changer (a déjà changé) la prise en charge des cancers colo-rectaux? 03/03/2020 Dr Thibault MAZARD

Cancer du rectum localisé Traitement néoadjuvant

Contexte § Cancer du rectum localisé T 3 -T 4/N+= traitement multimodal – traitement de référence depuis 2004=RCT preop (CAP 50) suivi d’ETM =>moins de 5% de récidive locale/30% d’évolution métastatique – radiothérapie courte 5 x 5 Gy=option Avec chirurgie différée, permet d’obtenir un downstaging – CT adjuvante: • Utilisation fréquente en dépit d’un rôle toujours controversé (sauf pour les yp. N+) • Compliance médiocre au traitement (43 -70%)

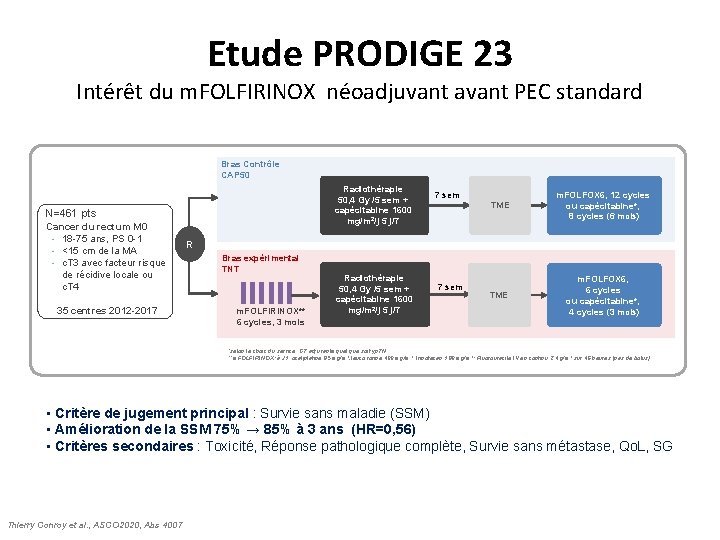
Etude PRODIGE 23 Intérêt du m. FOLFIRINOX néoadjuvant avant PEC standard Bras Contrôle CAP 50 Radiothérapie 50, 4 Gy /5 sem + capécitabine 1600 mg/m 2/j 5 j/7 N=461 pts Cancer du rectum M 0 • 18 -75 ans, PS 0 -1 • <15 cm de la MA • c. T 3 avec facteur risque de récidive locale ou c. T 4 35 centres 2012 -2017 TME m. FOLFOX 6, 12 cycles ou capécitabine*, 8 cycles (6 mois) TME m. FOLFOX 6, 6 cycles ou capécitabine*, 4 cycles (3 mois) 7 sem R Bras expérimental TNT m. FOLFIRINOX** 6 cycles, 3 mois Radiothérapie 50, 4 Gy /5 sem + capécitabine 1600 mg/m 2/j 5 j/7 7 sem *selon le choix du service, CT adjuvante quel que soit yp. TN **m. FOLFIRINOX: à J 1, oxaliplatine 85 mg/m 2, leucovorine 400 mg/m 2, Irinotécan 180 mg/m 2; Fluorouracile IV en continu 2, 4 g/m 2 sur 46 heures (pas de bolus) • Critère de jugement principal : Survie sans maladie (SSM) • Amélioration de la SSM 75% → 85% à 3 ans (HR=0, 56) • Critères secondaires : Toxicité, Réponse pathologique complète, Survie sans métastase, Qo. L, SG Thierry Conroy et al. , ASCO 2020, Abs 4007

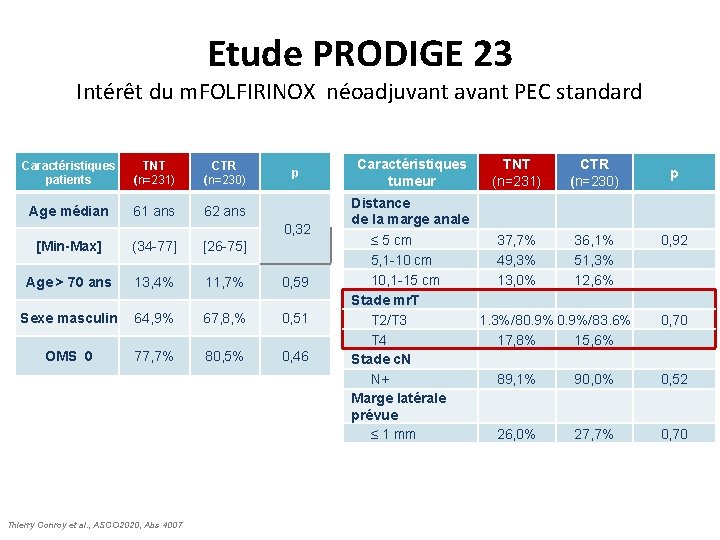
Etude PRODIGE 23 Intérêt du m. FOLFIRINOX néoadjuvant avant PEC standard Caractéristiques patients TNT (n=231) CTR (n=230) Age médian 61 ans 62 ans p 0, 32 [Min-Max] (34 -77] [26 -75] Age > 70 ans 13, 4% 11, 7% 0, 59 Sexe masculin 64, 9% 67, 8, % 0, 51 OMS 0 77, 7% 80, 5% 0, 46 Thierry Conroy et al. , ASCO 2020, Abs 4007 Caractéristiques tumeur TNT (n=231) CTR (n=230) Distance de la marge anale ≤ 5 cm 37, 7% 36, 1% 5, 1 -10 cm 49, 3% 51, 3% 10, 1 -15 cm 13, 0% 12, 6% Stade mr. T T 2/T 3 1. 3%/80. 9%/83. 6% T 4 17, 8% 15, 6% Stade c. N N+ 89, 1% 90, 0% Marge latérale prévue ≤ 1 mm 26, 0% 27, 7% p 0, 92 0, 70 0, 52 0, 70

Etude PRODIGE 23 Intérêt du m. FOLFIRINOX néoadjuvant avant PEC standard TNT (n=219) Radiochimiotherapie CRT (n 227) p Compliance TNT (n=231) CT adjuvante Traitement complet Radiotherapy > 48 Gy 98, 2% 98, 7% Capecitabine 8, 3% 3, 1% discontinuation Grade 3 -4 adverse events, % per patients Neutropenia 2, 8% 0% NS <0, 02 Chirurgie Régime utilisé m. FOLFOX 6 82, 8% 85, 4% Capecitabine 17, 2% 14, 6% Décès toxique 0% 1, 9% CRT Restaging avant chirurgie : Maladie métastatique 2 (1%) 10 (4, 7%) Chirurgie n=213* n=218 7, 9 semaines ns 0 (0%) 8 (3, 7%) 0, 007 Découverte per-op de métastase - 5 (2, 3%) Tumeur non résécable ou R 2 - 3 (1, 4%) 11 jours (3 -78) 12 jours (2 -99) ns morbidité 29, 3% 31, 2% ns mortalité 0 6 (2, 8%) 0, 52 Chirurgie non thérapeutique DMS (Min-Max) Thierry Conroy et al. , ASCO 2020, Abs 4007 p 163 (70, 6%) 158 (68, 7%) 80, 4% 75, 3% TNT Intervalle pré-op : ARCC > chir CRT (n=230) p 0, 03 ns

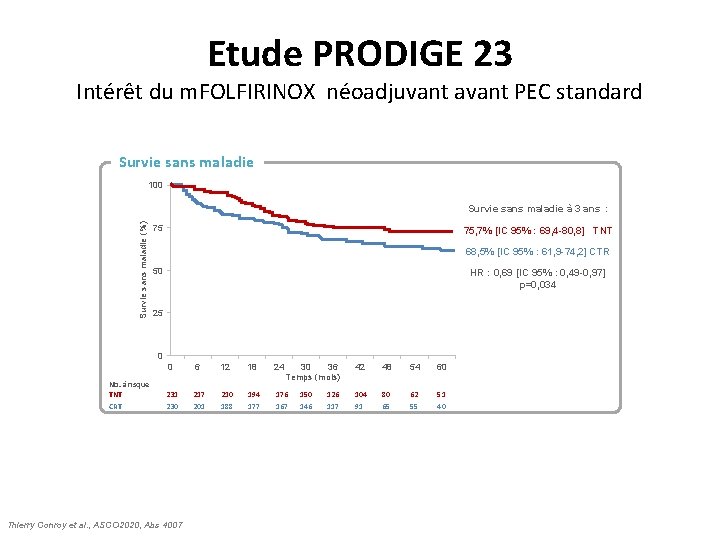
Etude PRODIGE 23 Intérêt du m. FOLFIRINOX néoadjuvant avant PEC standard Survie sans maladie 100 Survie sans maladie (%) Survie sans maladie à 3 ans : 75 75, 7% [IC 95% : 69, 4 -80, 8] TNT 68, 5% [IC 95% : 61, 9 -74, 2] CTR 50 HR : 0, 69 [IC 95% : 0, 49 -0, 97] p=0, 034 25 0 Nb. à risque TNT CRT 0 6 12 18 24 231 230 217 201 210 188 194 177 176 167 Thierry Conroy et al. , ASCO 2020, Abs 4007 30 36 Temps (mois) 150 146 126 117 42 48 54 60 104 91 80 65 62 55 51 40

Etude PRODIGE 23 Intérêt du m. FOLFIRINOX néoadjuvant avant PEC standard Réponse pathologique TNT (n=213) CRT (n=218) p Grade 1 modified Dworak’s tumor regression 47, 6% 31, 8% 0, 003 yp. T 0 28, 3% 12, 6% < 0, 001 yp. N 0 82, 6% 67, 4% < 0, 001 yp. T 0 N 0 27, 8% 12, 1% < 0, 001 Thierry Conroy et al. , ASCO 2020, Abs 4007

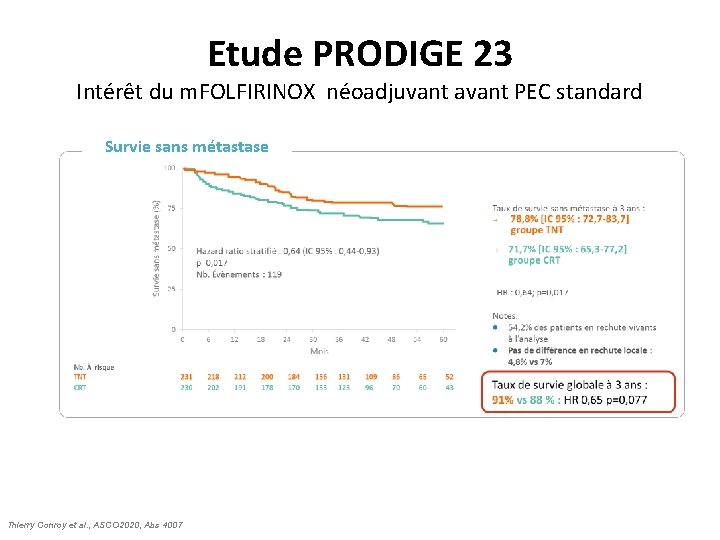
Etude PRODIGE 23 Intérêt du m. FOLFIRINOX néoadjuvant avant PEC standard Survie sans métastase Thierry Conroy et al. , ASCO 2020, Abs 4007

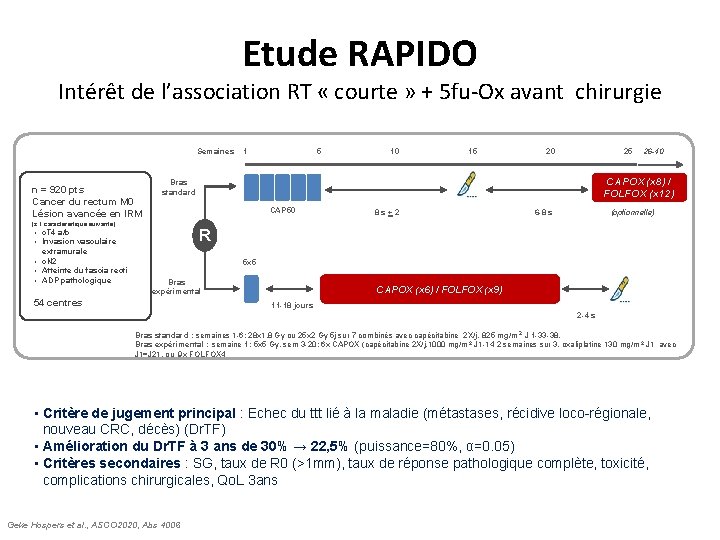
Etude RAPIDO Intérêt de l’association RT « courte » + 5 fu-Ox avant chirurgie Semaines n = 920 pts Cancer du rectum M 0 Lésion avancée en IRM 1 5 10 15 20 25 26 -40 CAPOX (x 8) / FOLFOX (x 12) Bras standard CAP 50 8 s+2 6 -8 s (optionnelle) (≥ 1 caractéristique suivante) c. T 4 a/b Invasion vasculaire extramurale • c. N 2 • Atteinte du fascia recti • ADP pathologique R • • 5 x 5 Bras expérimental 54 centres CAPOX (x 6) / FOLFOX (x 9) 11 -18 jours 2 -4 s Bras standard : semaines 1 -6: 28 x 1. 8 Gy ou 25 x 2 Gy 5 j sur 7 combinés avec capécitabine 2 X/j. 825 mg/m 2 J 1 -33 -38. Bras expérimental : semaine 1: 5 x 5 Gy, sem 3 -20: 6 x CAPOX (capécitabine 2 X/j. 1000 mg/m 2 J 1 -14 2 semaines sur 3, oxaliplatine 130 mg/m 2 J 1 avec J 1=J 21, ou 9 x FOLFOX 4 • Critère de jugement principal : Echec du ttt lié à la maladie (métastases, récidive loco-régionale, nouveau CRC, décès) (Dr. TF) • Amélioration du Dr. TF à 3 ans de 30% → 22, 5% (puissance=80%, α=0. 05) • Critères secondaires : SG, taux de R 0 (>1 mm), taux de réponse pathologique complète, toxicité, complications chirurgicales, Qo. L 3 ans Geke Hospers et al. , ASCO 2020, Abs 4006

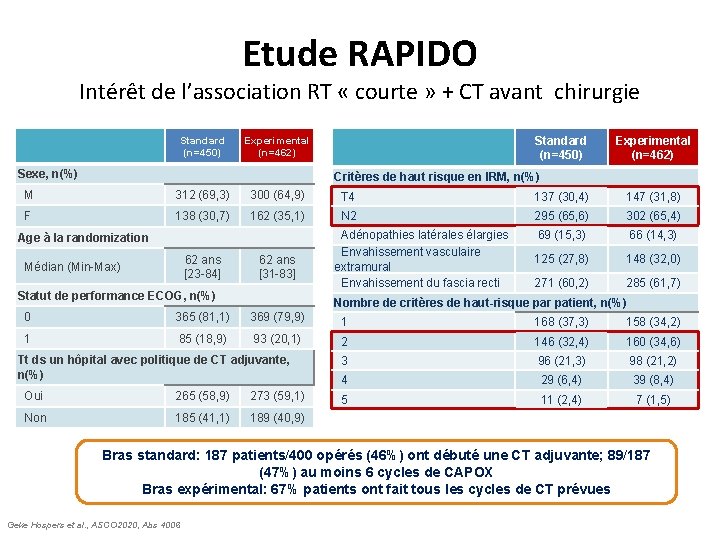
Intérêt de la RT « courte » néoadjuvante à la CT et chirurgie : Etude RAPIDO Intérêt de l’association RT « courte » + CT avant chirurgie Standard (n=450) Experimental (n=462) Sexe, n(%) Experimental (n=462) Critères de haut risque en IRM, n(%) M 312 (69, 3) 300 (64, 9) T 4 137 (30, 4) 147 (31, 8) F 138 (30, 7) 162 (35, 1) N 2 295 (65, 6) 302 (65, 4) 69 (15, 3) 66 (14, 3) 125 (27, 8) 148 (32, 0) 271 (60, 2) 285 (61, 7) Age à la randomization 62 ans [23 -84] Médian (Min-Max) 62 ans [31 -83] Statut de performance ECOG, n(%) Adénopathies latérales élargies Envahissement vasculaire extramural Envahissement du fascia recti Nombre de critères de haut-risque par patient, n(%) 0 365 (81, 1) 369 (79, 9) 1 168 (37, 3) 158 (34, 2) 1 85 (18, 9) 93 (20, 1) 2 146 (32, 4) 160 (34, 6) 3 96 (21, 3) 98 (21, 2) 4 29 (6, 4) 39 (8, 4) 5 11 (2, 4) 7 (1, 5) Tt ds un hôpital avec politique de CT adjuvante, n(%) Oui 265 (58, 9) 273 (59, 1) Non 185 (41, 1) 189 (40, 9) Bras standard: 187 patients/400 opérés (46%) ont débuté une CT adjuvante; 89/187 (47%) au moins 6 cycles de CAPOX Bras expérimental: 67% patients ont fait tous les cycles de CT prévues Geke Hospers et al. , ASCO 2020, Abs 4006

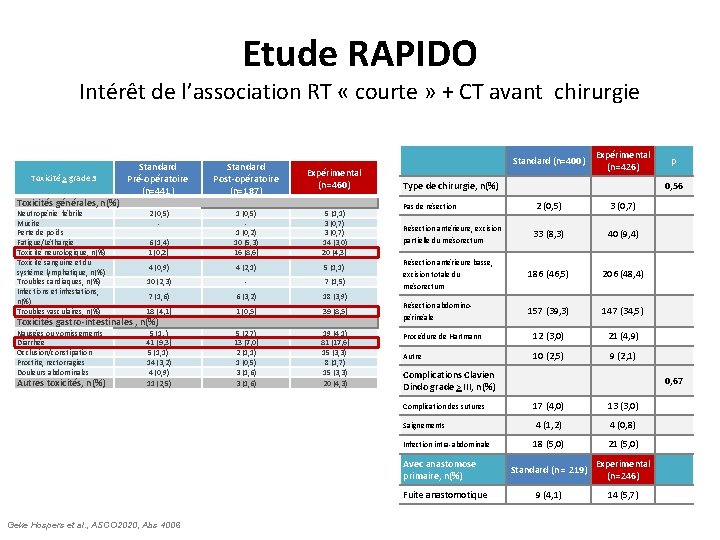
Intérêt de la RT « courte » néoadjuvante à la CT et chirurgie : Etude RAPIDO Intérêt de l’association RT « courte » + CT avant chirurgie Toxicité > grade 3 Toxicités générales, n(%) Neutropénie fébrile Mucite Perte de poids Fatigue/Léthargie Toxicité neurologique, n(%) Toxicité sanguine et du système lymphatique, n(%) Troubles cardiaques, n(%) Infections et infestations, n(%) Troubles vasculaires, n(%) Standard Pré-opératoire (n=441) Standard Post-opératoire (n=187) Expérimental (n=460) 2 (0, 5) 6 (1, 4) 1 (0, 2) 1 (0, 5) 1 (0, 2) 10 (5, 3) 16 (8, 6) 5 (1, 1) 3 (0, 7) 14 (3, 0) 20 (4, 3) 4 (0, 9) 4 (2, 1) 5 (1, 1) 10 (2, 3) - 7 (1, 5) 7 (1, 6) 6 (3, 2) 18 (3, 9) 18 (4, 1) 1 (0, 5) 39 (8, 5) 5 (1. , ) 41 (9, 3) 5 (1, 1) 14 (3, 2) 4 (0, 9) 11 (2, 5) 5 (2, 7) 13 (7, 0) 2 (1, 1) 1 (0, 5) 3 (1, 6) 19 (4, 1) 81 (17, 6) 15 (3, 3) 8 (1, 7) 15 (3, 3) 20 (4, 3) Toxicités gastro-intestinales , n(%) Nausées ou vomissements Diarrhée Occlusion/constipation Proctite, rectorragies Douleurs abdominales Autres toxicités, n(%) Standard (n=400) Type de chirurgie, n(%) 3 (0, 7) 33 (8, 3) 40 (9, 4) 186 (46, 5) 206 (48, 4) 157 (39, 3) 147 (34, 5) Procédure de Hartmann 12 (3, 0) 21 (4, 9) Autre 10 (2, 5) 9 (2, 1) Résection antérieure, excision partielle du mésorectum p 0, 56 2 (0, 5) Pas de résection Résection antérieure basse, excision totale du mésorectum Résection abdominopérinéale Complications Clavien Dindo grade > III, n(%) Complication des sutures Saignements Infection intra-abdominale Avec anastomose primaire, n(%) Fuite anastomotique Geke Hospers et al. , ASCO 2020, Abs 4006 Expérimental (n=426) 0, 67 17 (4, 0) 13 (3, 0) 4 (1, 2) 4 (0, 8) 18 (5, 0) 21 (5, 0) Standard (n = 219) Experimental (n=246) 9 (4, 1) 14 (5, 7)

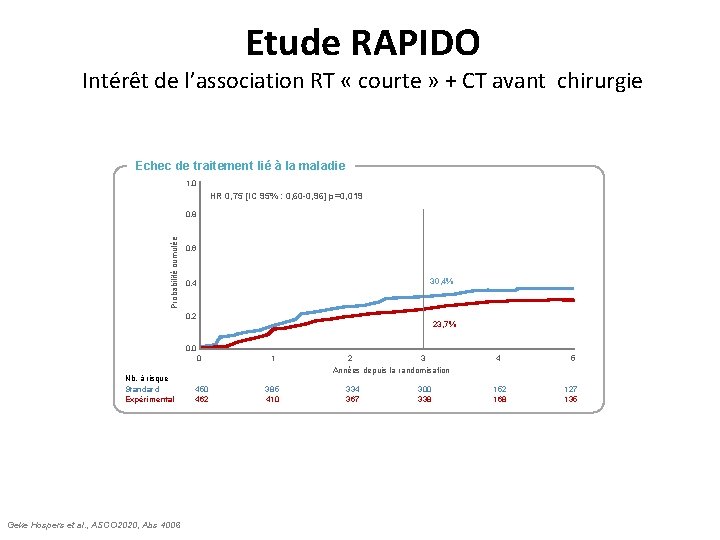
Etude RAPIDO Intérêt de l’association RT « courte » + CT avant chirurgie Echec de traitement lié à la maladie 1, 0 HR 0, 75 [IC 95% : 0, 60 -0, 96] p=0, 019 Probabilité cumulée 0, 8 0, 6 30, 4% 0, 4 0, 2 23, 7% 0, 0 Nb. à risque Standard Expérimental Geke Hospers et al. , ASCO 2020, Abs 4006 0 1 450 462 385 410 2 3 Années depuis la randomisation 334 367 300 338 4 152 168 5 127 135

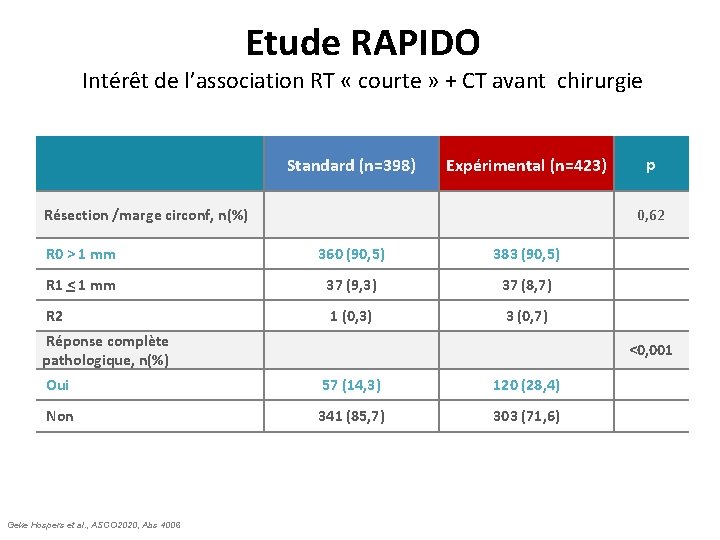
Intérêt de la RT « courte » néoadjuvante à la CT et chirurgie : Etude RAPIDO Intérêt de l’association RT « courte » + CT avant chirurgie Standard (n=398) Expérimental (n=423) Résection /marge circonf, n(%) 0, 62 R 0 > 1 mm 360 (90, 5) 383 (90, 5) R 1 < 1 mm 37 (9, 3) 37 (8, 7) R 2 1 (0, 3) 3 (0, 7) Réponse complète pathologique, n(%) <0, 001 Oui 57 (14, 3) 120 (28, 4) Non 341 (85, 7) 303 (71, 6) Geke Hospers et al. , ASCO 2020, Abs 4006 p

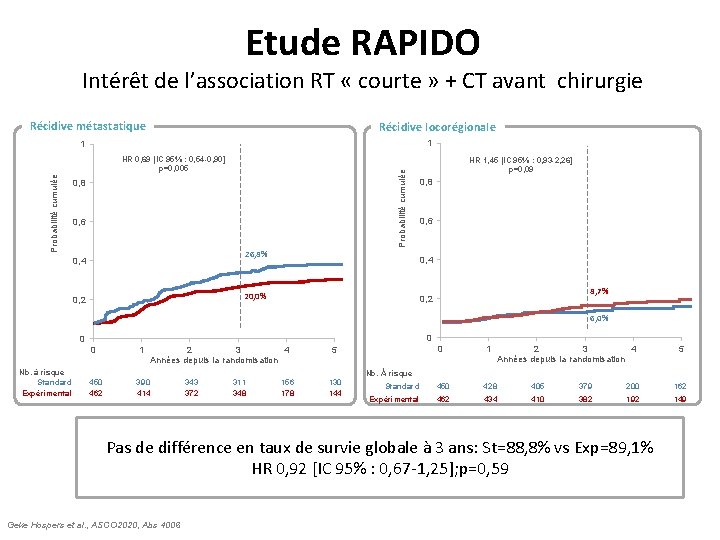
Intérêt de la RT « courte » néoadjuvante à la CT et chirurgie : Etude RAPIDO Intérêt de l’association RT « courte » + CT avant chirurgie Récidive métastatique Récidive locorégionale 1 1 Probabilité cumulée HR 0, 69 [IC 95% : 0, 54 -0, 90] p=0, 005 0, 8 0, 6 26, 8% 0, 4 0, 8 0, 6 0, 4 20, 0% 0, 2 HR 1, 45 [IC 95% : 0, 93 -2, 26] p=0, 09 8, 7% 0, 2 6, 0% 0 0 0 Nb. à risque Standard Expérimental 450 462 1 2 3 4 Années depuis la randomisation 390 414 343 372 311 348 156 178 0 5 130 144 1 2 3 4 Années depuis la randomisation Nb. À risque Standard 450 428 405 379 200 162 Expérimental 462 434 410 382 192 149 Pas de différence en taux de survie globale à 3 ans: St=88, 8% vs Exp=89, 1% HR 0, 92 [IC 95% : 0, 67 -1, 25]; p=0, 59 Geke Hospers et al. , ASCO 2020, Abs 4006 5

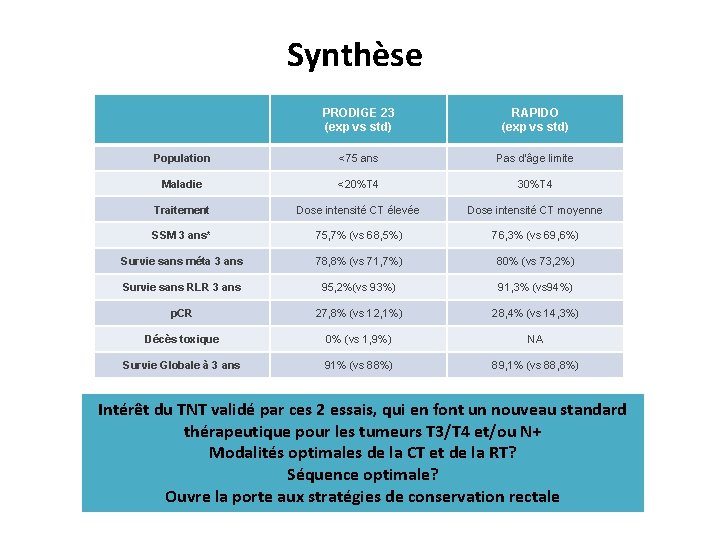
Synthèse PRODIGE 23 (exp vs std) RAPIDO (exp vs std) Population <75 ans Pas d’âge limite Maladie <20%T 4 30%T 4 Traitement Dose intensité CT élevée Dose intensité CT moyenne SSM 3 ans* 75, 7% (vs 68, 5%) 76, 3% (vs 69, 6%) Survie sans méta 3 ans 78, 8% (vs 71, 7%) 80% (vs 73, 2%) Survie sans RLR 3 ans 95, 2%(vs 93%) 91, 3% (vs 94%) p. CR 27, 8% (vs 12, 1%) 28, 4% (vs 14, 3%) Décès toxique 0% (vs 1, 9%) NA Survie Globale à 3 ans 91% (vs 88%) 89, 1% (vs 88, 8%) Intérêt du TNT validé par ces 2 essais, qui en font un nouveau standard thérapeutique pour les tumeurs T 3/T 4 et/ou N+ Modalités optimales de la CT et de la RT? Séquence optimale? Ouvre la porte aux stratégies de conservation rectale

Cancer colorectal métastatique MSI

Contextete –Instabilité microsatellitaire ou déficience MMR (d. MMR) observée chez environ 5% des patients avec un CCRm (constitutionnelle ou sporadique) –Facteur prédictif d’efficacité des inhibiteurs des points de contrôle (checkpoint) immunitaires. –Pembrolizumab: activité antitumorale durable avec un profil de sécurité acceptable dans les tumeurs MSI métastatiques préalablement traitées par chimiothérapie dans plusieurs phase II.

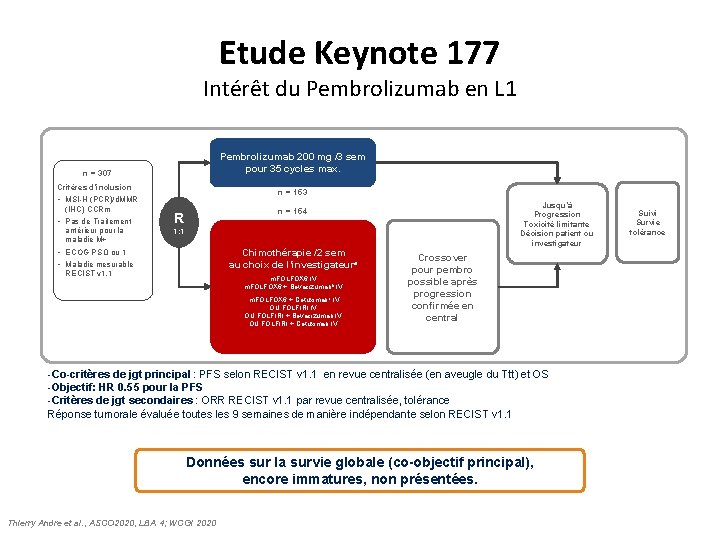
Etude Keynote 177 Intérêt du Pembrolizumab en L 1 Pembrolizumab 200 mg /3 sem pour 35 cycles max. n = 307 Critères d’inclusion n = 153 • MSI-H (PCR)/d. MMR (IHC) CCRm • Pas de Traitement antérieur pour la maladie M+ Jusqu’à Progression Toxicité limitante Décision patient ou investigateur n = 154 R 1: 1 • ECOG PS 0 ou 1 • Maladie mesurable Chimothérapie /2 sem au choix de l’investigateura RECIST v 1. 1 m. FOLFOX 6 IV m. FOLFOX 6 + Bevacizumabb IV m. FOLFOX 6 + Cetuximab c IV OU FOLFIRI + Bevacizumab IV OU FOLFIRI + Cetuximab IV Crossover pour pembro possible après progression confirmée en central -Co-critères de jgt principal : PFS selon RECIST v 1. 1 en revue centralisée (en aveugle du Ttt) et OS -Objectif: HR 0. 55 pour la PFS -Critères de jgt secondaires : ORR RECIST v 1. 1 par revue centralisée, tolérance Réponse tumorale évaluée toutes les 9 semaines de manière indépendante selon RECIST v 1. 1 Données sur la survie globale (co-objectif principal), encore immatures, non présentées. Thierry Andre et al. , ASCO 2020, LBA 4; WCGI 2020 Suivi Survie tolérance

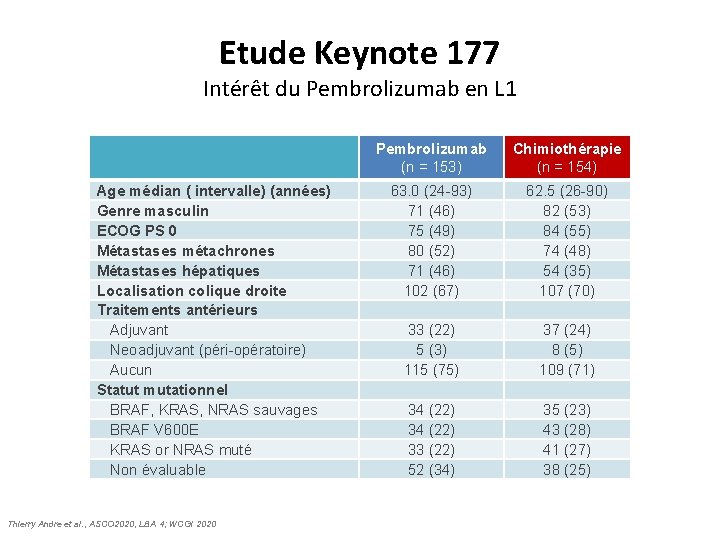
Pembrolizumab vs CT en L 1 du CCRm MSI Etude Keynote 177 Intérêt du Pembrolizumab en L 1 Age médian ( intervalle) (années) Genre masculin ECOG PS 0 Métastases métachrones Métastases hépatiques Localisation colique droite Traitements antérieurs Adjuvant Neoadjuvant (péri-opératoire) Aucun Statut mutationnel BRAF, KRAS, NRAS sauvages BRAF V 600 E KRAS or NRAS muté Non évaluable Thierry Andre et al. , ASCO 2020, LBA 4; WCGI 2020 Pembrolizumab (n = 153) Chimiothérapie (n = 154) 63. 0 (24 -93) 71 (46) 75 (49) 80 (52) 71 (46) 102 (67) 62. 5 (26 -90) 82 (53) 84 (55) 74 (48) 54 (35) 107 (70) 33 (22) 5 (3) 115 (75) 37 (24) 8 (5) 109 (71) 34 (22) 33 (22) 52 (34) 35 (23) 43 (28) 41 (27) 38 (25)

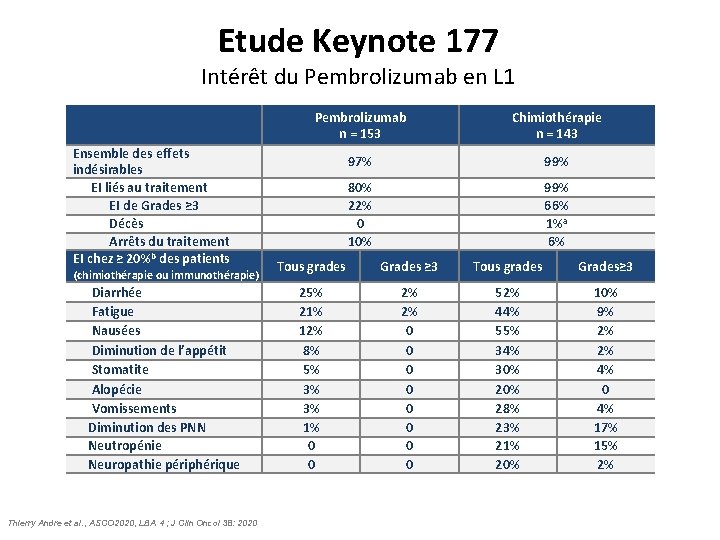
Etude Keynote 177 Intérêt du Pembrolizumab en L 1 Ensemble des effets indésirables EI liés au traitement EI de Grades ≥ 3 Décès Arrêts du traitement EI chez ≥ 20%b des patients (chimiothérapie ou immunothérapie) Diarrhée Fatigue Nausées Diminution de l’appétit Stomatite Alopécie Vomissements Diminution des PNN Neutropénie Neuropathie périphérique Thierry Andre et al. , ASCO 2020, LBA 4 ; J Clin Oncol 38: 2020 Pembrolizumab n = 153 Chimiothérapie n = 143 97% 99% 80% 22% 0 10% 99% 66% 1%a 6% Tous grades Grades ≥ 3 Tous grades Grades≥ 3 25% 21% 12% 8% 5% 3% 3% 1% 0 0 2% 2% 0 0 0 0 52% 44% 55% 34% 30% 28% 23% 21% 20% 10% 9% 2% 2% 4% 0 4% 17% 15% 2%

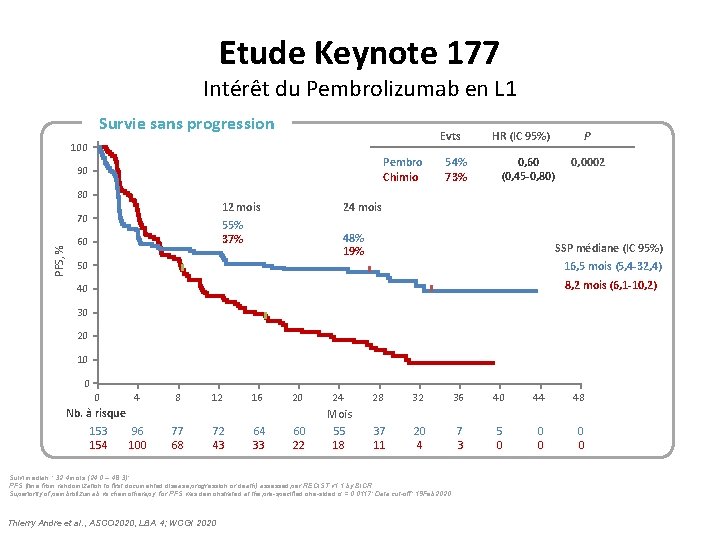
Pembrolizumab vs CT en L 1 du CCRm MSI Etude Keynote 177 Intérêt du Pembrolizumab en L 1 Survie sans progression Evts 100 Pembro Chimio 90 80 12 mois PFS, % 70 0, 60 (0, 45 -0, 80) P 0, 0002 24 mois 55% 37% 60 54% 73% HR (IC 95%) 48% 19% 50 SSP médiane (IC 95%) 16, 5 mois (5, 4 -32, 4) 8, 2 mois (6, 1 -10, 2) 40 30 20 10 0 0 4 8 12 16 20 24 28 32 36 40 44 48 60 22 Mois 55 18 37 11 20 4 7 3 5 0 0 0 Nb. à risque 153 154 96 100 77 68 72 43 64 33 Suivi median : 32, 4 mois (24, 0 – 48, 3); PFS (time from randomization to first documented disease progression or death) assessed per RECIST v 1. 1 by BICR. Superiority of pembrolizumab vs chemotherapy for PFS was demonstrated at the pre-specified one-sided α = 0. 0117; Data cut-off: 19 Feb 2020. Thierry Andre et al. , ASCO 2020, LBA 4; WCGI 2020

Etude Keynote 177 Pembrolizumab vs CT en L 1 du CCRm MSI Intérêt du Pembrolizumab en L 1 SSP : Analyse de sous-groupes Events/Patients, N HR (IC 95% Ensemble des patients 195/307 0. 60 (0. 45 -0. 80) Age ≤ 70 ans 132/217 0. 52 (0. 37 -0. 75) 63/90 0. 77 (0. 46 -1. 27) Sexe Masculin 91/153 0. 59 (0. 38 -0. 90) Féminin 104/154 0. 58 (0. 39 -0. 87) >70 ans Statut ECOG 0 1 Zone géographique Asie 90/159 0. 37 (0. 24 -0. 59) 105/148 0. 84 (0. 57 -1. 24) 28/48 0. 65 (0. 30 -1. 41) Europe occidentale/NA 146/222 Reste du monde Stade Récurrent metachrone 21/37 0. 40 (0. 16 -0. 98) 87/154 0. 53 (0. 34 -0. 82) Nouvellement diagnostiqué 108/153 BRAF WT 0. 62 (0. 44 -0. 87) 0. 70 (0. 47 -1. 04) 78/131 0. 50 (0. 31 -0. 80) 51/77 0. 48 (0. 27 -0. 86) KRAS/NRAS tous WT 95/151 0. 44 (0. 29 -0. 67) KRAS or NRAS Muté 51/74 1. 19 (0. 68 -2. 07) BRAF V 600 E Site de la tumeur primitive Colon droit 137/209 Colon gauche 50/88 0. 54 (0. 38 -0. 77) 0. 81 (0. 46 -1. 43) Bénéfice 10 0. 1 Bénéfice 1 pembrolizumab chimothérapie Thierry Andre et al. , ASCO 2020, LBA 4; WCGI 2020

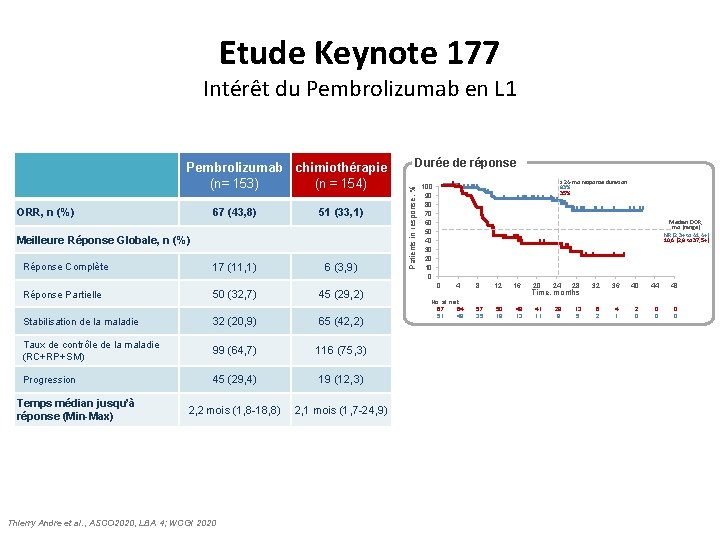
Etude Keynote 177 Intérêt du Pembrolizumab en L 1 ORR, n (%) 67 (43, 8) 51 (33, 1) Réponse Complète 17 (11, 1) 6 (3, 9) Réponse Partielle 50 (32, 7) 45 (29, 2) Meilleure Réponse Globale, n (%) Stabilisation de la maladie 32 (20, 9) 65 (42, 2) Taux de contrôle de la maladie (RC+RP+SM) 99 (64, 7) 116 (75, 3) Progression 45 (29, 4) 19 (12, 3) 2, 2 mois (1, 8 -18, 8) 2, 1 mois (1, 7 -24, 9) Temps médian jusqu’à réponse (Min-Max) Thierry Andre et al. , ASCO 2020, LBA 4; WCGI 2020 Durée de réponse Patients in response, % Pembrolizumab chimiothérapie (n= 153) (n = 154) ≥ 24 -mo response duration 83% 35% 100 90 80 70 60 50 40 30 20 10 0 Median DOR, mo (range) NR (2, 3+ to 41, 4+) 10, 6 (2, 8 to 37, 5+) 0 4 No. at risk 67 64 51 48 8 57 35 12 16 50 19 48 13 20 24 28 32 36 40 44 48 41 11 29 9 13 5 6 2 4 1 2 0 0 0 Time, months

Pembrolizumab vs CT en L 1 du CCRm MSI Synthèse Le Pembrolizumab devient le standard de 1 e ligne pour les CCRm MSI/d. MMR Guérison à long terme? Peut-on encore améliorer ces résultats? (notamment pour les « progresseurs rapides » ) : double inhibition des checkpoints? Autres combinaisons? . . . Thierry Andre et al. , ASCO 2020, LBA 4 ; J Clin Oncol 38: 2020
 Faire la guerre faire la paix hggsp
Faire la guerre faire la paix hggsp Asco coi
Asco coi Guias asco
Guias asco Asco gu san francisco
Asco gu san francisco Gunter von minckwitz
Gunter von minckwitz 2017 asco oncology practice conference
2017 asco oncology practice conference Mi restaurante favorito
Mi restaurante favorito Asco 2017 virtual meeting
Asco 2017 virtual meeting Avec tous ceux qui t'aiment
Avec tous ceux qui t'aiment Toi qui plies, toi qui pleures
Toi qui plies, toi qui pleures Post mortem bahasa melayu
Post mortem bahasa melayu Laissez faire theory
Laissez faire theory Concept board marketing
Concept board marketing Une ouverture dans une conclusion
Une ouverture dans une conclusion Template lapbook
Template lapbook Orientation bac es
Orientation bac es Faire entrer l école dans l ère du numérique
Faire entrer l école dans l ère du numérique Je suis fauche
Je suis fauche Mot de bienvenue au culte d'adoration
Mot de bienvenue au culte d'adoration Le fordisme
Le fordisme Comment faire un diaporama avec open office
Comment faire un diaporama avec open office Laissez-faire
Laissez-faire Principe du microscope polarisant
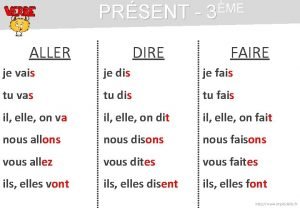
Principe du microscope polarisant Tu vas faire les courses
Tu vas faire les courses Rapport structure
Rapport structure Voir plus que parfait
Voir plus que parfait