n1d ns np Svojstva elemenata I grupe Ia











- Slides: 12

(n-1)d ns np

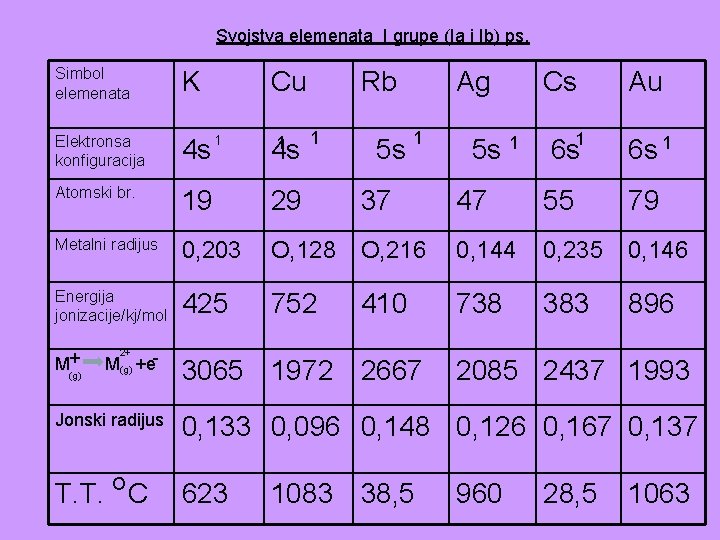
Svojstva elemenata I grupe (Ia i Ib) ps. Simbol elemenata K Cu Rb 1 Ag 1 Cs Au 6 s 1 Elektronsa konfiguracija 4 s Atomski br. 19 29 37 47 55 79 Metalni radijus 0, 203 O, 128 O, 216 0, 144 0, 235 0, 146 Energija jonizacije/kj/mol 425 752 410 738 383 896 M+ (g) 2+ M(g) +e- 1 1 4 s 5 s 3065 1972 2667 5 s 1 2085 2437 1993 Jonski radijus 0, 133 0, 096 0, 148 0, 126 0, 167 0, 137 T. T. O C 623 1083 38, 5 960 28, 5 1063

Latinski naziv za bakar je cuprum iz kojeg je izveden simbol za elemenat. Bakar je poznat od davnina, kao osovni sastojak bronze. Zapravo, poznat je još u praistorijsko doba, pa se i doba u ljudskoj istoriji naziva Bakarnim dobom. Stari Grci su ga nazivali halkos, ali su takođe nazivali i mesing i bronzu. Danas je ova reč deo kovanica za razne minerale koji sadrže bakar poput halkopirita i halkozina. Vazne su i legure bakra sa kalajem-bronza(bronze mogu biti razlicite u zavisnosti od primese), cinkom- mesing i novo srebro.

Osobine bakra -svetlocrvenkaste boje -mekan, ali vrlo zilav i rastegljiv metal -koristi se kao provodnik elektriciteta i toplote (umesto srebra, jer je jeftiniji) -spada u plemenite metale(imaju pozitivne vrednosti redoks-potencijala, tesko stupaju u jednjenja i jaka su oksidovana sredstva, otporni prema koroziji. . . ) -Na vazduhu ne podleže koroziji, ali dugim stajanjem na njemu bakar se prevlači zelenom patinom baznih soli bakra (hidroksi karbonata, hidroksisulfata ili hidroksihlorida). -Bakar se rastvara u hladnoj razblazenoj azotnoj kiselini: + - 2+ 3 Cu + 8 H 3 O + 2 NO 3 3 Cu + 2 NO + 12 H 2 O -Uz prisustvo kiseonika iz vazduha bakar serastvara u razblazenoj H 2 SO 4 i koncentrovanoj HCl kiselini : 22+ 2+ 2 Cu + 4 H 3 O + 2 SO 4 + O 2 2 (Cu + SO 4 ) + 6 H 2 O + 2 Cu + 4 H 3 O + 8 Cl + O 2 2 - 2 Cu. Cl 4 + 6 H 2 O -Rude: halkopirit Cu. Fe. S 2 , halkozin Cu 2 S, kovelin Cu. S. . .

Bakar se dobija iz ruda pirometaluski: Cu 2 S(1) + 2 Cu 2 O(1) 6 Cu (1) + SO 2 (g) I hidrometalurski : 2+ 2 - Cu(aq) + SO 4(aq) + Fe(s) 2+ 2 - Fe(aq) + SO 4(aq) + Cu (s) Primena: -u elektrotehnici u vidu provodnika, elektromotora, generatora, transformatora, i za izradu grejnih tela. Bakar je i vazan biogeni element. Nalazi se u eritrocitima, krvnoj plazmi. Jetri Misicima, kostima. . . Nedostatak bakra u organizmu ometa sintezu hemoglobina. Cu 2+ – joni regulisu u organizmu redoks procese, uticu na sintezu vitamina, masti i proteina.

Ag Latinski naziv za srebro je argentum. Osobine srebra -beo sjajan metal -tvrdji je od bakra i zlata (najbolje se izvlaci u zice i kuje od svih metala) -od srebra nema boljeg provodnika toplote i elektriciteta -spada u plemenite metale -Usled dužeg staјanja na vazduhu srebro se prevlači tankim crnim sloјem, dejstvom tragova H 2 S: 4 Ag(s) + O 2(g) + 2 H 2 S (s) 2 Ag 2 S (s) + 2 H 2 O -srebro se rastvara u razblazenoj azotnoj kiselini: + + 3 Ag + 4 H 3 O + NO 3 3 Ag + NO(g) + 6 H 2 O

Srebro ima nekoliko svoјih minerala kao što su : argentit (Ag 2 S), bromargentit (Ag. Br) ili karargentit (Ag. Cl); Uglavnom se dobiјa kao sporedni proizvod prerade ruda drugih metala. Primena: -za izradu nakita, laboratorijsko i drugo posudje, fotohemikalije. -u tehnici se koristi za izradu aparata i mernih instrumenata velike tacnosti -za izradu ogledala -za prevlacenje manje plemenitih metala, legure. . . -Ag -jon ima baktericno delovanje, pa se koristi u medicini i za dezinfekciju vode.

Jedinjenja bakra i srebra U jedinjenjima ox. br. bakra moze da bude +1, +2, +3 Najcesci ox. br. bakra u stabilnim jedinjenjima je +2, a srebra +1 Bakar(II)-oksid (Cu. O) Pri zagrevanju bakra u prisustvu vazduha: 2 Cu(S) + O 2(g) 2 Cu. O(s) a i zagravanjem bakar(II)-nitrata ili hidroksida nastaje kristalni crni prah bakar(II)-oksid. Taj bazni oksid, sa kiselinama gradi bakar(II)-soli: 2+ + Cu. O + 2 H 3 O Cu + 3 H 2 O Cu. O 2 primena: -u tahnici kao ispravljac naizmenicne struje -u laboratorijama koristi se za dokazivanje ugljenika i vodonika u organskim jedinjenjima, pri cemu se i sam redukuje do bakar(I)-oksida -za bojenje stakla i emajla u plavu ili zelenu boju

Dejstvom baza na bakar(II) soli dolazi do talozenja bakra(II)-hidroksida 2+ - Cu(aq) +2 OH(aq) Cu(OH)2(s) Bakar(II)-hidroksid ima pretezno bazna svojstva, ali se dobro rastvara u kiselinama, sa viskom baza slabo reaguje. U amonijaku se rastvara gradeci plavi kompleksni tetraaminbakar(II)-jon 2+ Cu(OH)2 + 4 NH 3 Cu(NH 3)4 + 2 OH Ovaj rastvor se koristi kao rastvarac za celulozu, pri proizvodnji vestackih vlakna. Bakar(II)-sulfat pentahidrat (Cu. SO 4 5 H 2 O ) je najpoznatija so bakra(II), poznata je i pod nazivom plavi kamen ili plava glinica. Plava glinica se upotrebljava kao fungcid (protiv gljiva) i insekticid u vocarstvu I vinogradarstvu, jer Cu-jon ima otrovno dejstvona nize organizme. Vodeni rastvori bakra(II) jedinjenja su plavicaste boje zbog nastajanja Heksaakva-bakar(II)-jona: 2+ 2+ Cu + 6 H 2 O Cu(H 2 O)6

Halogenidi srebra Poznata su 4 halogenida, koja nastaju delovanjem odgovarajuceg halogenidnog jona na rastvor koji sadrzi Ag-jon. U vodi je tastvoran samo srebro(I)fluorid, Ag. F. Ostale halogenide razlikujemo na osnovu rastvorljivosti u amonijaku: srebro(I)-hlorid se lako radtvara gradeci kompleksno jedinjenje: + Ag. Cl(s) + 2 NH 3 Ag(NH 3)2 + Cl diaminosrebro(I)-hlorid Srebro(I)-bromid (Ag. Br) se slabo rastvara, a srebro(I)-jodid (Ag. I) neznatno. Hlorid, bromid i jodid srebra(I) dobro se rastvaraju u rastvorima cijanida , gradeci komleksna jedinjenja: Ag. X(s) + 2 CN Ag(CN) 2 + X X=Cl, Br, I dicijanoagrantat(I)-jon U vodi triosulfat je vazan um fotografiji, jer se neizreagovana srebrna so , prevodjenjem u kompleksni triosulfat, uklanja sa filma ili ploca: 23 Ag. Br + 2 S 2 O 3 Ag(S 2 O 3)2 + Br Pod uticajem svetlosti, halogenidi srebra se polako razlazu na srebro i halogeni element: 2 Ag. X (s) hv 2 Ag (s) + X 2

Srebro(II)-nitrat (Ag. NO 3) nastaje rastvaranjem srebrau azotnoj kiselini: + + 3 Ag + 4 H 3 O + 4 NO 3 (s) (aq) (ag) + 3(Ag + NO 3 ) + NO (g)+ 6 H 2 O (aq) To je bela kristalna supstanca dobro rastvorna u vodi. + Koristi se u reakcijama kada je potreban Ag –jon u vodenim rastvorima, ža sluzi i Kao reagens u analirickoj hemiji.

Jovana Dobrosavljevic II/2
 Elementi 14 grupe
Elementi 14 grupe Rasprostranjenost elemenata u prirodi
Rasprostranjenost elemenata u prirodi Periodni sistem elemenata prezentacija
Periodni sistem elemenata prezentacija Kontrast svjetlo tamno
Kontrast svjetlo tamno Elementi 16 grupe
Elementi 16 grupe D elementi
D elementi Nernstova jednadžba
Nernstova jednadžba Kemija 7 razred ponavljanje
Kemija 7 razred ponavljanje Periodni sustav elemenata
Periodni sustav elemenata Istorija periodnog sistema elemenata
Istorija periodnog sistema elemenata Mendeljejev zakon periodicnosti
Mendeljejev zakon periodicnosti Atomski broj hlora
Atomski broj hlora Elementi 3 grupe periodnog sistema
Elementi 3 grupe periodnog sistema