Luku 1 Jaksollinen jrjestelm Jaksollisen jrjestelmn kertaus Metalliepmetalliluonne











- Slides: 12

Luku 1, Jaksollinen järjestelmä Jaksollisen järjestelmän kertaus Metalli-/epämetalliluonne Elektronegatiivisuus ja sidokset Atomien ja ionien koko jaksollisen järjestelmän perusteella • Hapan ja emäksinen oksidi • •

Mitä muistat jaksollisesta järjestelmästä?

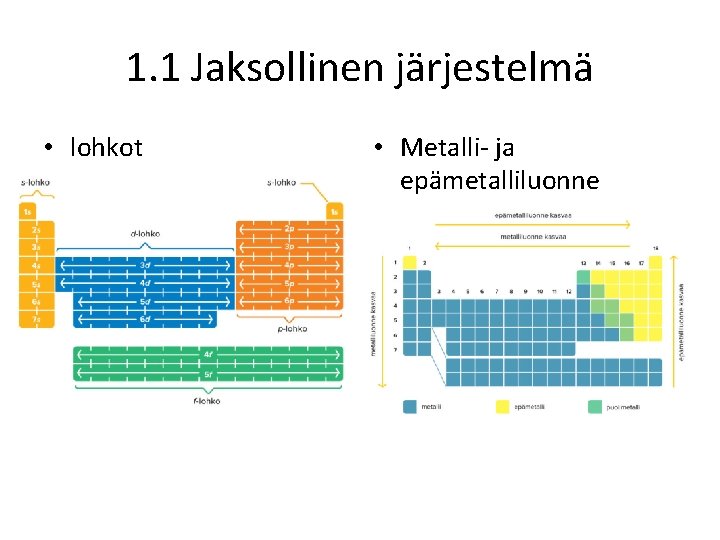
1. 1 Jaksollinen järjestelmä • Alkuaineet on järjestetty jaksoihin ja ryhmiin protonien määrän eli järjestyslukujen mukaan • Jakso (vaakarivi) kertoo, monellako kuorella alkuaineella on elektroneja • Pääryhmän (1, 2 ja 13 -18) numero kertoo ulkoelektronien määrän • Ryhmät 3 -12 ovat sivuryhmiä • Jaksollinen järjestelmä jaetaan lohkoihin sen mukaan, millä orbitaalilla (s, p, d, f) uloimmat elektronit ovat

1. 1 Jaksollinen järjestelmä • lohkot • Metalli- ja epämetalliluonne

1. 2 Elektronegatiivisuus ja sidoksen luonne • Elektronegatiivisuus: atomin kyky vetää sidoselektroneja puoleensa. Mitä suurempi arvo, sitä voimakkaammin vetää elektroneja puoleensa.

1. 2 Elektronegatiivisuus ja sidoksen luonne • Mitä suurempi on elektronegatiivisuus arvojen ero, sitä enemmän sidoksella on ioniluonnetta. • Jos sidoksen ioniluonne on yli 50% (ero n. 1, 7), se luokitellaan ionisidokseksi.

1. 3 Atomin ja ionin koko • Miksi atomikoko muuttuu kuvan osoittamalla tavalla?

1. 3 Atomin ja ionin koko • Ryhmässä alaspäin koko kasvaa, koska energiatasojen määrän kasvaessa niiden etäisyys ytimestä kasvaa • Jaksossa oikealle koko pienenee, koska protonien määrä ytimessä kasvaa, jolloin sen vetovoima kasvaa • Pääryhmien metalleilla suuremmat atomit ovat reaktiivisempia kuin pienemmät, koska kauempana olevat elektronit irtoavat helpommin ytimen pienemmän vetovoiman ja elektronien keskinäisen hylkimisen takia • Epämetalleilla pienemmät atomit ovat reaktiivisempia kuin suuremmat, koska pienemmän atomin ydin vetää voimakkaammin puoleensa muiden atomien elektroneja

1. 3 Atomin ja ionin koko • Ionisoitumisenergia: Energia, joka tarvitaan kun kaasutilassa olevasta atomista irrotetaan elektroneja (MAOL s. 142) • Elektroniaffiniteetti: Energia, joka vapautuu tai sitoutuu kun kaasutilassa olevaan atomiin liittyy elektroneja

1. 3 Atomin ja ionin koko • Miten koko muuttuu, kun atomista tulee positiivinen tai negatiivinen ioni? Miksi?

1. 3 Atomin ja ionin koko • Positiivinen ioni on pienempi kuin saman alkuaineen atomi, koska protoneja on enemmän kuin elektroneja, jolloin ytimen vetovoima on suurempi ja elektronien hylkiminen vähenee (ja atomin uloin energia taso on ”poistunut”) • Negatiivinen ioni on suurempi kuin saman alkuaineen atomi, koska elektroneja on enemmän kuin protoneja, ytimen vetovoima heikkenee ja elektronien hylkiminen lisääntyy

1. 4 Oksidien happo-emäsluonne • Metallioksidit ovat ioniyhdisteitä. Yleensä ne ovat emäksisiä oksideja, eli niiden reagoidessa veden kanssa syntyy emäksinen liuos. • Epämetallioksidit ovat molekyyliyhdisteitä. Yleensä ne ovat happamia oksideja, eli veden kanssa reagoidessa syntyy hapan liuos. Aiheuttavat happamia sateita, joista on haittaa kasveille. Merkittävimpiä ovat rikin ja typen oksidit.






















