La natura atomica della materia 4 Elemento specie

















- Slides: 19

La natura atomica della materia 4

Elemento= specie atomica • • • Idrogeno, H Elio, He Litio, Li Berillio, Be Boro, B Carbonio, C Azoto, N Ossigeno, O Fluoro, F Neon, Ne • • • Sodio, Na Calcio, Ca Alluminio, Al Silicio, Si Fosforo, P Zolfo, S Cloro, Cl Argo, Ar Ferro, Fe Argento, Ag

Tavola Periodica

Cose da fare • Imparare i nomi e i simboli degli elementi più comuni

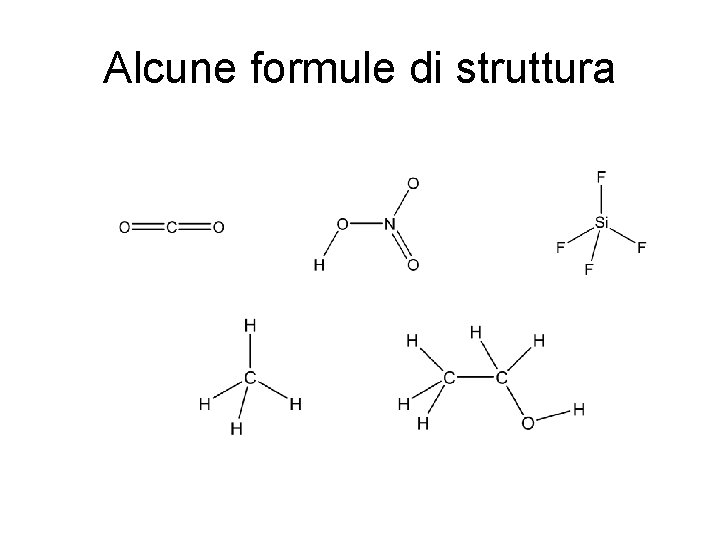
Formule chimiche • Danno la composizione atomica delle sostanze • Formula minima o stechiometrica o elementare: il semplice rapporto tra atomi. Na. Cl, P 2 O 5, Si. O 2, Ca 3 P 2 O 8 • Formula molecolare: specifica il numero di atomi che entra a far parte della “molecola”: H 2, O 2, N 2, H 2 O 2, C 6 H 6, Ca 3(PO 4)2 • Formula di struttura: fornisce la concatenazione molecolare

Alcune formule di struttura

La struttura dell’atomo Nucleo, caricato positivamente in cui è praticamente tutta la massa dell’atomo; neutroni n e protoni p+ Elettroni caricati negativamente e-

Isotopi Numero atomico= numero di protoni, Z Nell’atomo neutro Z elettroni Numero di neutroni, N Numero di massa A= N+ Z Le proprietà chimiche sono legate agli elettroni quindi a Z. Tutti gli atomi che hanno lo stesso Z corrispondono alla stessa specie chimica, o elemento. Atomo dello stesso elemento possono avere differente N: Isotopi

Simboli degli isotopi

Massa atomica relativa La massa atomica relativa di un nuclide indica il rapporto tra la massa del nuclide e la massa di 1/12 della massa del 12 C che è presa per convenzione uguale a 12 esatto Se si definisce una nuova unità di misura uguale a 1/12 della massa del nuclide 12 C, detta unità di massa atomica, uma, o Dalton, Da, lo stesso numero dà la massa relativa e la massa nella nuova unità di misura 1 uma= 1 Da= 1, 6605389(10). 10 -27 kg

Isotopi naturali di alcuni elementi Nuclide Massa rel. % nuclidi 1 H 1, 007825 99, 985 2 H 2, 014102 0, 015 3 H 3, 01605 tracce 6 Li 6, 015126 7, 42 7 Li 7, 01605 92, 58 12 C 12 98, 89 13 C 13, 003354 1, 11 14 C 14, 003142 tracce

Peso atomico relativo e medio degli elementi La percentuale dei vari isotopi di un elemento è costante su tutta la terra. Si può quindi definire un peso atomico medio come la media pesata degli isotopi di un certo elemento. Il fattore di peso è la percentuale dell’isotopo nella miscela naturale 1 H 1, 007825 (99, 985%) 2 H 2, 014102 (0, 015%) (1, 007825 x 99, 985/100)+ (2, 014102 x 0, 015/100)= 1, 007976 12 C 13, 003354 (1, 11%) 12 (98. 89%) (12 x 0, 9889)+ (13, 0034 x 0, 0111)= 12, 0111


Peso molecolare e peso formula La somma dei pesi atomici di tutti gli elementi della molecola o della formula di una sostanza è detta peso molecolare Peso molecolare di I 2: 2 x 126, 9= 253, 8 Peso molecolare di H 2 SO 4: 2 x 1, 00798+ 32, 064+ 4 x 15, 999= 98, 076 Peso formula di K 2 Cr 2 O 7: 2 x 39, 10+ 2 x 51, 996+7 x 15, 999= 294, 2

La mole è la quantità di materia che contiene tante unità elementari (atomi, molecole, ioni, elettroni, ecc. ) quanti ne sono contenuti in 12 g del nuclide 12 C Numero o costante di Avogadro, NA NA= 6, 0221415(10). 1023 mol-1 La massa in g di una mole di sostanza è data dallo stesso numero che ne esprime il peso molecolare

Massa molare La massa molare è il rapporto tra massa e quantità di sostanza. E’ espressa dal simbolo M. Ha dimensioni: [M]= g mol-1

Qual’è la massa di una mole di: • • Idrogeno (sostanza elementare) Ossigeno (sostanza elementare) Cloruro di sodio Metano Biossido di carbonio Acido solforico Permanganato di potassio benzene

Quante moli ci sono in 100 g di: • • Azoto (sostanza elementare) Ossido di carbonio Ferro Biossido di silicio Alcool etilico Biossido di zolfo Fluoruro di potassio Tetrossido di osmio

Calcolare le percentuali in massa degli elementi in • • Cloruro di sodio Bromuro di magnesio Diossido di carbonio Carbonato ferrico Ossido di mercurio Acido solfidrico Cianuro di potassio Solfato di calcio biidrato
 Teoria atomica della materia
Teoria atomica della materia Charles darwin origine della specie
Charles darwin origine della specie Charles darwin origine della specie
Charles darwin origine della specie Materia natura
Materia natura Legge di proust
Legge di proust Pessimismo agonistico leopardi
Pessimismo agonistico leopardi La doppia natura della luce zanichelli
La doppia natura della luce zanichelli 5 regni dei viventi
5 regni dei viventi Atomo di bohr
Atomo di bohr Tabella potenziale mellifero
Tabella potenziale mellifero Cartina macchia mediterranea
Cartina macchia mediterranea Potenziometria
Potenziometria Deriva genica
Deriva genica Regole di riempimento degli orbitali
Regole di riempimento degli orbitali Speciile genului epic
Speciile genului epic Dominio regno phylum classe ordine famiglia genere specie
Dominio regno phylum classe ordine famiglia genere specie Specie pesci favignana
Specie pesci favignana Una branca della chimica
Una branca della chimica Specii epice
Specii epice Formula velocità media
Formula velocità media




































