La chimica di alcoli e tioli Gli alcoli
















- Slides: 32

La chimica di alcoli e tioli

Gli alcoli e gli eteri devono essere attivati perchè possano andare incontro a reazioni di sostituzione o di eliminazione Nel caso degli alcoli, occorre trasformare il gruppo OH- in un buon gruppo uscente

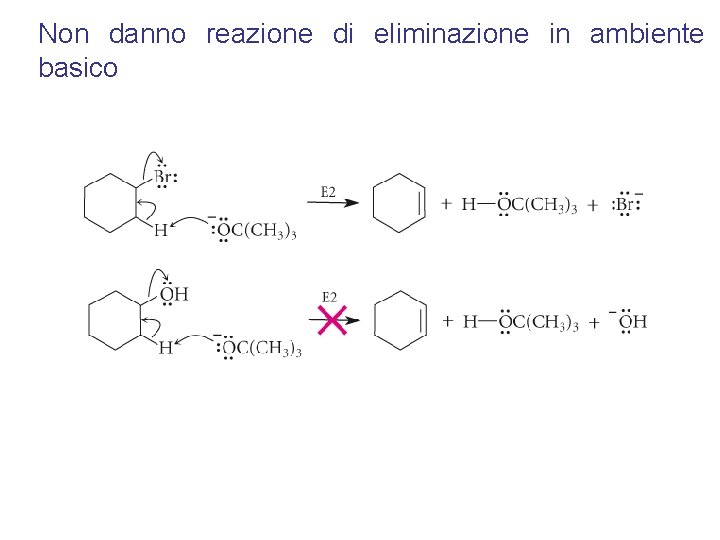
Non danno reazione di eliminazione in ambiente basico

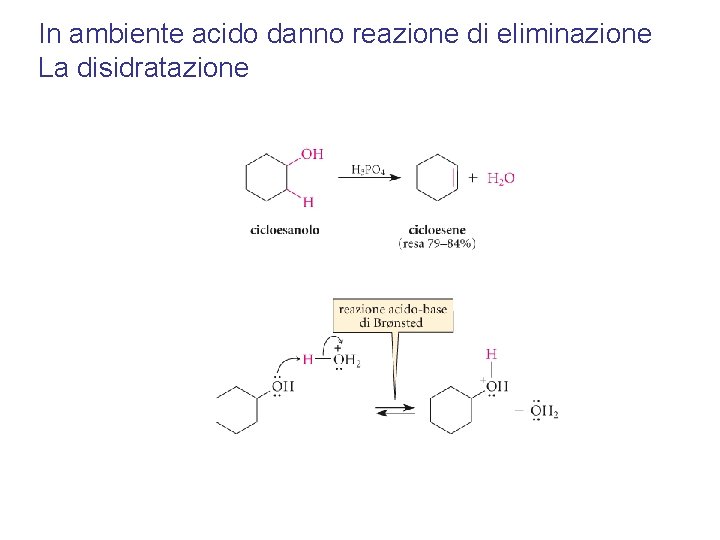
In ambiente acido danno reazione di eliminazione La disidratazione


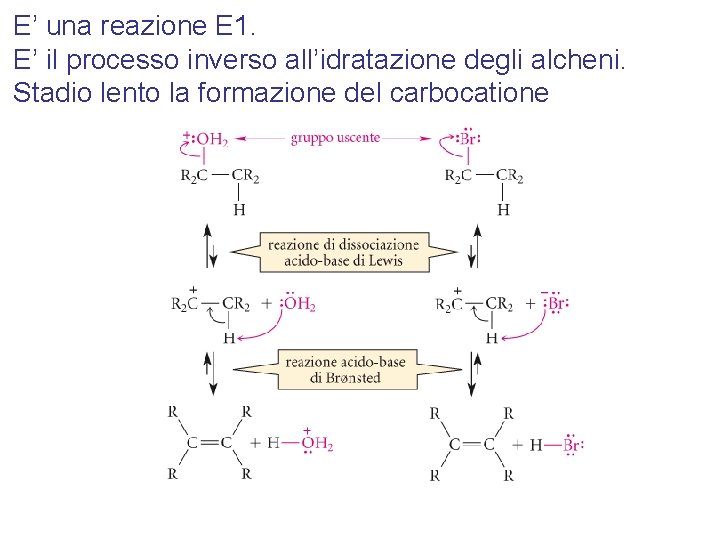
E’ una reazione E 1. E’ il processo inverso all’idratazione degli alcheni. Stadio lento la formazione del carbocatione

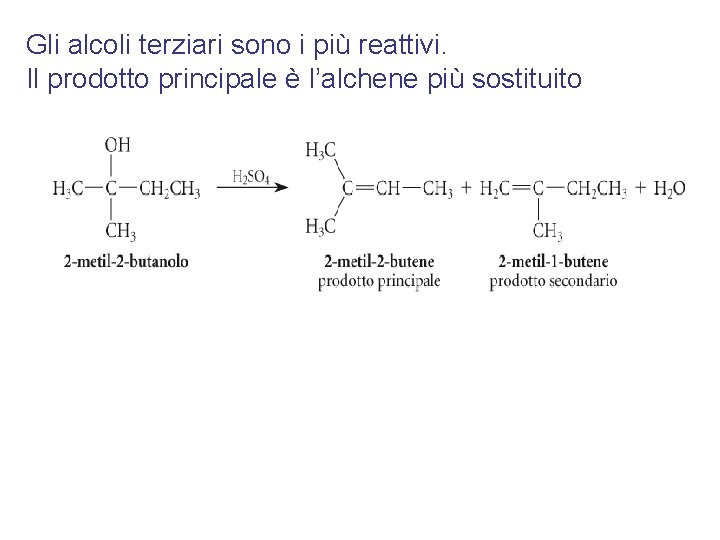
Gli alcoli terziari sono i più reattivi. Il prodotto principale è l’alchene più sostituito

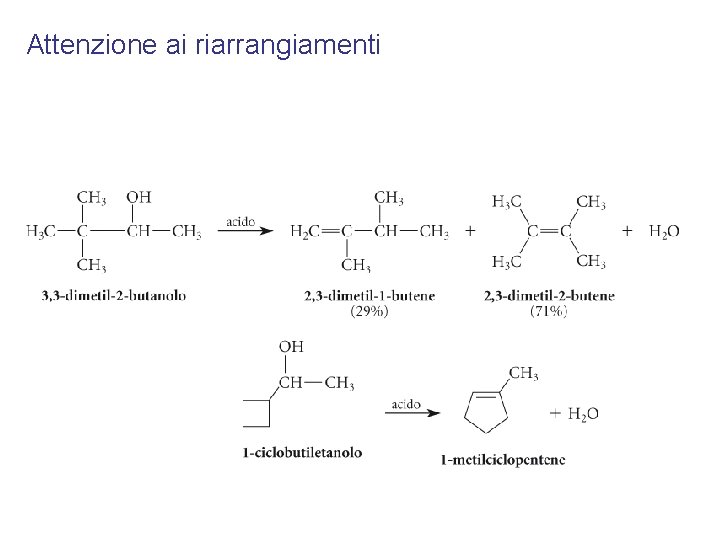
Attenzione ai riarrangiamenti

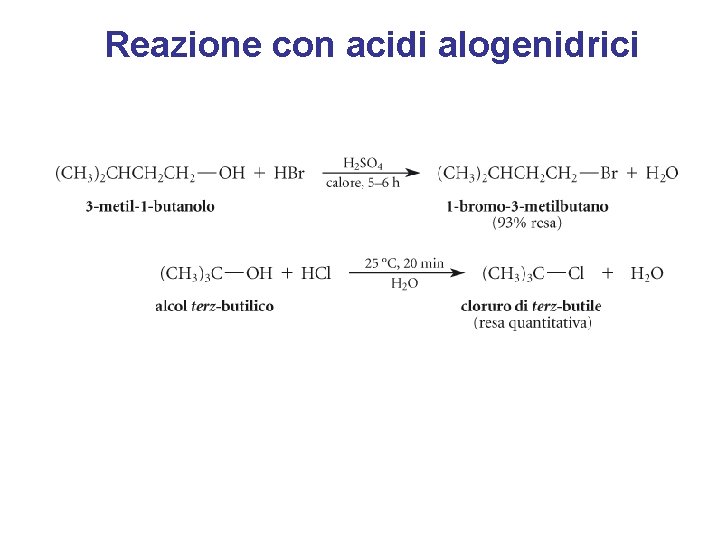
Reazione con acidi alogenidrici



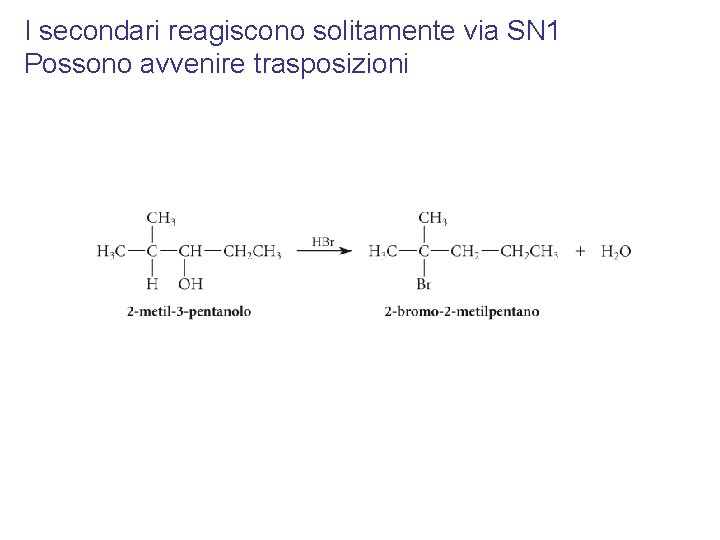
I secondari reagiscono solitamente via SN 1 Possono avvenire trasposizioni

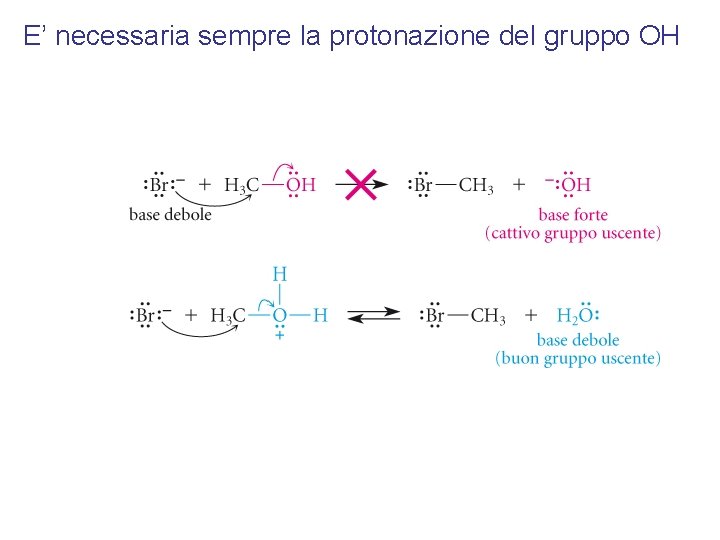
E’ necessaria sempre la protonazione del gruppo OH

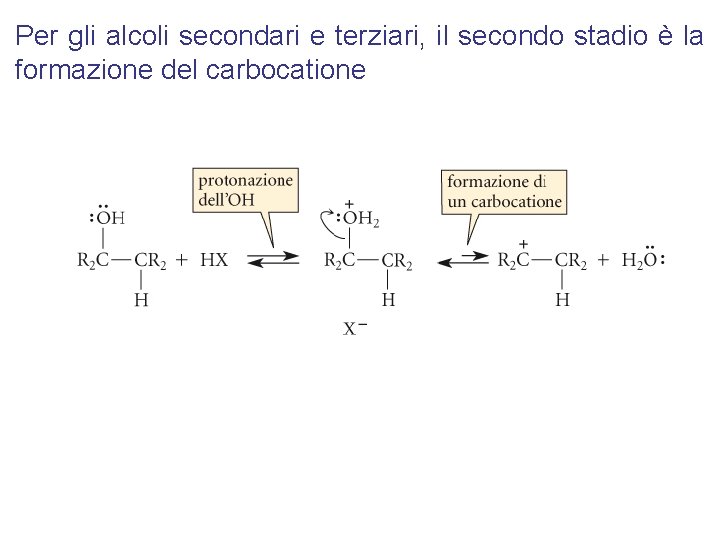
Per gli alcoli secondari e terziari, il secondo stadio è la formazione del carbocatione

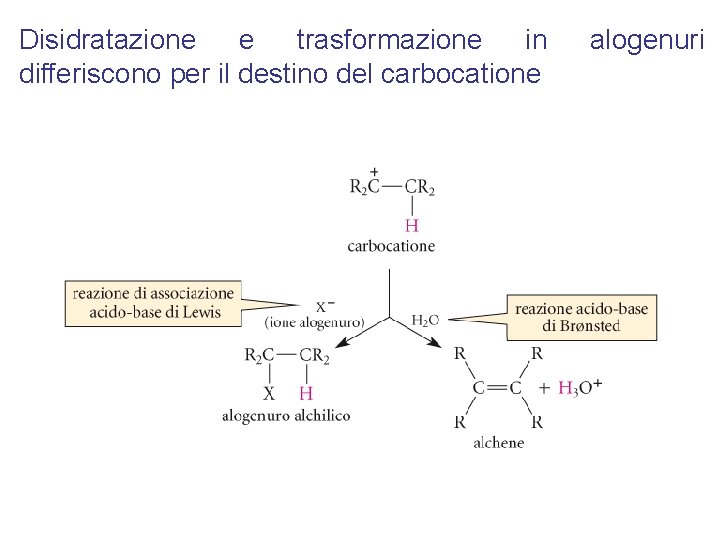
Disidratazione e trasformazione in differiscono per il destino del carbocatione alogenuri

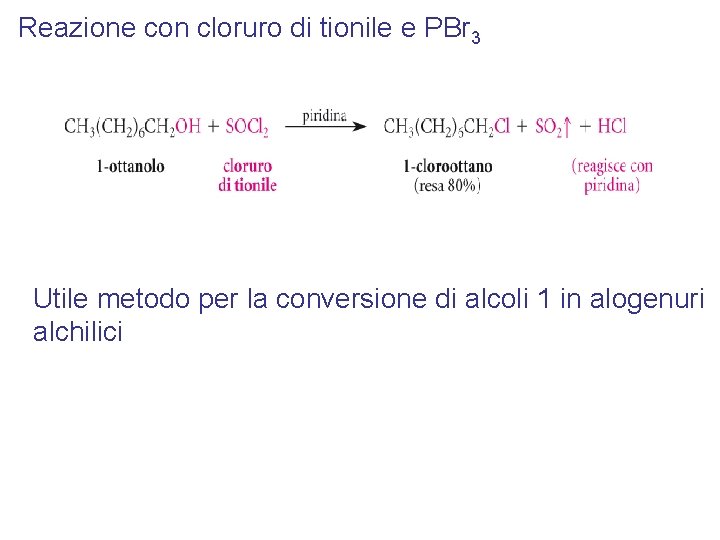
Reazione con cloruro di tionile e PBr 3 Utile metodo per la conversione di alcoli 1 in alogenuri alchilici



Substrato Cloruro Bromuro Ioduro Primario SOCl 2 + pyr PBr 3 P + I 2 oppure HI Secondario SOCl 2 + pyr PBr 3 + pyr P + I 2 Terziario HCl 0 °C HBr 0 °C HI 0 °C Con SOCl 2 e PBr 3: SN 2 quindi inversione di configurazione

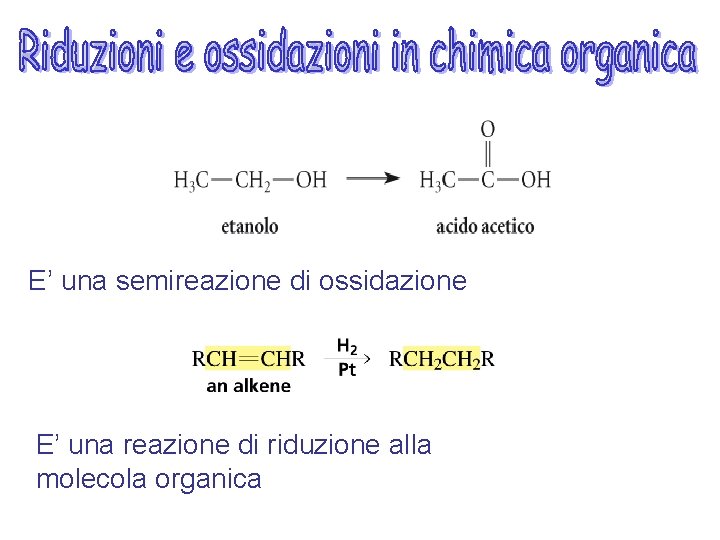
E’ una semireazione di ossidazione E’ una reazione di riduzione alla molecola organica

Per ossidazione e riduzione s’intende l’aumento rispettivamente, del numero di ossidazione di un atomo o la diminuzione, Un’ossidazione è sempre accoppiata a una riduzione Formalmente, l’ossidazione è una perdita di elettroni e la riduzione un acquisto di elettroni In Chimica organica, è più comodo riferirsi al numero di atomi di idrogeno e di ossigeno acquistati o peduti da un atomo; in particolare: Un’ossidazione comporta un aumento del numero di atomi di ossigeno (o N o X) e/o una diminuzione del numero di atomi di H Una riduzione comporta una diminuzione del numero di atomi di ossigeno (o N o X) e/o un aumento del numero di atomi di H


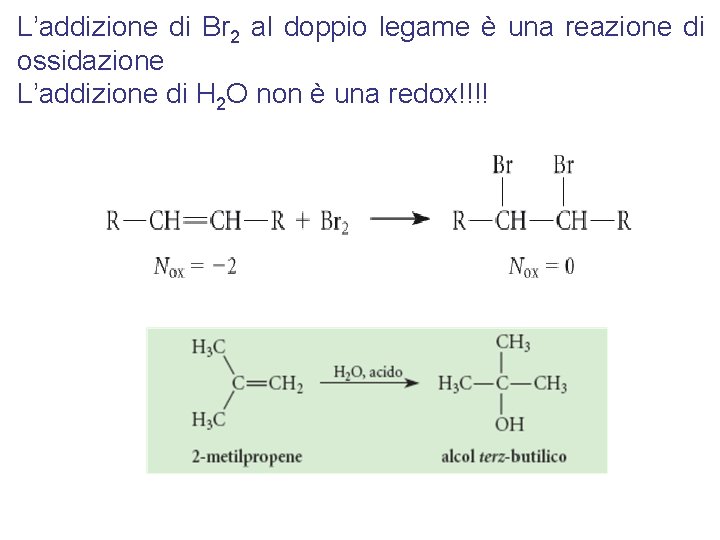
L’addizione di Br 2 al doppio legame è una reazione di ossidazione L’addizione di H 2 O non è una redox!!!!


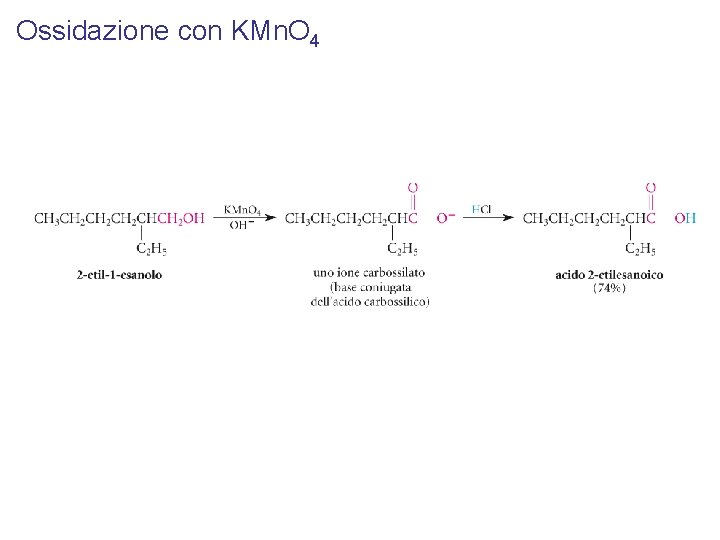
Si usa per ossidare gli alcoli 1° ad acidi carbossilici



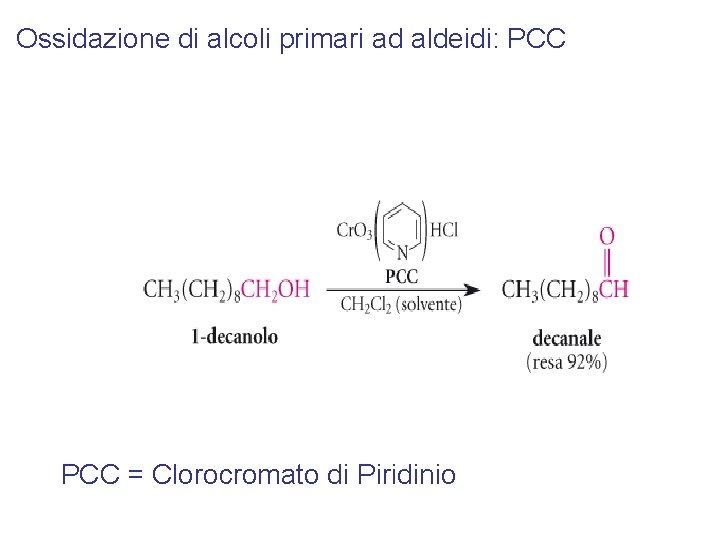
Ossidazione di alcoli primari ad aldeidi: PCC = Clorocromato di Piridinio

Ossidazione con KMn. O 4


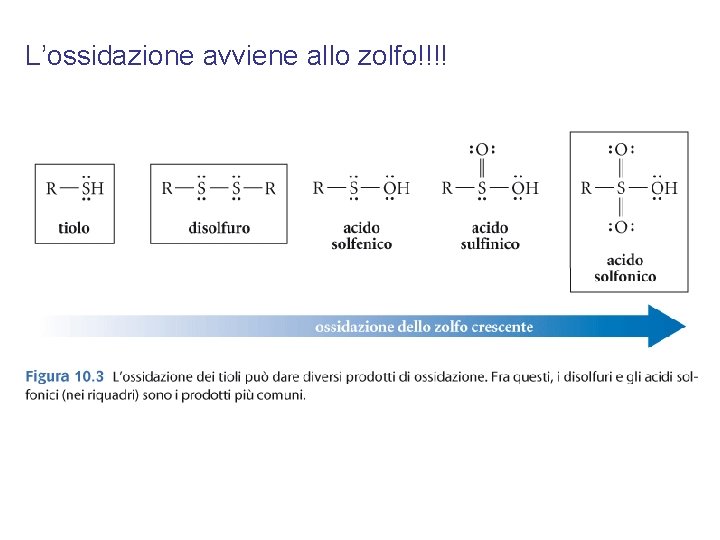
L’ossidazione avviene allo zolfo!!!!

 Ch2oh nome
Ch2oh nome Alcoli e fenoli
Alcoli e fenoli Amici aggettivo qualificativo
Amici aggettivo qualificativo Gruppi funzionali chimica organica
Gruppi funzionali chimica organica Cesare sconfigge e insegue gli elvezi
Cesare sconfigge e insegue gli elvezi Differenza tra ipse e idem
Differenza tra ipse e idem Destaste la mente che dormia significato
Destaste la mente che dormia significato Come calcolare gli oneri per la sicurezza?
Come calcolare gli oneri per la sicurezza? Gli alimenti regolatori forniscono alla cellula
Gli alimenti regolatori forniscono alla cellula Gli artropodi sono invertebrati
Gli artropodi sono invertebrati Cartogramma a mosaico
Cartogramma a mosaico Cos'è un enjambement
Cos'è un enjambement Gli scritti bibbia
Gli scritti bibbia Seguir con gli occhi un airone
Seguir con gli occhi un airone Piattaforme mobili autosollevanti petrolio
Piattaforme mobili autosollevanti petrolio Trabalenguas con gla gle-gli-glo-glu
Trabalenguas con gla gle-gli-glo-glu Non fidarti di chi non chiude gli occhi quando ti bacia
Non fidarti di chi non chiude gli occhi quando ti bacia Tipi di arrangiamento
Tipi di arrangiamento Quali caratteristiche hanno gli esseri viventi
Quali caratteristiche hanno gli esseri viventi Capacità di agire e capacità giuridica
Capacità di agire e capacità giuridica In una scuola gli studenti sono stati divisi in tre gruppi
In una scuola gli studenti sono stati divisi in tre gruppi Avverbi definizione
Avverbi definizione Ha i lati e gli angoli tutti uguali
Ha i lati e gli angoli tutti uguali Conoscere se stessi attraverso gli altri
Conoscere se stessi attraverso gli altri Capacità di agire
Capacità di agire Grazie x gli auguri
Grazie x gli auguri Dettato di frasi terza elementare
Dettato di frasi terza elementare Studia gli esseri viventi
Studia gli esseri viventi Le piante sono pluricellulari
Le piante sono pluricellulari Il popolo è l'elemento
Il popolo è l'elemento Gli italiani e il bar
Gli italiani e il bar Fiabe con funzioni di propp
Fiabe con funzioni di propp Stile analitico di apprendimento
Stile analitico di apprendimento