Indicatori nelle titolazioni di neutralizzazione Analiti acidi o



![La costante di equilibrio dell’indicatore Ka = [H 3 O+] [Ind-] [HInd] [HIn] ≥ La costante di equilibrio dell’indicatore Ka = [H 3 O+] [Ind-] [HInd] [HIn] ≥](https://slidetodoc.com/presentation_image_h2/79a2d726416f830af53c3cc9bb034c0c/image-6.jpg)




- Slides: 11

Indicatori nelle titolazioni di neutralizzazione

Analiti acidi o basici oppure che possono essere trasformati in tali specie mediante un trattamento chimico, possono essere determinati con soluzioni standard di acidi forti e di basi forti.

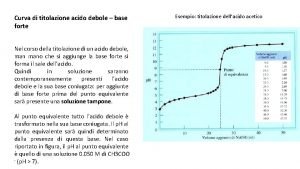
Le reazioni di neutralizzazione H 3 O+ + OH- → 2 H 2 O Titolazione acido forte - base forte HA + OH- → H 2 O + A- Titolazione acido debole base forte H 3 O+ + B → H 2 O + BH+ Titolazione acido forte base debole Le soluzioni standard impiegate sono acidi o basi forti in quanto queste sostanze reagiscono con un analita più completamene di quanto non facciano le loro controparti più deboli e perciò producono punti finali più netti.

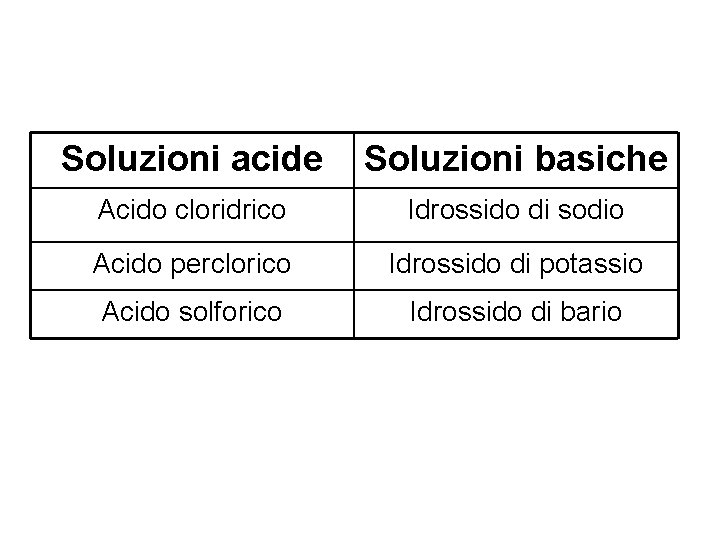
Soluzioni acide Soluzioni basiche Acido cloridrico Idrossido di sodio Acido perclorico Idrossido di potassio Acido solforico Idrossido di bario

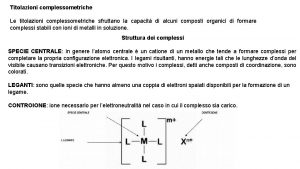
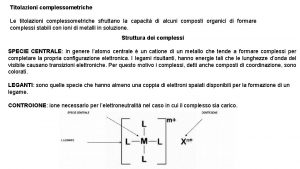
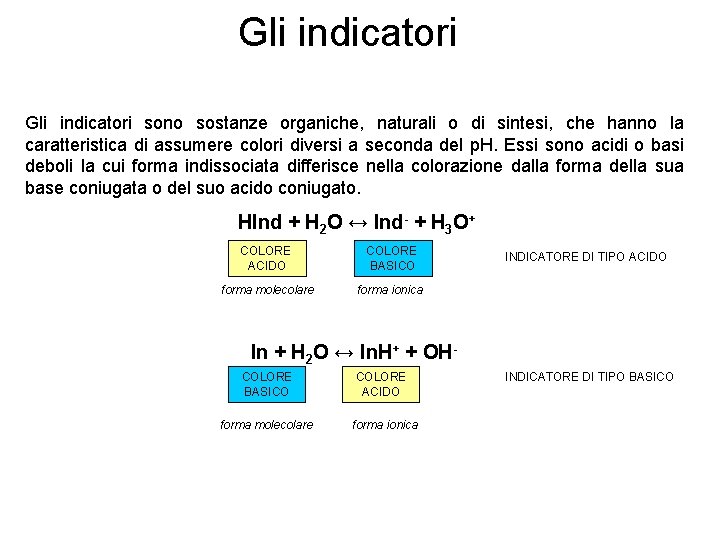
Gli indicatori sono sostanze organiche, naturali o di sintesi, che hanno la caratteristica di assumere colori diversi a seconda del p. H. Essi sono acidi o basi deboli la cui forma indissociata differisce nella colorazione dalla forma della sua base coniugata o del suo acido coniugato. HInd + H 2 O ↔ Ind- + H 3 O+ COLORE ACIDO COLORE BASICO forma molecolare forma ionica INDICATORE DI TIPO ACIDO In + H 2 O ↔ In. H+ + OHCOLORE BASICO forma molecolare COLORE ACIDO forma ionica INDICATORE DI TIPO BASICO
![La costante di equilibrio dellindicatore Ka H 3 O Ind HInd HIn La costante di equilibrio dell’indicatore Ka = [H 3 O+] [Ind-] [HInd] [HIn] ≥](https://slidetodoc.com/presentation_image_h2/79a2d726416f830af53c3cc9bb034c0c/image-6.jpg)
La costante di equilibrio dell’indicatore Ka = [H 3 O+] [Ind-] [HInd] [HIn] ≥ 10 H 3 O + = K a [HIn] p. H = p. Ka – log [HInd] / [Ind-] [In-] L’indicatore HIn esibisce il suo perfetto colore acido [In-] [HIn] ≤ 0, 1 L’indicatore HIn esibisce il suo perfetto colore basico [In-] Il discorso può essere applicato anche agli indicatori di tipo basico

Dalla relazione precedente è possibile fare le seguenti osservazioni: • p. H << p. Ka → [HInd] >> [Ind-] l’indicatore assume il colore della forma basica • p. H >> p. Ka → [HInd] << [Ind-] l’indicatore assume il colore della forma acida • p. H ~ p. Ka → [HInd] ~[Ind-] l’indicatore assume un colore intermedio Il p. H dove [HInd] = [Ind-] è detto punto di viraggio. Il p. H del punto di viraggio deve coincidere il più possibile con il p. H al punto di equivalenza della titolazione. Solo in questo modo si osserverà una variazione del colore al momento giusto.

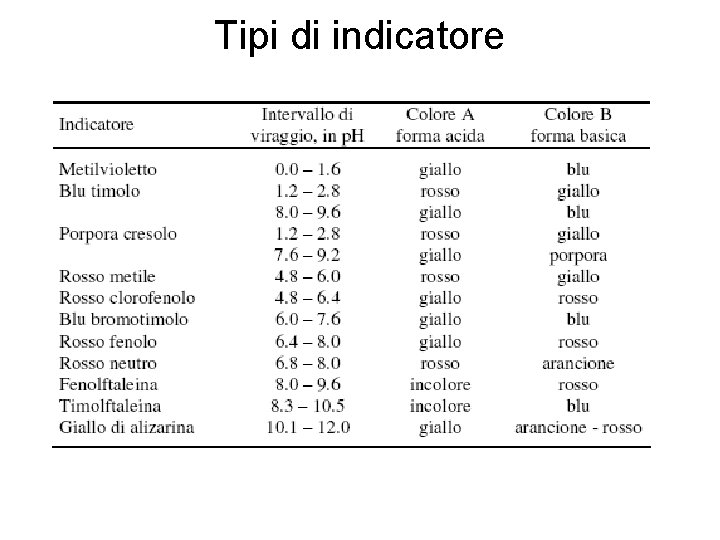
Tipi di indicatore

Variabili che influenzano il comportamento degli indicatori • p. H; • temperatura; • forza ionica; • solventi organici; • particelle colloidali.

Il caso della fenolftaleina La fenolftaleina è uno degli indicatori più utilizzato nelle titolazioni di neutralizzazione Fonte: http: //edivini. pbworks. com/f/sintesi_fenolftaleina. gif p. H < 8, 2 INCOLORE 8, 2<p. H<9, 8 ROSSO Fonte: http: //share. dschola. it/default. aspx p. H > 9, 8 ROSSO VIOLACEO

Bibliografia e sitografia • Douglas A. Skoog, Donald M. West F. James Holler; Chimica analitica una introduzione; edizioni Edi. Ses • http: //www. dsch. univ. trieste. it/~balducci/biotecnologie/slides. OLD/node 1. html
 Curve di titolazione acido debole base forte
Curve di titolazione acido debole base forte Titolazioni argentometriche
Titolazioni argentometriche Indicatori statistici geografia
Indicatori statistici geografia Concetti indicatori e variabili esempi
Concetti indicatori e variabili esempi Struttura del testo drammatico
Struttura del testo drammatico Catione flavilio
Catione flavilio Prolessi
Prolessi Indicatori di anomalia provvedimento 616 del 2010
Indicatori di anomalia provvedimento 616 del 2010 Indicatori di posizione gravitazionali
Indicatori di posizione gravitazionali Verbi modali
Verbi modali Indicatori anomalia operazioni sospette
Indicatori anomalia operazioni sospette Struttura del testo teatrale
Struttura del testo teatrale