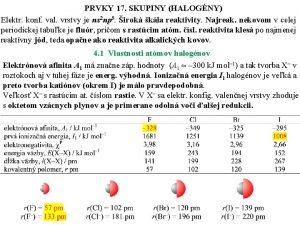
Halogny Prvky VII A podskupiny Flur F Chlr













- Slides: 14

Halogény Prvky VII. A podskupiny

Fluór F Chlór Cl Bróm Br Jód I Astát At Ømajú podobné vlastnosti Ømajú spoločný názov halogény hals = soľ genao = tvorím Øsú veľmi reaktívne Øv prírode sa vyskytujú len v zlúčeninách

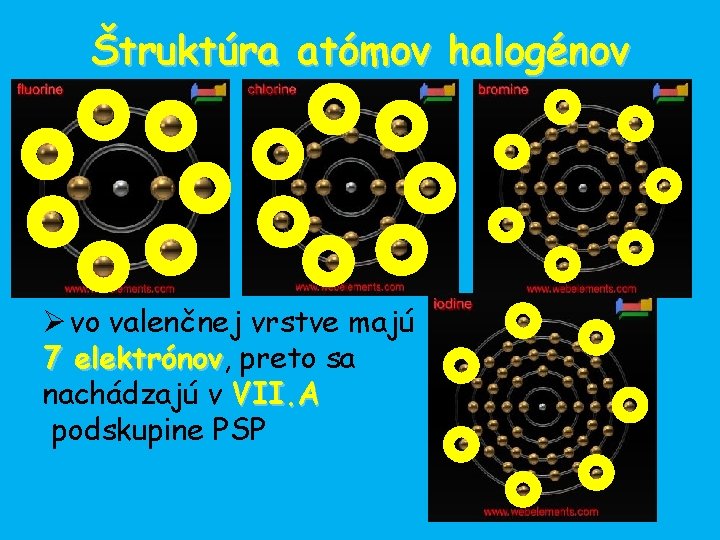
Štruktúra atómov halogénov Ø vo valenčnej vrstve majú 7 elektrónov, elektrónov preto sa nachádzajú v VII. A podskupine PSP

Postavenie v PSP VII A

Fluór F 2 ftoros = ničiaci Ø prenikavo zapáchajúci plyn bledožltej farby Ø je jedovatý Ø pri zasiahnutí pokožky spôsobuje ťažké popáleniny Ø sklo sa jeho pôsobením rozpúšťa, preto sa uskladňuje v nádobách z niklu a medi, drevo a guma pôsobením fluóru vzplanú, lebo je veľmi reaktívny, nachádza sa v zubnej sklovine

Chlór Cl 2 chloros = žltozelený „Bezo mňa by ste mali život veľmi ťažký. Len si spomeňte na známu rozprávku Soľ nad zlato. “ Ø žltozelený, zapáchajúci jedovatý plyn, ktorý leptá sliznicu a dráždi dýchacie cesty Ø používa sa na dezinfekciu pitnej vody, bielenie papiera a textilu, na výrobu farieb, rozpúšťadiel, liekov, plastov (PVC), na výrobu kyseliny chlorovodíkovej Ø je v kuchynskej soli Na. Cl

Chlór ako zbraň Prudko jedovaté vlastnosti chlóru boli zneužité v I. svetovej vojne. 22. apríla 1915 nemecká armáda cisára Vilhelma II. pri rieke Ypres v Belgicku použila na útok proti francúzskym vojakom na západnom fronte plynný chlór. Hoci ho vypustili iba na päť minút, jeho účinky boli otrasné. 15 000 francúzskych vojakov sa otrávilo, z toho 5 000 zomrelo.

Ypres 1915

Bróm Br 2 bromos = zápach Ø červenohnedá, ťažká kvapalina veľmi nepríjemného zápachu Ø leptá pokožku Ø vyparuje sa už pri izbovej teplote Ø pary silne leptajú sliznice a dráždia na kašeľ (základ slzotvorných plynov) Ø používa sa na výrobu liekov a farbív

Jód I 2 iodes = modrofialový Ø je to sivočierna tuhá látka, vo vode sa málo rozpúšťa Ø pri zohrievaní sublimuje (vyparuje sa) Ø roztok jódu v liehu je jódová tinktúra Ø nedostatok jódu v tele zapríčiňuje poruchy štítnej žľazy Ø obsahujú ho morské riasy

Reaktivita halogénov Ø všetky majú veľkú hodnotu elektronegativity, preto ľahko vytvárajú anióny F + 1 e. Cl + 1 e. Br + 1 e. I + 1 e- FCl. Br. I-

Halogény reagujú s alkalickými kovmi a s vodíkom Ø chlór reaguje so sodíkom za vzniku chloridu sodného Cl 2 + 2 Na. Cl Ø reakciou chlóru s vodíkom vzniká chlorovodík Cl 2 + H 2 2 HCl

Úloha 1 Ø zapíš chemickými rovnicami reakcie fluóru, brómu a jódu s ďalšími alkalickými kovmi Úloha 2 Ø zapíš reakcie fluóru, brómu a jódu s vodíkom

Ďakujem za pozornosť! Mariana Pavelčáková © 2009 Zdroje: E. Adamkovič: Chémia 8 A. Velikanič: Chemická čítanka M. Pauková: Chémia 9