Gli elementi chimici che colorano la fiamma saggi






















- Slides: 22

Gli elementi chimici che colorano la fiamma (saggi alla fiamma) Di Barni Alessandro

PRESENTAZIONE I”saggi alla fiamma” è una tecnica di riconoscimento di alcuni elementi chimici metallici, mediante l’ esame del colore assunto dalla fiamma del fornello bunsen quando sali che li contengono ricevono energia termica Fornendo energia ad un certo metallo, ossia scaldandolo, si provoca lo spostamento su orbite più energetiche di alcuni suoi elettroni, i quali, tornando poi al livello originale, emettono l’ eccesso di energia sotto forma di radiazioni luminose, che corrispondono, quindi, a transizioni da stati eccitati instabili a stati “normali” o “fondamentali” stabili dell’ atomo. Le colorazioni delle radiazioni luminose appaiono tanto più facilmente quanto più volatili sono i sali; poiché le sostanze più volatili sono i cloruri, si introduce il filo di nichel-cromo in una provetta contenente acido cloridrico ( HCl ) concentrato e poi, dopo aver fatto aderire una piccolissima quantità del sale posta su un vetrino da orologio, lo si scalda alla fiamma, ottenendo colorazioni diverse per i diversi metalli. In poche parole, alcuni cationi metallici , se riscaldati alla fiamma ossidante del bunsen, hanno la capacità di colorarla con una colorazione caratteristica del catione stesso.

L’acido cloridrico (HCl) assume in questo esperimento particolare importanza. Infatti, i composti che contengono gli elementi , che sono in grado di manifestare la loro colorazione, devono trovarsi nella fiamma allo stato gassoso: l’HCl ha la funzione di permettere l'adesione al filo dei cristalli del sale e di trasformare lo stesso, qualora già non lo fosse, in un cloruro, sale particolarmente volatile, cioè che evapora facilmente. Ad esempio, il carbonato di calcio, che non è volatile, e quindi non darebbe alcuna colorazione, è trasformato nel cloruro di calcio, che è volatile, nel seguente modo: Ca. CO 3 + 2 HCl Ca. Cl 2 + H 2 O + CO 2

Materiale, sostanze, strumenti e dispositivi utilizzati Ø Ø Ø Becco bunsen Filo di nichel-cromo lungo 5 -6 cm e fissato su una bacchetta di vetro Soluzione di acido cloridrico concentrato (1: 3) Sali di litio, potassio, sodio, calcio, stronzio, bario, rame Vetrini da orologio

Esecuzione dell’ esperienza Si prelevano con una spatola piccole quantità dei sali in analisi, disponendole su vetrini da orologio. Si prende un filo al Ni-Cr e si provvede alla sua pulizia inumidendolo con l'acido e portandolo nella fiamma ossidante ( zona di fusione ) di un bunsen. Tale operazione è completata quando la fiamma appare incolore. Si inumidisce nuovamente il filo al Ni-Cr con l'acido, si raccolgono sulla punta alcuni cristalli del primo sale in analisi e si osservano il colore ed i caratteri della fiamma. L'acido cloridrico ha la funzione di permettere l'adesione al filo dei cristalli del sale e di trasformare lo stesso, qualora già non lo fosse, in un cloruro, sale particolarmente volatile. Si ripete l'esperienza con tutti i sali disponibili, avendo cura di pulire accuratamente il filo al Ni-Cr ogni volta. Durante questa fase, talvolta, capita che si formino dei grumi sul filo, per toglierli si può utilizzare della carta di vetro. E' opportuno annotare in una tabella, per ogni catione, la colorazione ed i caratteri della fiamma. Completate le analisi singole dei composti si mescolano a due questi composti e si individuano quali elementi sono presenti nel miscuglio, grazie alla colorazione che impartiscono alla fiamma Si utilizzi un vetrino al cobalto per filtrare la luce gialla del sodio. I colori dei principali cationi sono:

Potassio ( K ): violetto, si manifesta subito ed è poco persistente. E’ ben individuabile con vetro azzurro al cobalto

Sodio (Na): giallo intenso, si manifesta subito, è persistente e avvolge tutta la fiamma. Guarda foto

Litio ( Li ): rosso cardinale, si manifesta subito ed è persistente.

Calcio ( Ca ): rosso mattone, dà sprazzi fugaci.

Bario ( Ba ): giallo-verde: molto persistente. Guarda foto

Stronzio ( Sr ): rosso intenso, dà un primo sprazzo che ritorna, se riportato nelle zona più calda. Guarda foto

Rame ( Cu ): verde brillante e azzurro elettrico, poco persistente. Guarda foto

Polvere di ferro l’effetto è ……. . pirotecnico Guarda la foto

Il giallo del sodio è molto intenso e facilmente maschera la presenza di altri cationi, quali, ad esempio, il potassio. Il colore giallo è, però, assorbito dai vetri al cobalto blu per cui, osservando la fiamma attraverso uno di questi, è possibile riconoscere il catione mascherato.

Conclusioni I cationi metallici adoperati, trasformati in cloruri per azione dell'acido cloridrico, conferiscono alla fiamma colorazioni caratteristiche ne consentono il riconoscimento; infatti i cloruri sono facilmente volatili.






Pulizia del filo con carta vetrata

Schema descrittivo della fiamma del bunsen
 Saggi alla fiamma conclusioni
Saggi alla fiamma conclusioni Quali sono i fattori che influenzano il clima
Quali sono i fattori che influenzano il clima Sean saggi
Sean saggi L'elefante e i sei saggi ciechi
L'elefante e i sei saggi ciechi La coautrice dei saggi scientifici e moglie di carl sagan
La coautrice dei saggi scientifici e moglie di carl sagan Struttura della fiaba schema
Struttura della fiaba schema Testo narrativo schema
Testo narrativo schema Gli elementi filler cream
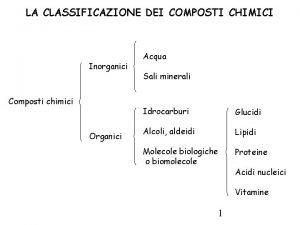
Gli elementi filler cream Quali sono gli elementi fondamentali dello stato
Quali sono gli elementi fondamentali dello stato Il popolo è l'elemento
Il popolo è l'elemento Elementi della comunicazione
Elementi della comunicazione Canto ulisse testo
Canto ulisse testo Chopper spettrofotometro
Chopper spettrofotometro Spettrofotometro ad assorbimento atomico
Spettrofotometro ad assorbimento atomico Quando fra l'altre donne ad ora ad ora
Quando fra l'altre donne ad ora ad ora Vetreria tarata definizione
Vetreria tarata definizione Sinalefe esempi
Sinalefe esempi Focaccia suono dolce o duro
Focaccia suono dolce o duro Artropodi cosa sono
Artropodi cosa sono Voi che per li occhi mi passaste il core parafrasi
Voi che per li occhi mi passaste il core parafrasi Amico aggettivo qualificativo
Amico aggettivo qualificativo Gli angeli che ci proteggono
Gli angeli che ci proteggono I vettori devono accertarsi che gli stranieri
I vettori devono accertarsi che gli stranieri