Sostanze elementari o elementi Nel medioevo gli elementi








- Slides: 14

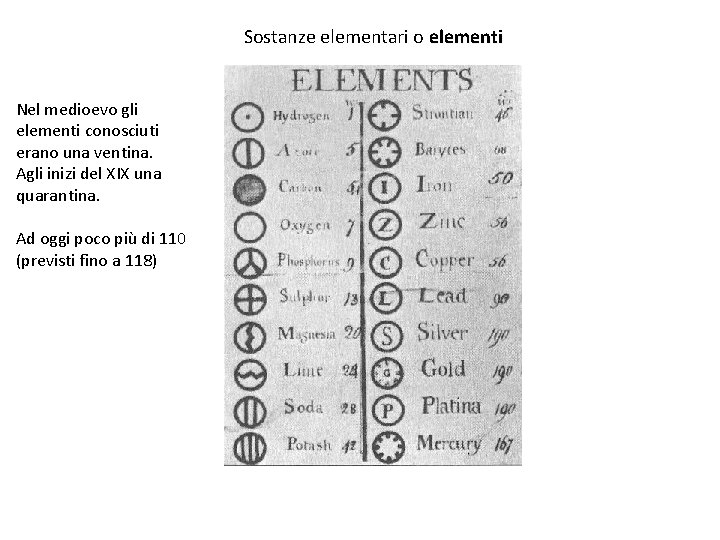
Sostanze elementari o elementi Nel medioevo gli elementi conosciuti erano una ventina. Agli inizi del XIX una quarantina. Ad oggi poco più di 110 (previsti fino a 118)

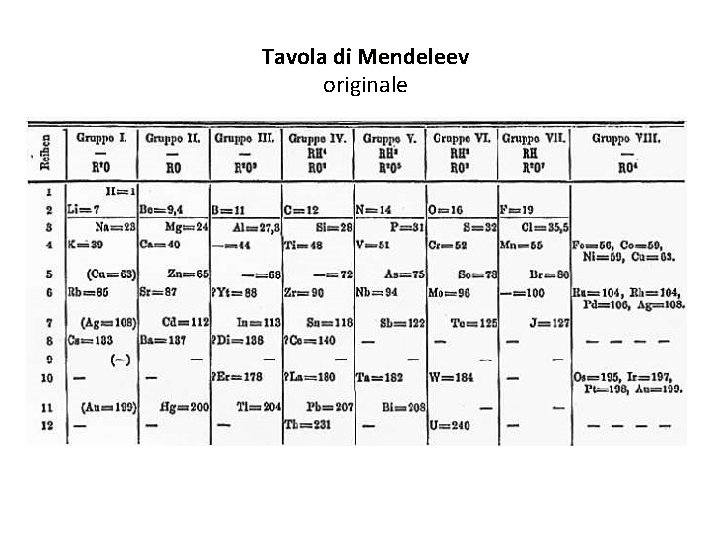
La tavola periodica Nel XIX secolo (grazie a Dalton e all’introduzione dell’u. m. a. ) gli elementi allora conosciuti furono ordinati in base alla massa, dall’H (il più leggero) al Pb Pb (ritenuto l’elemento più pesante) e ad ognuno fu assegnato un numero d’ordine Analizzando, inoltre, le caratteristiche chimico-fisiche dei materiali elementari (stato di aggregazione, compattezza, lucentezza, friabilità, t° di fusione ed ebollizione, conducibilità termica ed elettrica, malleabilità, reattività in presenza di ossigeno oppure di acidi o di basi ecc. ) vari chimici tentarono di farne anche una qualche classificazione, raggruppando elementi con caratteristiche simili. Il russo Mendeleev si accorse che, seguendo il numero d’ordine, Mendeleev numero d’ordine le caratteristiche chimico-fisiche si ripetevano con una certa regolarità (periodicità) salvo pochissime eccezioni. periodicità Inventò, perciò, una tabella fatta di righe e righe colonne in modo da sistemare gli colonne elementi da sinistra a destra e dall’alto in basso in base alla massa, ma anche da incolonnarli secondo caratteristiche chimico-fisiche comuni Tavola periodica o di periodica Mendeleev). Mendeleev Col tempo e con la scoperta di nuovi elementi, la tavola è stata perfezionata, ma l’idea originale del Russo si è mantenuta.

Tavola di Mendeleev originale

Tavola periodica attuale N. B. I colori, le informazioni in ogni casella variano in base all’autore, ma l’organizzazione è unica.

Nel XX secolo si scoprì che il numero d’ordine coincide perfettamente con il numero d’ordine numero dei protoni identificativo di ogni elemento, fu indicato come Numero protoni Numero atomico e si assegnò il simbolo Z atomico Numero atomico Z = numero di protoni Ø Allo stato fondamentale (neutro) , Il numero degli elettroni è elettroni pari a quello pari dei protoni, protoni Ø Se l’elemento si «combina» con altri per formare composti, il numero di combina elettroni può variare (in più o in meno) diventando ione, ma non cambia il elettroni ione non cambia numero atomico, quindi la natura dell’elemento stesso. numero atomico Altra importantissima scoperta del XX secolo elementi della stessa colonna hanno uguale esterno). uguale configurazione elettronica nell’ultimo livello (quello più configurazione elettronica esterno Questo stava a significare che le caratteristiche chimico-fisiche degli elementi dipendono prevalentemente dal livello esterno.


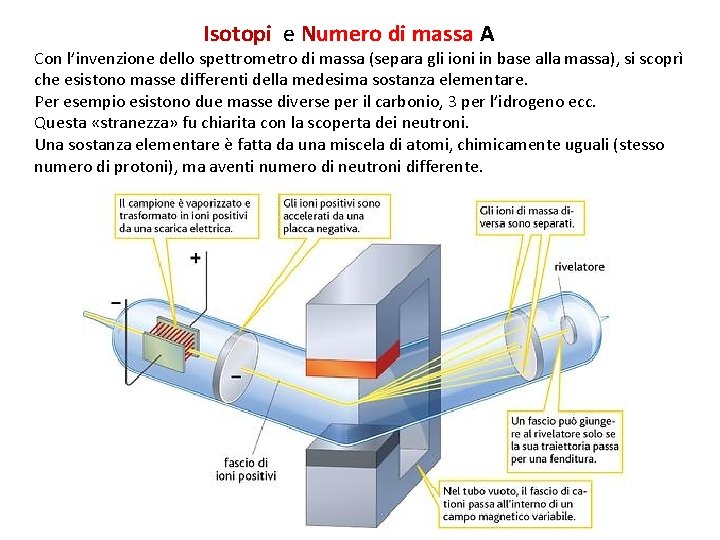
Isotopi e Isotopi Numero di massa A Con l’invenzione dello spettrometro di massa (separa gli ioni in base alla massa), si scoprì che esistono masse differenti della medesima sostanza elementare. Per esempio esistono due masse diverse per il carbonio, 3 per l’idrogeno ecc. Questa «stranezza» fu chiarita con la scoperta dei neutroni. Una sostanza elementare è fatta da una miscela di atomi, chimicamente uguali (stesso numero di protoni), ma aventi numero di neutroni differente.

Si introdussero, quindi, i concetti di: Ø Numero di massa A N° di protoni + N° di neutroni Ø Isotopi atomi aventi stesso numero atomico Z (numero di P) ma Isotopi numero di massa (P+N) differente. Per esempio 14 (A=6+8) C 12 (A=6+6) e C 14 H 1 (idrogeno A= 1+0), H 2 (Deuterio A=1+1) e H 3 (Trizio A=1+2). Gli isotopi più «pesanti» sono, in genere, instabili e tendono a stabilizzarsi trasformando un protone in neutrone, o viceversa, oppure espellendo particelle α 2+ (2 neutroni + 2 protoni) liberando radioattività In tal caso, modificando il numero atomico Z , si trasformano in un altro elemento. (per esempio il carbonio C 14 trasforma un neutrone in un protone diventando azoto N 14)

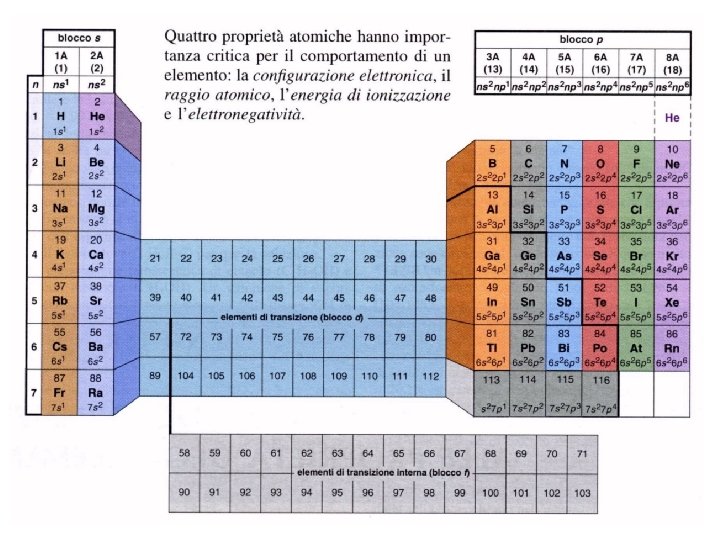
I gruppi e i I gruppi periodi La tavola periodica è, in pratica, una tabella composta da colonne e colonne righe Ø Le colonne vengono nominate Gruppi. Ogni gruppo è costituito da elementi aventi proprietà colonne Gruppi chimico-fisiche molto simili. § Ogni gruppo, in molte tavole, è indicato con un numero romano accompagnato dalla lettera A (i primi due e gli ultimi 6) oppure B (i gruppi centrali più «bassi» ) A § Il numero di ogni gruppo di tipo A indica anche quanti elettroni presentano nell’ultimo livello energetico gli atomi che vi appartengono. § Gli elementi dei gruppi di tipo B (parte centrale della tavola + le ultime due righe, normalmente rappresentate a parte) sono definiti «Metalli di transizione» Metalli di transizione Ø Le righe vengono definiti Periodi. Ogni riga (periodo) contiene elementi aventi proprietà righe Periodi differenti e le differenze tra due elementi della stesa riga sono tanto più significative quanto più sono tra loro distanti. • Passando da una riga all’altra le proprietà mantengono lo stesso andamento (periodicità). • Il numero del periodo coincide con il numero del livello energetico più esterno in cui si numero del periodo livello energetico sistemanodi elettroni allo stato fondamentale (o di riposo): le righe, infatti, sono in totale 7, come i livelli ipotizzati nella teoria quantistica (da Bohr in poi)

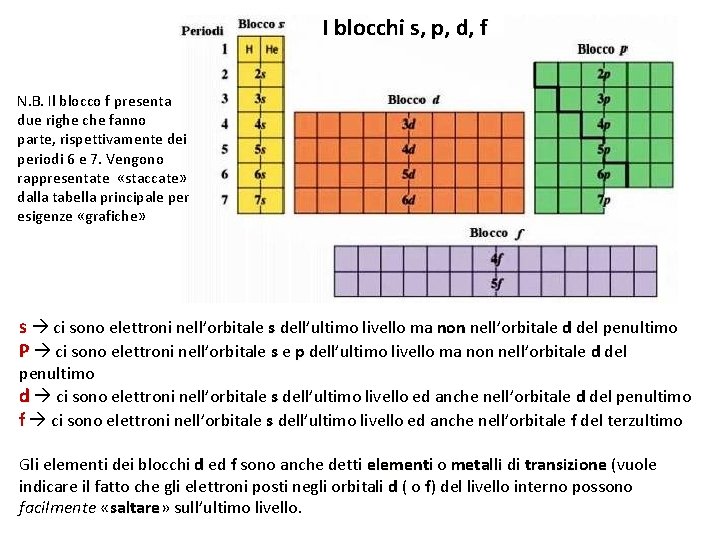
I blocchi s, p, d, f N. B. Il blocco f presenta due righe che fanno parte, rispettivamente dei periodi 6 e 7. Vengono rappresentate «staccate» dalla tabella principale per esigenze «grafiche» s ci sono elettroni nell’orbitale s dell’ultimo livello ma non nell’orbitale d del penultimo non d P ci sono elettroni nell’orbitale s e p dell’ultimo livello ma non nell’orbitale d del d penultimo d ci sono elettroni nell’orbitale s dell’ultimo livello ed anche nell’orbitale d del penultimo f ci sono elettroni nell’orbitale s dell’ultimo livello ed anche nell’orbitale f del terzultimo f Gli elementi dei blocchi d ed f sono anche detti elementi o f element metalli di metalli transizione (vuole transizione indicare il fatto che gli elettroni posti negli orbitali d ( o f) del livello interno possono facilmente «saltare» sull’ultimo livello. saltare

Il comportamento (caratteristiche chimico-fisiche) di un determinato elemento può essere studiato attraverso: Energia di prima ionizzazione energia, espressa in Kcal/mol (o KJ/mol), necessaria ad una Energia di prima ionizzazione mole di atomi allo stato gassoso per trasformarla in una mole di cationi (ioni +) monovalenti. Rispetto ad un atomo indica l’energia necessaria per strappargli 1 elettrone. Atomo + E. I. → Atomo+ + e. Affinità elettronica energia, espressa in Kcal/mol (o KJ/mol), liberata (o acquistata) da Affinità elettronica una mole di atomi neutri allo stato gassoso quando si trasforma in una mole di anioni (ioni -) monovalenti. Rispetto ad un atomo indica l’energia liberata (o assorbita) per fargli acquistare 1 elettrone. Atomo + e- → Atomo- + A. E. Elettronegatività potere di un atomo di attrarre elettroni di legame con un altro atomo. Elettronegatività Dipende da entrambe le precedenti energie. Raggio atomico raggio di un atomo, espresso in nm equivalente alla metà della distanza Raggio atomico minima tra il nucleo dell'atomo considerato e il nucleo di un atomo uguale. Maggiore è il raggio, minore sarà l’energia di ionizzazione, minore l’affinità elettronica, minore l’elettronegatività

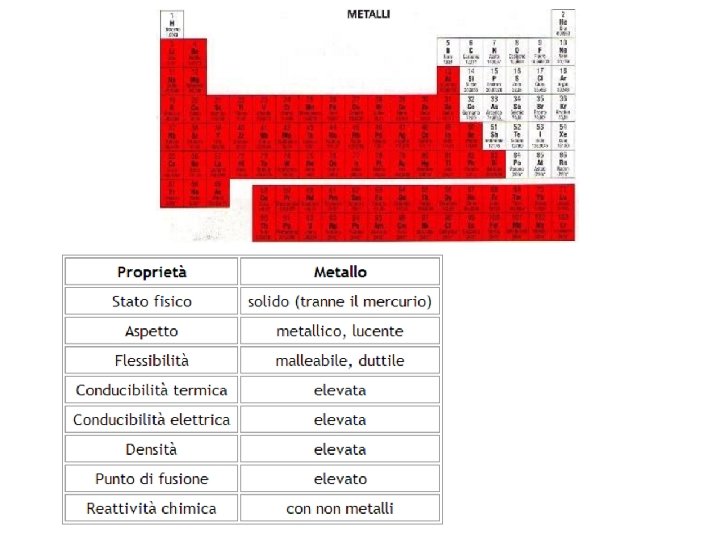
Suddivisione sommaria per caratteri chimico-fisici Esaminando le caratteristiche chimico-fisiche, gli elementi della tavola periodica si possono classificare in: Metalli sono la maggior parte e sono tutti Metalli quelli a sinistra della «scaletta» , fatta eccezione per i semimetalli Semimetalli sono essenzialmente 7 Semimetalli posizionati a «ridosso» della «scaletta» : boro (B); silicio (Si); germanio (Ge); arsenico (As); antimonio (Sb); tellurio (Te); polonio (Po). Non metalli sono a destra della Non metalli «scaletta» Gas nobili sono quelli dell’ultimo gruppo Gas nobili a destra sono a destra della «scaletta»


I semimetalli hanno carattere semimetalli anfotero, nel senso che in alcuni casi si comportano da metalli e in altri casi si comportano da non metalli, dipende dall’elemento con cui reagiscono o di combinano. Energia di ionizzazione, Affinità elettronica ed elettronegatività aumentano dai metalli ai non metalli (da sinistra a destra). Diminuiscono dall’alto verso il basso della tavola.
 Sostanze elementari
Sostanze elementari Chi erano le streghe
Chi erano le streghe Scolastica nel medioevo
Scolastica nel medioevo Medioevo musica mappa concettuale
Medioevo musica mappa concettuale La mentalità medievale
La mentalità medievale Misoginia nel medioevo
Misoginia nel medioevo Aggettivi qualificativi amico
Aggettivi qualificativi amico Le seguenti sostanze danno soluzioni basiche
Le seguenti sostanze danno soluzioni basiche Le sostanze che colorano la fiamma
Le sostanze che colorano la fiamma Sostanze eterogenee
Sostanze eterogenee Definizione sostanza pura
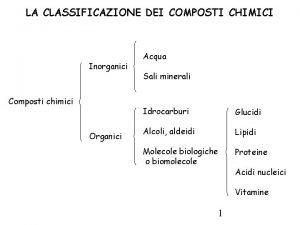
Definizione sostanza pura Classificazione composti inorganici
Classificazione composti inorganici Sostanze insolubili
Sostanze insolubili Esperimento miscugli e soluzioni
Esperimento miscugli e soluzioni Sostanze comburenti
Sostanze comburenti