EXTRA NATUURKUNDE 6 V QUANTUMWERELD 1 2 ELEKTRA















- Slides: 18

EXTRA NATUURKUNDE 6 V QUANTUMWERELD 1 2 ELEKTRA 6 MUZIEK MECHANICA 7 SATELLIETEN 3 STRALING 8* 4 VECTOREN 9* ASTROFYSICA 5 ENERGIE 10* QUANTUM MODELLEN Voorjaar 2020 Bram Tenhaeff

I ZICHT 1 Eerst de energie van 1 foton dan de totale invallende energie Het invallende vermogen is en de laagst zichtbare intensiteit

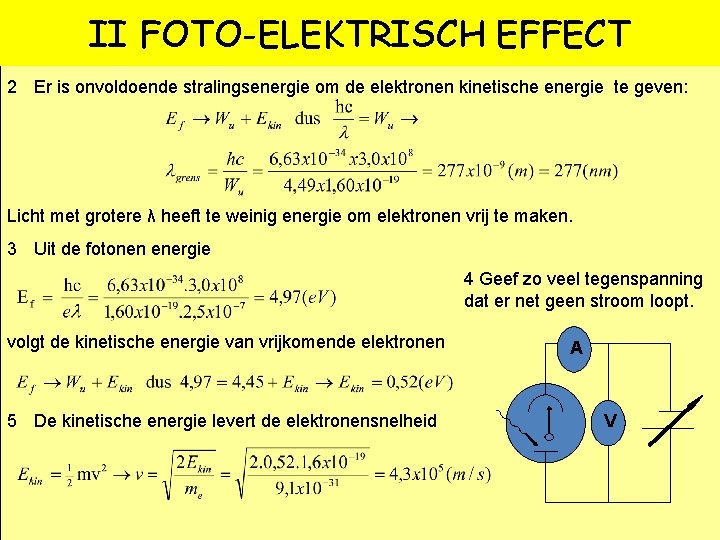
II FOTO-ELEKTRISCH EFFECT 2 Er is onvoldoende stralingsenergie om de elektronen kinetische energie te geven: Licht met grotere λ heeft te weinig energie om elektronen vrij te maken. 3 Uit de fotonen energie 4 Geef zo veel tegenspanning dat er net geen stroom loopt. volgt de kinetische energie van vrijkomende elektronen 5 De kinetische energie levert de elektronensnelheid A V

III DE LASER 6 Eerst de uitgezonden stralingsenergie dan de energie per foton uit Planks wet en tot slot het aantal fotonen per seconde 7 Rode LASER golflengte groter energie fotonen kleiner meer fotonen nodig 8 Groene LASER groen filter fotonen met precies 1 golflengte piek rondom die ene golflengte

IV AANSLAAN VAN EEN ATOOM 9 Golflengte uit relatie van Planck en de definitie van e. V: 10 Vanuit niveau 4 kan er op 4 + 3 + 2 + 1 = 10 manieren naar 0 worden teruggevallen. 11 De energieën tussen 400 en 800 nm in e. V: 12 Alleen de overgangen 4 2 (2, 13 e. V) en 2 1 (2, 84 e. V) zijn zichtbaar.

V REKENEN AAN H-ATOMEN 13 Eerst de tralieconstante dan de hoeken uit de golflengte De hoek tussen beide lijnen is dus 12 o. 14 Eerst de afstanden x voor rood en blauw uit x=L. tan α en dan de breedte van het spectrum. 15 Foton-energieën uit de relatie van Planck:

V REKENEN AAN H-ATOMEN 16 Eerst het verschil in energie tussen de twee niveaus dan de golflengte uit de relatie van Planck 17 Dat kan niet: de energie moet precies gelijk zijn anders wordt E-behoud geschonden (waar moet die extra energie heen? ). 18 Je moet de ionisatie-energie in de relatie van Planck invullen: 19 Die 20 e. V wordt de kinetische energie van een elektron, dus:

VI MATERIEGOLVEN 20 Bij tralies is het weglengteverschil d. sinα omdat de invallende bundel loodrecht komt aanzetten, dat is hier gezien de symmetrie van de situatie 2 d. sinα. 21 Hoek α = 90 -52/2=64 o, dus: 22 Eerst de snelheid uit de kinetische energie van de elektronen (versneld over 56 V hebben deze 56 e. V aan energie): dan de golflengte uit de relatie van de Broglie,

VII ERYTHEEM EN GROOTSE ROY 23 Fotonen-energie uit de relatie van Planck 23 Totale energie op 1 cm 2 volgt uit het aantal deeltjes en de energie van 1 deeltje: 24 Het vermogen dat instraalt op 1 cm 2 is 10. 000 keer zo klein als op 1 m 2: dus de maximale tijd wordt hooguit een half uur voor grootse Roy:

VII KLEURSTOFMOLEKUUL 26 Op lengte L passen een heel aantal buiken, dus 27 Hieruit en uit de relatie van de Broglie volgt de snelheidsformule waaruit de energie formule snel volgt (er is alleen kinetische energie): 28 De energie in de grondtoestand volgt uit invullen van de gegevens, nadat je eerst door e deelt om de energie in e. V te krijgen

VII KLEURSTOFMOLEKUUL 29 Uit die 0, 259 n 2 volgende eerste 3 niveaux: 30 Als de grenzen van zichtbaar licht tussen 400 en 800 nm liggen dan is 1, 55<E*<3, 10 (e. V). Immers: 31 De overgang van 4 naar 3 is de overgang met de laagste energie binnen deze grenzen, leidend tot rood licht:

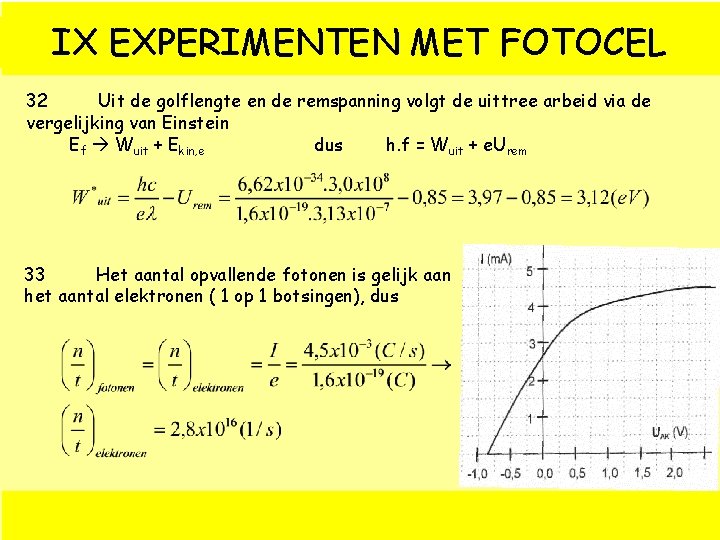
IX EXPERIMENTEN MET FOTOCEL 32 Uit de golflengte en de remspanning volgt de uittree arbeid via de vergelijking van Einstein Ef Wuit + Ekin, e dus h. f = Wuit + e. Urem 33 Het aantal opvallende fotonen is gelijk aan het aantal elektronen ( 1 op 1 botsingen), dus

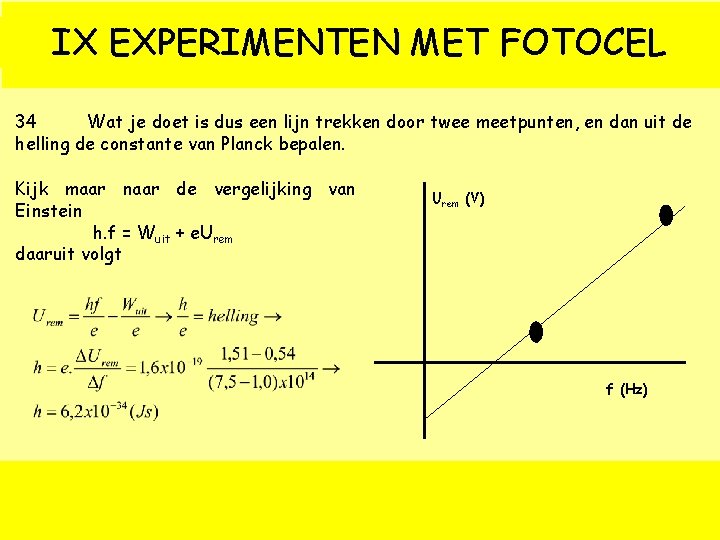
IX EXPERIMENTEN MET FOTOCEL 34 Wat je doet is dus een lijn trekken door twee meetpunten, en dan uit de helling de constante van Planck bepalen. Kijk maar naar de vergelijking van Einstein h. f = Wuit + e. Urem daaruit volgt Urem (V) f (Hz)

X DS MOLEKULEN 36 Vul de formule voor het deeltje in de doos in en bereken de uitkomst voor n=1 t/m 6: 37 De terugval van n=7 naar n=6 levert De wet van Planck levert de golflengte n E x 10 -20(J) 1 6, 04 2 24, 2 3 54, 3 4 9, 66 5 151 6 217 38 Bij een dubbele lengte L wordt L 2 22=4 maal zo groot en stijgt het aantal elektronen naar 12 zodat bij de overgang 13 12 met (132 -122)=25 rekening gehouden moet worden. Dus wordt de energiuestap 25/4 maal zo groot en de golflengte 25/4 maal zo klein.

XI NEUTRINO’s 37 De formule voor het deeltje in de doos bij de overgang van 2 naar 1 luidt: Invullen levert de energie van het vrijkomende foton Omgerekend is dit 6 Me. V, en dat is de energie van een gamma foton volgens BINAS 19 B (zachte gamma straling boven de 1 Me. V)

XII TRILLINGEN IN EEN MOLEKUUL A Voor een massaveersysteem geldt: Hierin is m de massa van het H-atoom, gelijk aan 1, 673 ⋅ 10 -27 kg. Invullen geeft: B Het waterstofatoom heeft zijn maximale snelheid voor u = 0. Aangezien h daar het snelst beweegt, is de kans het kleinst dat je het deeltje daar aantreft. Als het deeltje richting +A of -A gaat, is zijn snelheid juist erg klein. Hij zal dus relatief lang in de buurt van deze uitersten posities zijn. Hier is de waarschijnlijkheid dat je het deeltje aantreft dus het grootst. Als de totale energie van het systeem groter wordt zou het deeltje verder weg van de evenwichtsstand kunnen komen. De breedte van de waarschijnlijkheidsverdeling zal dus toenemen. Aangezien het deeltje op meer plekken gevonden kan worden, zal de kans overal iets kleiner zijn. De hoogte van de waarschijnlijkheidsverdeling zal dus afnemen.

XII TRILLINGEN IN EEN MOLEKUUL C • Voor de frequenties zien we in fig 3 dat ze allemaal veelvouden van hetzelfde getal zijn. De relatie E = hf zegt ons dan dat de mogelijke energieën ook een veelvoud van één getal zijn. De afstand tussen de energieniveaus is dan dus constant. • Het verschil tussen twee opvolgende energieniveaus is 0, 68 ⋅ 1014 Hz. De bijhorende energie is: De frequentie van lijn B is 2 xzo groot als de frequentie van lijn A. De energie is dan dus ook 2 x zo groot. Dat kan op 2 manieren, zie figuur. D De E-niveaus in een E-put met oneindig hoge wanden liggen bij hogere n al verder uit elkaar. De energieniveaus in een vrij waterstofatoom komen steeds dichter bij elkaar te liggen. Aangezien de energieniveaus voor HI op dezelfde afstand blijven liggen zijn beide modellen dus niet toe te passen op HI. E Als het deeltje helemaal stilstaat, zou de onzekerheid in de snelheid (en dus de impuls) 0 zijn. Aangezien het deeltje ergens in het atoom kan worden aangetroffen, is de onzekerheid in de positie niet oneindig groot. Dit is in strijd met de onbepaaldheidsrelatie van Heisenberg.

EXTRA