Definizione e tipi di trapianti Def si intende


















- Slides: 27


Definizione e tipi di trapianti Def. : si intende il trasferimento di cellule, di tessuti e di organi da un individuo, definito donatore ad un altro, definito ricevente o ospite. • Lo studio venne effettuato a metà del XX secolo da Peter Medwar , il quale facendo riferimento agli studi sulla genetica utilizzò topi appartenenti a dei ceppi selezionati. • I ceppi selezionati erano singenici , ossia appartenenti all’incrocio tra fratello e sorella della stessa nidiata per 20 generazioni successive, ottenendo animali geneticamente identici come lo sono i gemelli monocoriali che derivano da un solo zigote.

Breve storia dei trapianti • Il primo trapianto d’organo effettuato è stato il trapianto di rene. Il 23 dicembre 1954 Harrison e Murray a Boston trapiantarono un rene allo compatibile in un gemello omozigote. Fortunatamente, il trapianto ebbe successo e durò circa dieci anni. • Il primo trapianto di polmone fu operato da Hardy nel 1963, purtroppo però con scarsi risultati: il paziente sopravvisse soltanto 18 giorni. • Nel 1963, Starzl eseguì il primo trapianto di fegato. Dai primi 171 interventi pionieristici di trapianto di fegato si è giunti agli 8000 trapianti del 1966. • Nell’anno successivo (1964) Hardy e Webb eseguirono il primo trapianto di cuore xenogenico scimmia-uomo che durò soltanto poche ore. • Nel 1967, in Sud Africa Christian Barnard eseguì il primo trapianto di cuore.

Breve storia dei trapianti • Nel 1967, Kelly e Lillehei eseguirono il primo trapianto di pancreas la cui indicazione è oggi il diabete mellito, la pancreatine cronica e i certi tumori pancreatici. • Il primo trapianto d’intestino e’ stato effettuato da Lillehei nel 1967. • Agli inizi degli anni ottanta Borel introdusse l’uso della ciclosporina A come farmaco anti-rigetto. Questa scoperta permise di controllare i rigetti e impresse velocità allo sviluppo clinico dei trapianti d’organo. In Italia • Il primo trapianto di rene fu eseguito a Roma nel 1966 dal Prof Paride Stefanini a dai suoi aiuti Prof Raffaello Cortesino e Prof carlo Umberto Casciani. • Il primo trapianto di fegato italiano fu eseguito nel 1983 a Roma dal Prof Raffaello Cortesini • Il primo trapianto di cuore fu eseguito a Padova nel 1985. • Il primo trapianto di polmone fu eseguito a Roma nel 1990 al Policlinico Umberto I dal Prof. Costante Ricci.

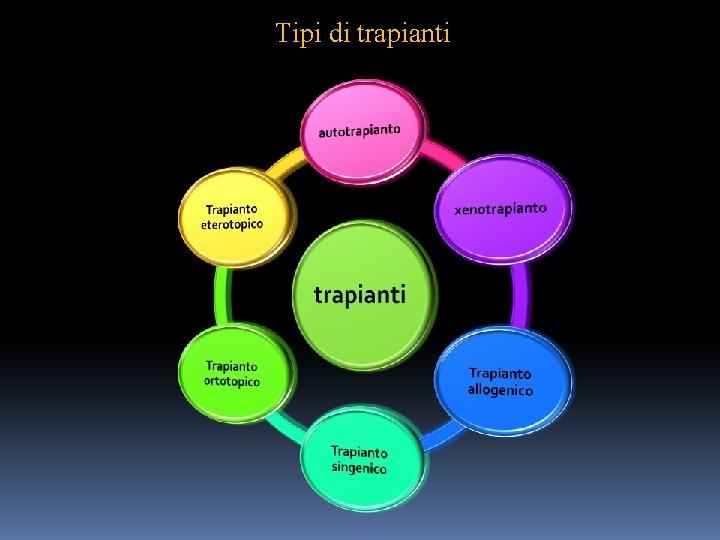
Tipi di trapianti

Definizione e tipi di trapianti Si possono distinguere i seguenti tipi di trapianti : • ORTOTOPICO : quando l’organo trapiantato è impiantato nella sua sede naturale dalla quale è stato asportato l’organo corrispondente. • ETEROTOPICO : quando l’organo trapiantato è impiantato in una sede diversa dalla sede naturale dalla quale era stato asportato. • AUTOTRAPIANTO : trapianto di un organo da una parte all’altra dello stesso animale, sempre accettato. • TRAPIANTO SINGENICO : trapianto di un organo proveniente da un topo dello stesso ceppo selezionato , sempre accettato. • TRAPIANTO ALLOGENICO : trapianto di un organo proveniente da un topo di ceppo selezionato diverso, rigettato. • XENOTRAPIANTO : trapianto di un organo proveniente da un animale di specie diversa , rigettato. •

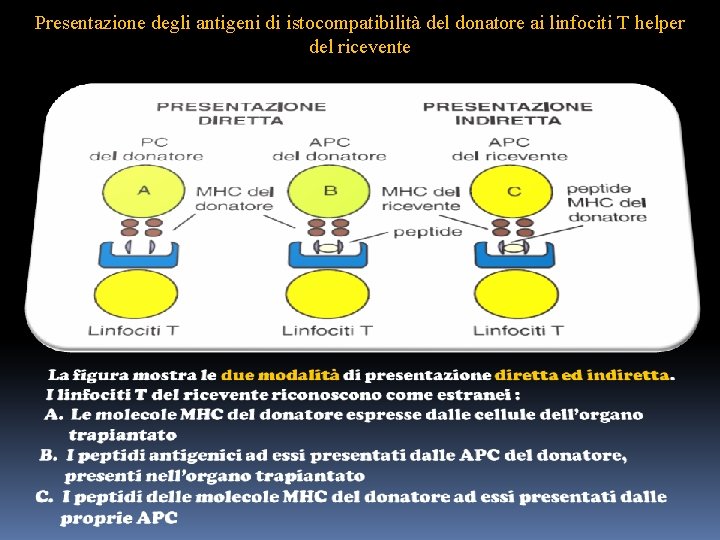
Presentazione degli antigeni di istocompatibilità del donatore ai linfociti T helper del ricevente

La tasca di una molecole MHC dove viene la presentazione dell’antigene

Definizione e tipi ti trapianti

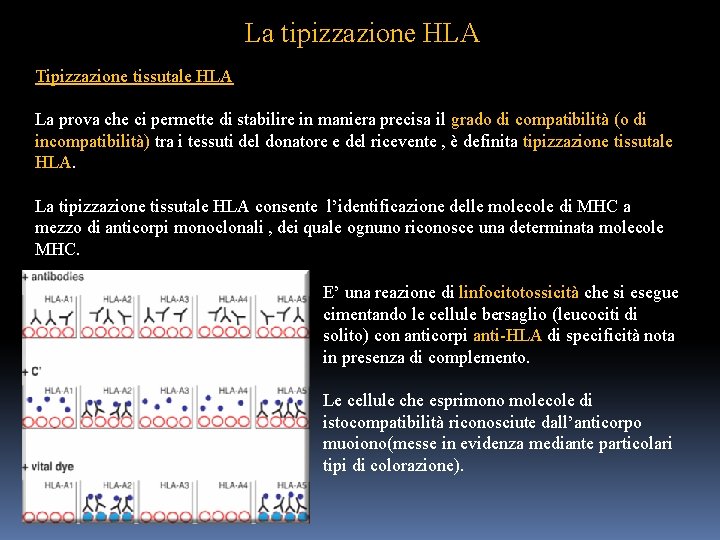
La tipizzazione HLA Tipizzazione tissutale HLA La prova che ci permette di stabilire in maniera precisa il grado di compatibilità (o di incompatibilità) tra i tessuti del donatore e del ricevente , è definita tipizzazione tissutale HLA. La tipizzazione tissutale HLA consente l’identificazione delle molecole di MHC a mezzo di anticorpi monoclonali , dei quale ognuno riconosce una determinata molecole MHC. E’ una reazione di linfocitotossicità che si esegue cimentando le cellule bersaglio (leucociti di solito) con anticorpi anti-HLA di specificità nota in presenza di complemento. Le cellule che esprimono molecole di istocompatibilità riconosciute dall’anticorpo muoiono(messe in evidenza mediante particolari tipi di colorazione).

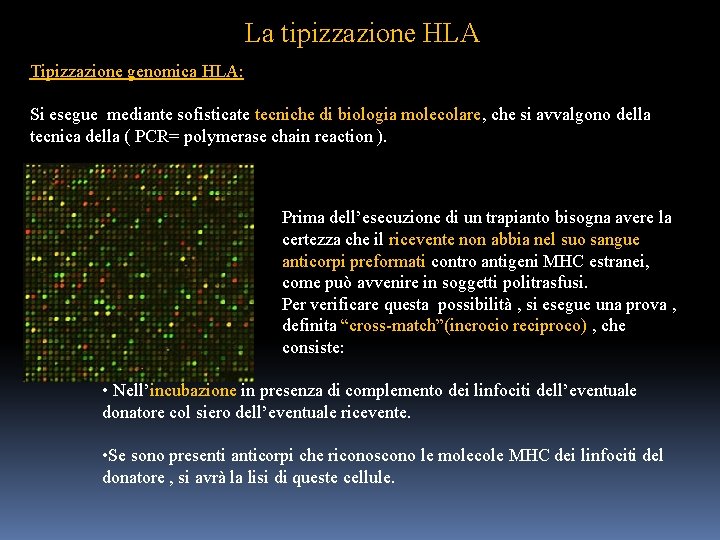
La tipizzazione HLA Tipizzazione genomica HLA: Si esegue mediante sofisticate tecniche di biologia molecolare, che si avvalgono della tecnica della ( PCR= polymerase chain reaction ). Prima dell’esecuzione di un trapianto bisogna avere la certezza che il ricevente non abbia nel suo sangue anticorpi preformati contro antigeni MHC estranei, come può avvenire in soggetti politrasfusi. Per verificare questa possibilità , si esegue una prova , definita “cross-match”(incrocio reciproco) , che consiste: • Nell’incubazione in presenza di complemento dei linfociti dell’eventuale donatore col siero dell’eventuale ricevente. • Se sono presenti anticorpi che riconoscono le molecole MHC dei linfociti del donatore , si avrà la lisi di queste cellule.

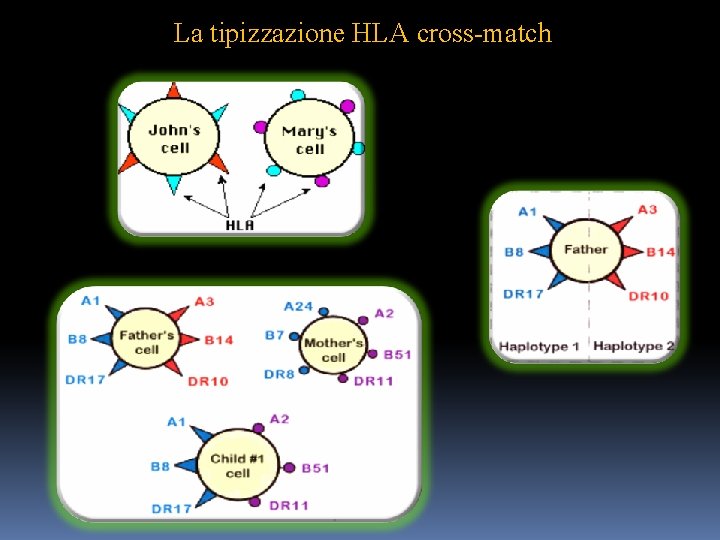
La tipizzazione HLA cross-match

La scelta del donatore In caso di disponibilità di un donatore cadavere, i suoi dati vengono telematicamente comunicati ai Centri di trapianto presso i quali sono contenuti in un database tutti i dati relativi agli aspiranti riceventi (liste di attesa). La selezione del ricevente o dei riceventi , viene fatta sulla base della compatibilità nell’ambito del gruppo ematico ABO e della più estesa identità tra gli antigeni HLA. Gli organi prelevati dal donatore vengono messi in appositi contenitori ed inviati immediatamente all’ospedale dove è ricoverato o è stato convocato urgentemente il ricevente. IL prelievo è spesso eseguito dalla stesse equipe che eseguirà il trapianto. Il candidato donatore ideale è in prima istanza un fratello gemello monocoriale( che condivide i due aplotipi) ed in seconda istanza un fratello non identico che condivide un aplotipo.

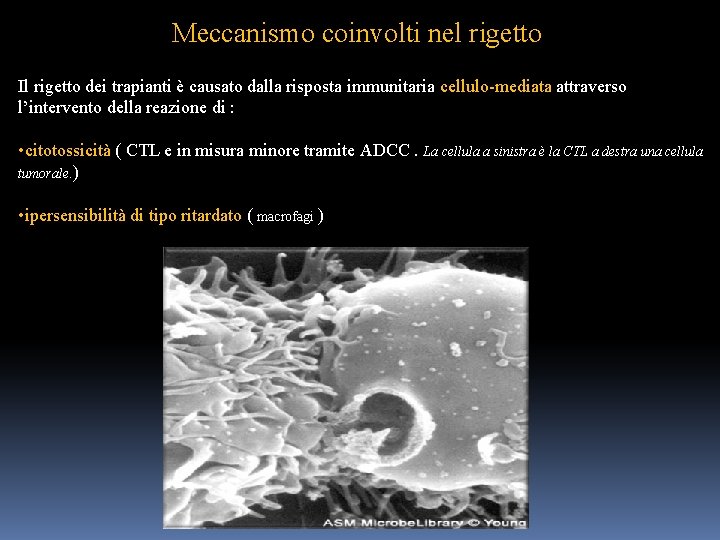
Meccanismo coinvolti nel rigetto Il rigetto dei trapianti è causato dalla risposta immunitaria cellulo-mediata attraverso l’intervento della reazione di : • citotossicità ( CTL e in misura minore tramite ADCC. La cellula a sinistra è la CTL a destra una cellula tumorale. ) • ipersensibilità di tipo ritardato ( macrofagi )

Meccanismo coinvolti nel rigetto Nel rigetto si possono distinguere due fasi :

Fase di sensibilizzazione In questa fase gli alloantigeni attivano sia i linfociti T CD 4+, sia i linfociti CD 8+ , mediante il seguente meccanismo : • gli Ag ( peptidi ) , provenienti dalla processazione delle proteine derivate dalle cellule del trapianto sono esposti sulle molecole di classe II delle cellule APC del ricevente ed attivano i linfociti CD 4+ specifici , i quali proliferano e si differenziano in TH 1. • I linfociti CD 8+ specifici vengono attivati dagli alloantigeni HLA esposti sulle cellule del trapianto. Nei trapianti degli organi sono presenti le cellule APC del donatore ( denominati leucociti viaggiatori ) , in genere cellule dendritiche migrano nei linfonodi del ricevente ed essendo riconosciute come estranee, attivano il linfociti T presenti nelle zone paracorticali.

Fase effettrice I linfociti T cosi attivati migrano nel tessuto del trapianto e ne causano il rigetto. I linfociti CD 8 si differenziano in CTL attivate ed uccidono le cellule del trapianto. I linfociti CD 4+ attivati nella fase sensibilizzante (Th 1) producono le citochine implicate nella reazione cellulo-mediata , nel dettaglio: • L’IL-2 , che promuove la proliferazione dei linfociti T, sia CD 4+ che CD 8 • L’IFN-g che determina lo sviluppo della reazione dell’ipersensibilità ritardata, mediata dai macrofagi • Il TNF-b, il quale ha un’azione citotossica diretta sulle cellule del trapianto.

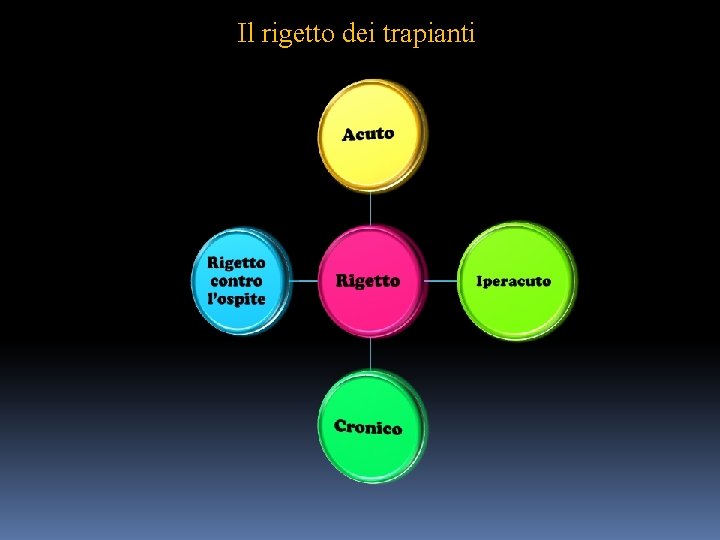
Il rigetto dei trapianti

Il rigetto dei trapianti Tenendo in considerazione l’aspetto cronologico della comparsa e l’aspetto delle lesioni tissutali in cui va in contro un organo trapiantato, possiamo considerare tipi di rigetto: 1. iperacuto: • compare entro qualche giorno dal trapianto. • Si ha quando nel sangue del ricevente sono contenuti anticorpi che reagiscono con antigeni presenti nelle cellule trapiantate. • Gli antigeni prevalentemente coinvolti sono quelli di gruppo ABO ed antigeni HLA. • L’organo trapiantato va in necrosi per mancato apporto di ossigeno e di nutrienti Questa è la conseguenza di azione degli anticorpi preformati con antigeni espressi dalle cellule endoteliali e dalla susseguente attivazione del complemento.

Il rigetto dei trapianti 2. Acuto : • interviene in un periodo di tempo compreso tra le due settimane ed un anno dopo il trapianto. • E’ mediato dalla reazione di anticorpi e di linfociti T citotossici dell’ospite verso le molecole di istocompatibilità , espresse dalle cellule endoteliali e parenchimali dell’organo trapiantato, o verso peptidi da esse presentate. 3. Cronico : • si manifesta dopo un maggiore lasso di tempo dal trapianto, cioè non prima di tre mesi o anche a distanza di qualche anno. • E’ causato essenzialmente da una reazione di ipersensibilità ritardata nel corso della quala si ha produzione di citochine (in particolare di PDGF= plateled derived growth factor) che stimolano i fibroblasti alla moltiplicazione ed alla produzione di collagene con la conseguenza che , gradualmente , il parenchima dell’organo trapiantato viene distrutto e sostituito da estese cicatrici fibrotiche.

La reazione del trapianto verso l’ospite (Graft versus host disease=GVHD) Fra i trapianti più utilizzati e con un buon esito vi è il trapianto di midollo osseo , che si esegue con l’infusione endovenosa nel ricevente di un adeguata quantità di midollo osseo, prelevata ad un donatore quanto più possibile istocompatibile. Le indicazioni terapeutiche riguardano in questo caso non solo alcune gravi malattie del sistema emopoietico , in particolare alcune leucemie, ma anche alcune immunodeficienze congenite. Il trapianto di midollo può essere: • autologo, cioè effettuato con un campione di midollo osseo , prelevato dallo stesso paziente in un momento di remissione di alcune forme di leucemia e privato delle cellule neoplastiche eventualmente presenti • allogenico, cioè eseguito con cellule midollari provenienti da un donatore preferibilmente consanguineo.

La reazione del trapianto verso l’ospite (Graft versus host disease=GVHD) Nel trapianto di midollo il riconoscimento immunitario ( e la conseguente reazione) non è espletata dal sistema immunitario del ricevente verso gli antigeni di istocompatibilità del tessuto midollare trapiantato perché, prima del trapianto, il paziente viene totalmente irradiato e/o sottoposto ad adeguato trattamento farmacologico con farmaci citostatici con duplice scopo: A. per eliminare tutte le cellule emopoietiche del suo midollo , tra le quali quelle che daranno origine a cellule immunocompetenti , nonché le cellule leucemiche eventualmente presenti. B. per preparare un microambiante midollare idoneo a ricevere adeguatamente le cellule midollari del donatore. Saranno le cellule immunocompetenti del donatore , che derivano dalle cellule midollari trapiantate , a riconoscere come estranee gli antigeni di istocompatibilità espressi da tutte le cellule del ricevente.

La reazione del trapianto verso l’ospite (Graft versus host disease=GVHD) La reazione del trapianto verso l’ospite , provoca nel ricevente l’insorgenza della cosi detta malattia da reazione del trapianto verso l’ospite che può manifestarsi in forma : • acuta : 1 o 2 mesi dopo il trapianto • cronica : diversi mesi dopo il trapianto. La sintomatologia è grave e coinvolge diversi apparati e sistemi, specialmente la cute, l’apparato digerente ed il fegato. Ovviamente questa reazione non si verifica nel caso di trapianto autologo o proveniente da un gemello monocoriale. Esistono a tutt’oggi diversi metodi per prevenire l’insorgenza della GVHD.

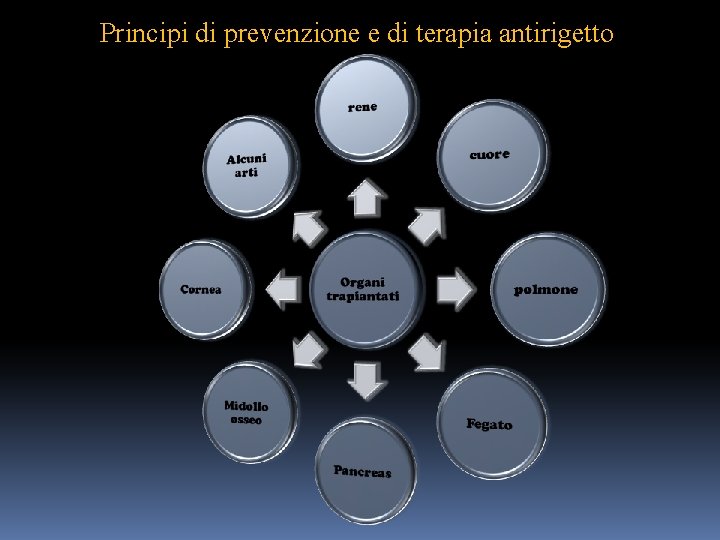
Principi di prevenzione e di terapia antirigetto Da un punto di vista teorico il migliore criterio di prevenzione del rigetto del trapianto è quello dell’impiego di organi prelevati da un donatore dello stesso gruppo sanguigno ABO ed Rh, i cui antigeni di istocompatibilità siano in gran parte identici a quelli del ricevente. Nel caso di trapianto della cornea, che è un tessuto privo di vasi, ed i alcuni organi , quali il cuore ed il fegato, si può avere una buona sopravvivenza del trapianto, anche se il donatore è alquanto differente dal ricevente per il sistema MHC. I risultati ottenuti dopo numerosi casi si trapianto hanno permesso di considerare: 1. Nel trapianto di rene la incompatibilità maggiormente responsabile di rigetto riguarda in ordine decrescente gli antigeni dei loci DR, B e A. 2. Nel cuore l’espressione degli antigeni di istocompatibilità di classe I è pressochè esclusivamente effettuata dagli endoteliociti dei vasi sanguigni mentre è molto scarsa nei miocardiociti, fatto questo che ha consentito l’esecuzione del trapianto nel solo ambito della compatibilità ABO tra donatore e ricevente.

Principi di prevenzione e di terapia antirigetto 3. Nel caso del trapianto di fegato , la incompatibilità degli antigeni del MHC, giuoca un ruolo molto meno importante , ai fini della sopravvivenza dell’organo trapiantato, in confronto a quanto riscontrato per il rene perché negli epatociti l’espressione degli antigeni di istocompatibilità è di scarso rilievo. Per evitare che la reazione immune(sia anticorpo che cellulo-mediata) del ricevente porti al rigetto è necessario sottoporre i portatori di trapianto a terapia immunosoppressiva. Per effettuare questo si sono adoperati diversi framaci, trai quali al momento, la ciclosporina si è dimostrato quello dotato di maggiore efficacia, tanto da permettere per moltissimi anni la sopravvivenza e la funzione dell’organo trapiantato.

Principi di prevenzione e di terapia antirigetto

Cenni di terapia Per essere sicuri che un trapianto allogenico possa attecchire, si deve trattare il paziente, il più presto possibile, con farmaci immunosoppressivi non specifici, quali : • Inibitori mitodici ( azatioprina ) • Corticosteroidi • Metaboliti fungini ( ciclosporina ) L’uso di questi farmaci induce nel paziente uno stato di immunodepressione generalizzata nei confronti di tutti gli Ag non solo quelli HLA, provocando effetti collaterali, quali : • Aumento di sviluppare infezioni • Aumento di sviluppare tumori L’uso di immunodepressivi non previene il rigetto del trapianto di tipo cronico. Sono in fase di sperimentazione farmaci basati su anticorpi monoclonali che inibiscono la costimolazione dei linfociti T.
 Son yörüngesinde 4 elektron bulunan maddelere ne denir
Son yörüngesinde 4 elektron bulunan maddelere ne denir X tipi matris
X tipi matris Centro nazionale trapianti
Centro nazionale trapianti Sit trapianti
Sit trapianti Centro nazionale trapianti
Centro nazionale trapianti Donor manager
Donor manager Centro nazionale trapianti
Centro nazionale trapianti Deus in adiutorium meum intende traduzione
Deus in adiutorium meum intende traduzione Per software si intende
Per software si intende Cosa si intende per tic
Cosa si intende per tic Per bio-etnocentrismo si intende
Per bio-etnocentrismo si intende Che cose lapotema
Che cose lapotema Cosa si intende per legalità
Cosa si intende per legalità Cosa vuol dire risorgimento
Cosa vuol dire risorgimento Scienze umane cos'è
Scienze umane cos'è Che cosa si intende per controriforma
Che cosa si intende per controriforma Cosa si intende per rischi emergenti
Cosa si intende per rischi emergenti Tipi di strofe
Tipi di strofe Esempio analisi del testo narrativo
Esempio analisi del testo narrativo U tipi manometre
U tipi manometre Canerhan tipi
Canerhan tipi Datu tipi
Datu tipi Diversi tipi di equazioni
Diversi tipi di equazioni Tipi di cambiamento
Tipi di cambiamento Arrangiamento ro
Arrangiamento ro Tipi di testo
Tipi di testo Congiuntivo iussivo
Congiuntivo iussivo Agregat meyve
Agregat meyve