Dal modellino dei Gas perfetti alla Tecnologia del


















- Slides: 23

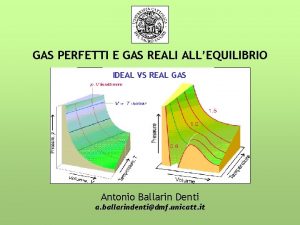
Dal modellino dei Gas perfetti alla Tecnologia del vuoto �Il gas perfetto è un “modellino” teorico che permette di “progettare e dimensionare i sistemi da vuoto”, parte tutto da PV= Nk. T (*) �L’equazione (*) contiene tutte le informazioni necessarie per qualsiasi tipo di gas. �Ed è impressionante: �P pressione del gas, mette in relazione grandezze �V Volume che lo contiene, MACROSCOPICHE �N numero di molecole, (P, V e T) �k costante dei Boltzmann e con la grandezze microscopica N �T temperatura del gas (K) ( numero di atomi, molecole) Vuoto e Spettrometria di Massa

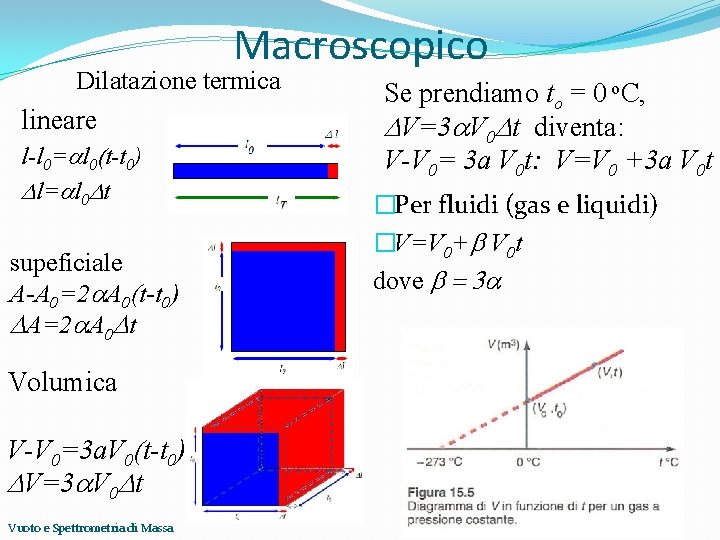
Macroscopico Dilatazione termica lineare l-l 0=al 0(t-t 0) Dl=al 0 Dt supeficiale A-A 0=2 a. A 0(t-t 0) DA=2 a. A 0 Dt Volumica V-V 0=3 a. V 0(t-t 0) DV=3 a. V 0 Dt Vuoto e Spettrometria di Massa Se prendiamo to = 0 o. C, DV=3 a. V 0 Dt diventa: V-V 0= 3 a V 0 t: V=V 0 +3 a V 0 t �Per fluidi (gas e liquidi) �V=V 0+b V 0 t dove b = 3 a

Dilatazione dei gas Dati sperimentali DV =V-V 0 =m ∙ t, da V=V 0 + b ∙ Vo t si ha: m = b ∙ Vo Per tutti i gas che non condensano, a pressione costante si ha che b è lo stesso. Ad un gas rarefatto (vuoto) questo modellino si adatta molto bene. Vuoto e Spettrometria di Massa

Scala termometrica dei Kelvin Riscriviamo DV= b ∙ Vo ∙ Dt , dato che to = 0 Conversione della scala termometrica da ° Celsius a gradi Kelvin o. C, si ha V= Vo (1+ b ∙ t) tk = T = tc + 273. 15 V= Vo (1+ b ∙ t) 1ª legge di Gay-Lussac o (Volta Gay-Lussac) Vuoto e Spettrometria di Massa

V constante 2 a legge di Gay-Lussac Dp = m’ ∙ Dt, Anche in questo caso si ha m’ = b ∙ po, come per la variazione di volume si aveva m = b ∙ Vo e b vale sempre Quindi allo stesso modo con la scala assoluta si ha: 2ª legge di Gay-Lussac o (Volta Gay-Lussac) Vuoto e Spettrometria di Massa

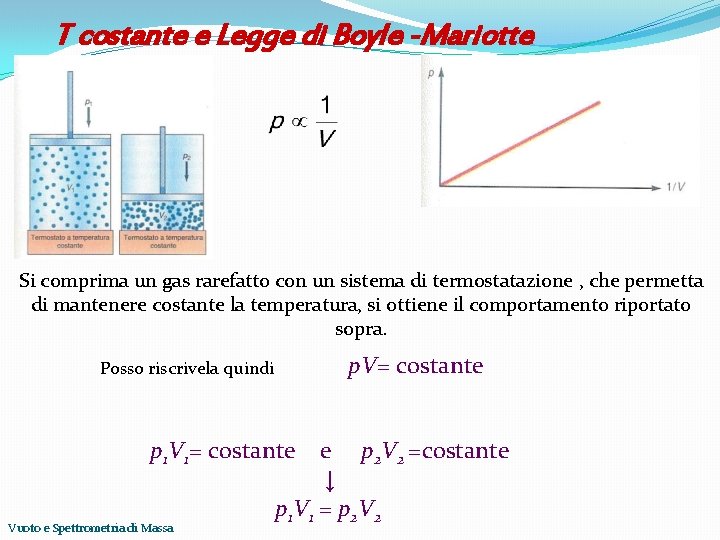
T costante e Legge di Boyle -Mariotte Si comprima un gas rarefatto con un sistema di termostatazione , che permetta di mantenere costante la temperatura, si ottiene il comportamento riportato sopra. p. V= costante Posso riscrivela quindi p 1 V 1= costante Vuoto e Spettrometria di Massa e p 2 V 2 =costante ↓ p 1 V 1 = p 2 V 2

Partiamo dalla relazione p 1 V 1 = p 2 V 2 (§) Prendiamo la 1 a legge di Gay-Lussac: Moltiplichiamo 1 o e 2 o membro dell’equazione (§) per questa quantità uguale: p 1 V 1 = p 2 V 2 (#) Prendiamo la 2 a legge di Gay-Lussac: Moltiplichiamo 1 o e 2 o membro dell’equazione (#) per una quantità uguale p 1 V 1 = p 2 Vuoto e Spettrometria di Massa

Si ricava ($) Cerco di ordinare a 1 o membro tutto con il pedice 1 ed al 2 o membro con il pedice 2, moltiplicando 1 o e 2 o membro dell’equazione ($) per una quantità uguale Semplifico; Vuoto e Spettrometria di Massa Si ha quindi;

Equazione di Stato dei Gas perfetti Tutti i tipi di gas in condizioni rarefatte (pressioni basse alto vuoto, quello che interessa a noi) soddisfano la seguente legge: Vuoto e Spettrometria di Massa

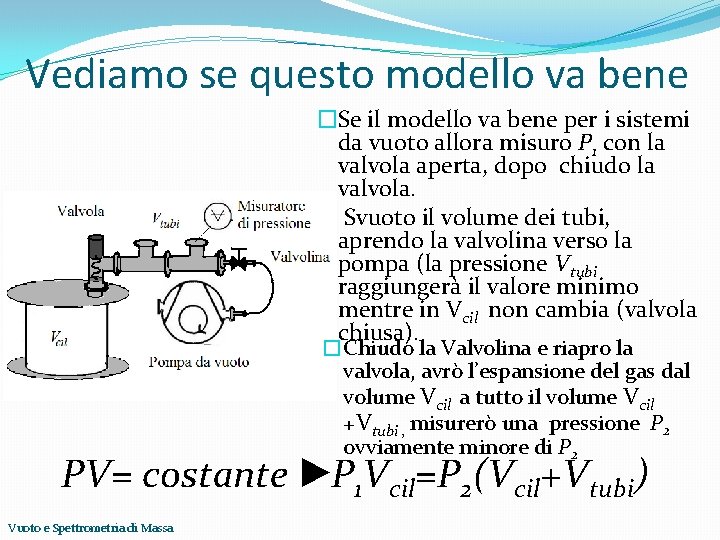
Vediamo se questo modello va bene �Se il modello va bene per i sistemi da vuoto allora misuro P 1 con la valvola aperta, dopo chiudo la valvola. � Svuoto il volume dei tubi, aprendo la valvolina verso la pompa (la pressione Vtubi raggiungerà il valore minimo mentre in Vcil non cambia (valvola chiusa). �Chiudo la Valvolina e riapro la valvola, avrò l’espansione del gas dal volume Vcil a tutto il volume Vcil +Vtubi , misurerò una pressione P 2 ovviamente minore di P 2 PV= costante ►P 1 Vcil=P 2(Vcil+Vtubi) Vuoto e Spettrometria di Massa

Questo vale per ogni successiva operazione � P 1 Vcil = P 2(Vcil+Vtubi) (a) �P 2 Vcil = P 3(Vcil+Vtubi) (b) �P 3. . . = P 4. . ecc. Se divido il primo membro di (a) per il primo membro di (b) , se uso la stessa quantità (secondi membri) l’uguaglianza non cambia. Il rapporto tra le pressioni rimane sempre lo stesso. Vuoto e Spettrometria di Massa

Misura dei rapporti tra le pressione, nel caso dell’espansione Pressione misurata nel volume Vtubi in espansioni successive P 1 P 2 P 3 P 4 P 5 P 6 P 7 P 8 P 9 P 10 P 1/P 2 P 2/P 3 P 3/P 4 P 4/P 5 P 5/P 6 P 6/P 7 P 7/P 8 P 8/P 9 P 9/P 10 media dei rapporti deviazione standard errore percentuale Vuoto e Spettrometria di Massa �La legge che abbiamo introdotto descrive bene il sistema per l’aria, anche in condizioni non rarefatte.

Misura dei rapporti tra P T, nel caso del riscaldamento dell’aria Pressione misurata nel volume Vtubi in espansioni successive P 1 P 2 P 3 P 4 P 5 P 6. . . Pn-1 Pn P 1 P 2 P 3 P 4 P 5 P 6. . . Tn-1 Tn Vuoto e Spettrometria di Massa P 2/P 1 P 3/P 2 P 4/P 3 P 5/P 4 P 6/P 5 Pn/Pn-1 = = =. . . = T 2/T 1 T 3/T 2 T 4/T 3 T 5/T 4 T 6/T 5 Tn/Tn-1 �La legge che abbiamo introdotto descrive bene il sistema per l’aria, anche in condizioni non rarefatte. �Si osservano che i rapporti, rimangono costanti e il rapporto delle pressioni è uguale al rapporto delle temperature.

Equazione di Stato dei Gas perfetti Tutti i tipi di gas in condizioni rarefatte (pressioni basse alto vuoto, quello che interessa a noi) soddisfano la seguente legge: Cos’è questa “costante” ? Vuoto e Spettrometria di Massa Continua

Numero di molecole, massa. . . �Quando gonfiamo un palloncino. = Immettiamo aria. . �Quando evacuiamo una camera. = Togliamo aria. Consideriamo quanto segue, conoscete il significato di queste uguaglianze “chimiche”: Vuoto e Spettrometria di Massa

Legge di Avogado 1811 �Nelle stesso condizioni di pressione e temperatura, stessi volumi di gas diversi contengono lo stesso numero di “particelle”, atomi, molecole … �Per i chimici questo numero è espresso per una mole alla pressione di una atmosfera ed alla temperatura di 0 °C, risultando in V= 22. 4 l. Numero di Avogadro Magari risulta più comprensibile per un volume delle dimensioni di un dado un cc (cm 3) Numero di Loschmidt Vuoto e Spettrometria di Massa

Ora possiamo riscrivere �P pressione, V volume T temperatura espressa in Kelvin, k costante di Boltzmann N numero di molecole. �Questa formula mette in relazione proprietà MACROSCOPICHE (P, V, T) e microscopiche il numero N di molecole. �È stato il cavallo di battaglia della prima teoria fisica: la teoria cinetica dei gas. Vuoto e Spettrometria di Massa

Le grandezze macroscopiche sono misurabili (comprensibili) in modo immediato Unità di misura e simboli utili PRESSIONE P � Dyne/cm 2 = mbar CGS � Newton/m 2 = Pascal � 1 Pa = 1. 0 10 -5 bar �Volumi � 1 m 3= 1 000 l �Litro = l = dm 3 = 1 000 cm 3 �m 3 = 1 000 cm 3 = = 106 cm 3 � 1 atm = 760 Torr (mm Hg) PRESSIONE P 1 atm = 1 013 mbar 1 mbar = 0. 75 Torr Vuoto e Spettrometria di Massa Potenze di 10 10 -12, 10 -9, 10 -6, 10 -3, 1, 103, 106, 109, 1012 pico, nano, micro, milli, . . . , chilo, mega, giga, tera. p, n, m, m, . . . , k, M, G, T

Condizioni stazionarie � Dopo l’evacuazione il sistema rimare ad una pressione costante � Ma la pompa sta asportando volume di gas nell’unità di tempo, ovvero asporta molecole, ci sarà una variazione di molecole nel tempo: (DN/Dt) � ma se moltiplichiamo per k. T: � : (DN/Dt)k. T= D(PV/Dt) che chiamiamo portata Q � Q= D(PV/Dt) � per P costante = P(DV/Dt) e T � dove DV/Dt volume di gas asportato Se guardiamo variazioni per intervalli di tempi infinitesimali Q= P(d. V/dt)=(d. N/dt)k. T d. V/dt= volume di gas evacuato detto: S velocità di pompaggio (l/s) Vuoto e Spettrometria di Massa

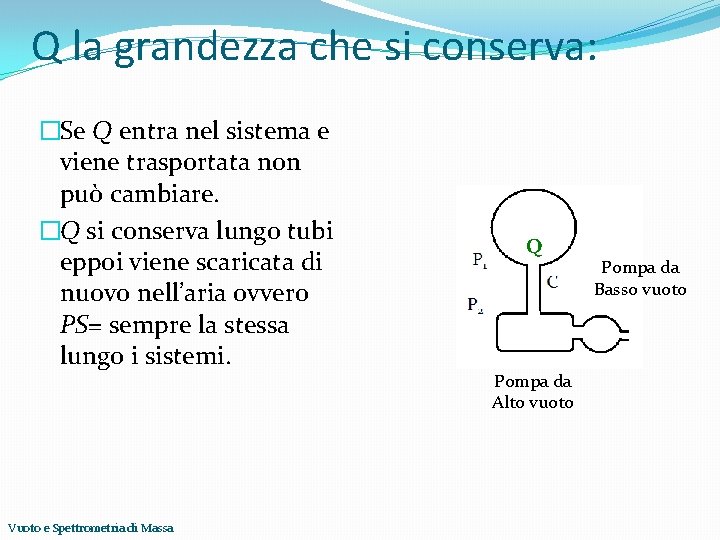
Q la grandezza che si conserva: �Se Q entra nel sistema e viene trasportata non può cambiare. �Q si conserva lungo tubi eppoi viene scaricata di nuovo nell’aria ovvero PS= sempre la stessa lungo i sistemi. Vuoto e Spettrometria di Massa Q Pompa da Alto vuoto Pompa da Basso vuoto

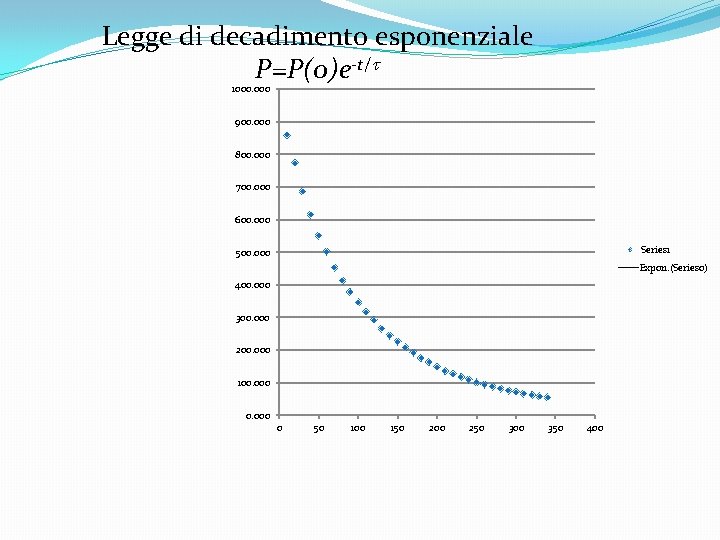
Condizioni non stazionarie: la pressione varia nel tempo. �P varia, consideriamo il volume del contenitore Vcil volume �(Pf-Pi)Vcil =Q=PS �=-d. P/dt=S/Vcil P �P=P(0)e-S/Vcil t = P=P(0)e-t/t �t detta costante di tempo t=Vcil / S �In un tempo t= t la pressione si riduce rispetto al valore iniziale a P=P(0)/e. �Vediamo sperimentalmente se è così. Vuoto e Spettrometria di Massa

Legge di decadimento esponenziale P=P(0)e-t/t 1000. 000 900. 000 800. 000 700. 000 600. 000 Series 1 500. 000 Expon. (Series 0) 400. 000 300. 000 200. 000 100. 000 0 50 100 150 200 250 300 350 400

Legge di decadimento esponenziale Decadimenti radioattivi : numero di atomi radioattivi che decadono nel tempo proporzionale al N Decadimento dell’intensità di particelle negli acceleratori :
 Legge dei gas perfetti
Legge dei gas perfetti R costante dei gas
R costante dei gas Adulteration of dal with kesari dal mainly causes
Adulteration of dal with kesari dal mainly causes Dall'albero alla carta
Dall'albero alla carta Itis marconi nocera
Itis marconi nocera Periodo funzione sinusoidale
Periodo funzione sinusoidale Numeri misti o naturali
Numeri misti o naturali Dal baratto alla moneta
Dal baratto alla moneta Libro di epica dal mito alla storia
Libro di epica dal mito alla storia Méthode perfetti exercices
Méthode perfetti exercices Charles perfetti
Charles perfetti Mas alla de mis miedos mas alla
Mas alla de mis miedos mas alla Vinillo de rioja
Vinillo de rioja Classificazione dei materiali tecnologia
Classificazione dei materiali tecnologia Alla ricerca dei colori perduti
Alla ricerca dei colori perduti Reyneri introduzione alla sociologia del mercato del lavoro
Reyneri introduzione alla sociologia del mercato del lavoro Final de tubo
Final de tubo Francesco rinaldi la marcia dei diritti ascolta
Francesco rinaldi la marcia dei diritti ascolta Quali sono i poligoni regolari
Quali sono i poligoni regolari Agnus dei qui tollis peccata mundi, miserere nobis
Agnus dei qui tollis peccata mundi, miserere nobis Circuitazione campo elettrico zanichelli
Circuitazione campo elettrico zanichelli Energia campo elettrico
Energia campo elettrico Classificazione dei gas
Classificazione dei gas Teoria cinetico molecolare della materia
Teoria cinetico molecolare della materia