COMPOSTI DI COORDINAZIONE Gli elementi di transizione hanno












- Slides: 18

COMPOSTI DI COORDINAZIONE Gli elementi di transizione hanno proprietà che variano relativamente poco andando da sinistra a destra lungo la tavola periodica; hanno inoltre la caratteristica di avere orbitali d incompleti. Per l’accessibilità di svariati stati di ossidazione, molti elementi di transizione hanno proprietà catalitiche. I loro ioni sono spesso colorati (in particolare quelli con un numero dispari di elettroni d) perché, a causa dei numerosi livelli energetici sia pieni che vuoti, ad energie poco diverse, hanno la possibilità di assorbire ed emettere luce visibile. A causa del loro elevato campo elettrico e della presenza di orbitali d incompleti, questi ioni possono dar luogo a composti di coordinazione, o complessi. Uno ione complesso è costituito da un atomo metallico centrale, con carica positiva, che coordina attorno a sé, secondo definite geometrie, un numero definito di molecole polari o di anioni (leganti).

Il numero di leganti coordinati va di solito da 2 a 6, ma può arrivare a 12. Il fenomeno della coordinazione cambia il comportamento sia del metallo che del legante.

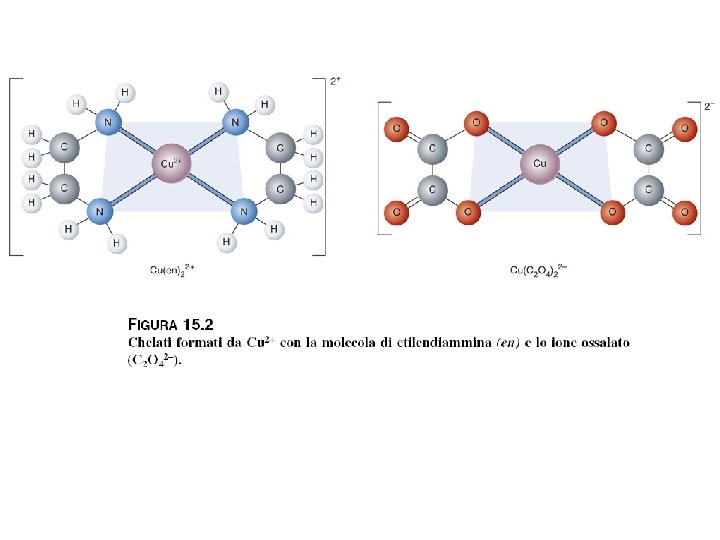
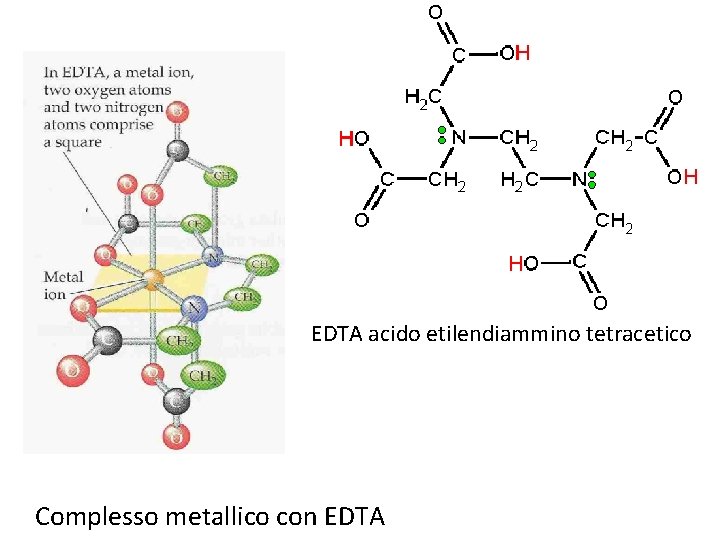
I leganti possono formare uno o più legami con l'atomo centrale e, nel secondo caso si dicono agenti chelanti (per affinità con le chele di molti crostacei). A seconda dei legami che un ligando forma con l'atomo centrale questo si chiama monodentato, bidentato o, in generale, polidentato. Esempi di chelanti sono l'EDTA (etilen-diamminotetraacetato) o l'EN (etilen-diammina). I ligandi come l'acqua o il cloro formano un solo collegamento con l'atomo centrale, e sono quindi detti essere monodentati. L'EDTA è esadentato, il che spiega la grande stabilità di molti dei suoi complessi.


La nomenclatura dei complessi Il procedimento di base per denominare un complesso è il seguente: Si scrivono i nomi dei ligandi in ordine alfabetico. 1. I ligandi monodentati che appaiono più volte ricevono un prefisso greco secondo il numero di occorrenze: di-, tri-, tetra-, penta-, or esa-. I ligandi polidentati (per esempio, etilenediamina, ossalato) ricevono i prefissi bis -, tris-, tetrakis-, e così via. 2. Gli anioni finiscono in o. Per esempio: cianuro diventa ciano. 3. Ai ligandi neutri si danno i loro soliti nomi, con qualche eccezione: NH 3 diventa amino; H 2 O diventa aquo; CO diventa carbonile. Si scrive il nome dell'atomo/ione centrale. Se il complesso è un anione, il nome dell'atomo centrale finirà in -ato, e si userà il suo nome latino se disponibile (eccetto per il mercurio). Se lo stato di ossidazione dell'atomo centrale deve essere specificato (quando è uno di vari stati possibili), lo si scrive come numero romano) tra parentesi. Esempi: [Ni. Cl 4]2 - → ione tetra-cloro-nichelato (II) [Cu. NH 3 Cl 5]3 - → ione amino-penta-cloro-cuprato (II)


Geometria di coordinazione Dal numero di coordinazione dipende la geometria del complesso NC 2 Lineare NC 4 Tetraedrica o quadrata planare NC 5 bipiramide trigonale NC 6 ottaedrica


Mettendo in soluzione insieme ioni Fe 2+ e ioni CN-, si dovrebbe osservare precipitazione dell’idrossido di ferro. In realtà la reazione che avviene è esclusivamente la formazione dello ione complesso esacianoferrato (II): Fe 2+ + 6 CN- = [Fe(CN)6] 4 La K di equilibrio per la reazione di decomposizione di questo complesso, ossia la K della reazione [Fe(CN)6] 4 - = Fe 2+ + 6 CNKinst= [CN-]6 [Fe 2+]/[Fe(CN)6]4È detta costante di instabilità, Kinst, e nel caso dell’esacianoferrato (II) vale 10 -35. la costante della reazione inversa è detta costante di formazione.

Ioni complessi di rame

Chelati

EDTA acido etilendiammino tetracetico Complesso metallico con EDTA

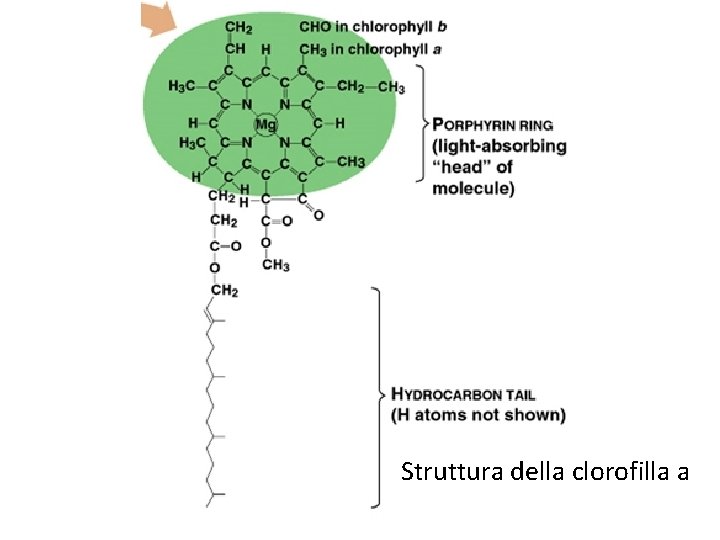
Struttura della clorofilla a

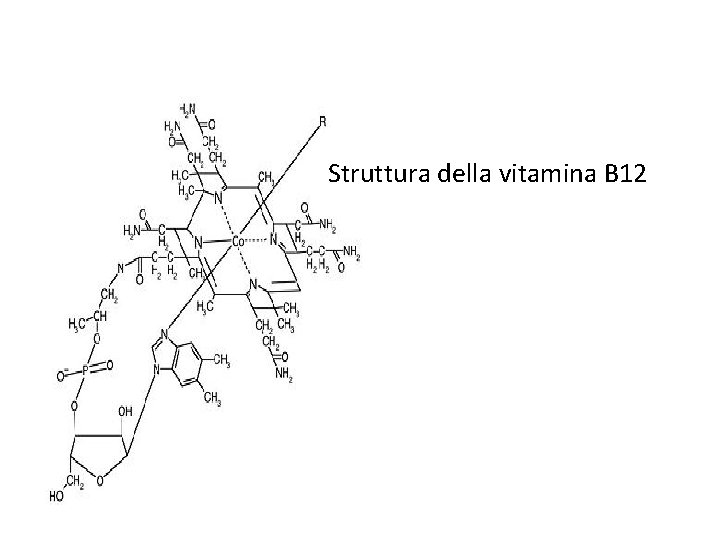
Struttura della vitamina B 12

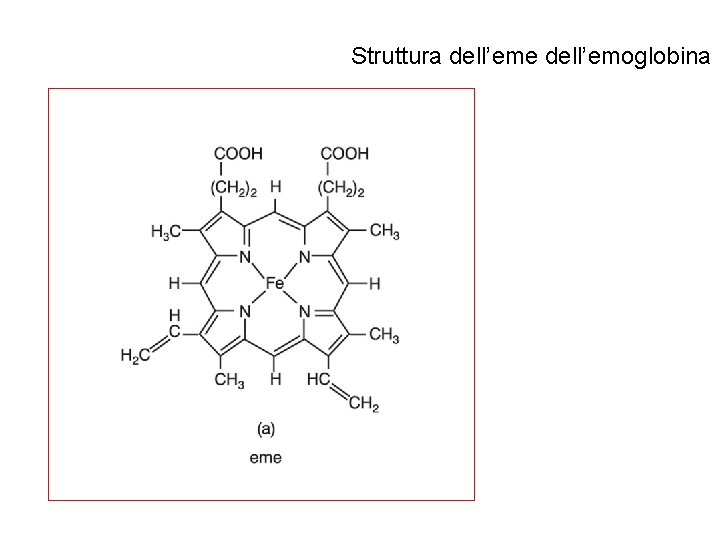
Struttura dell’eme dell’emoglobina


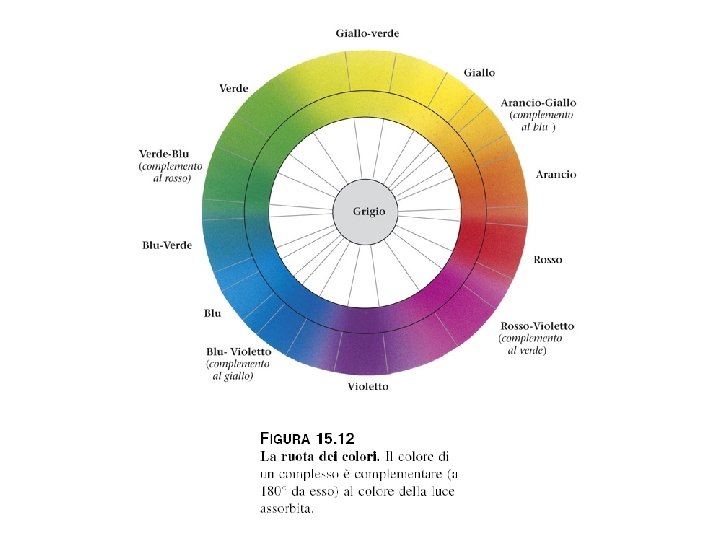
La ruota dei colori

 Configurazione elettronica
Configurazione elettronica Stereoisomeria ottica
Stereoisomeria ottica Quali caratteristiche hanno gli esseri viventi
Quali caratteristiche hanno gli esseri viventi Elementi e composti scuola primaria
Elementi e composti scuola primaria Capacità coordinative
Capacità coordinative Complemento di vocazione
Complemento di vocazione La scapigliatura riassunto
La scapigliatura riassunto Supporto transizione digitale
Supporto transizione digitale Momento di transizione
Momento di transizione Metalli transizione
Metalli transizione Gli elementi della narrazione
Gli elementi della narrazione Gli elementi filler cream
Gli elementi filler cream Quali sono gli elementi fondamentali dello stato
Quali sono gli elementi fondamentali dello stato Gli elementi della comunicazione
Gli elementi della comunicazione Elementi fondamentali dello stato
Elementi fondamentali dello stato Elementi della fiaba
Elementi della fiaba Fattori che determinano il clima
Fattori che determinano il clima Edhs
Edhs Equivalenza di figure piane
Equivalenza di figure piane