Complemento Il sistema del complemento rappresenta uno dei





- Slides: 14

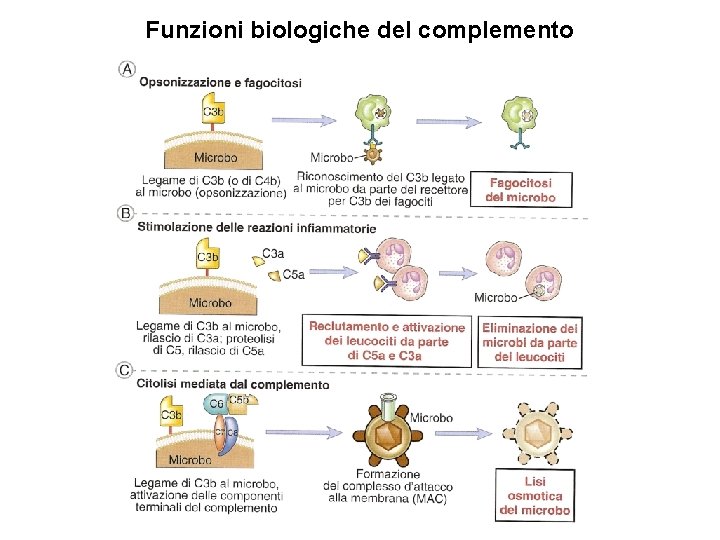
Complemento Il sistema del complemento rappresenta uno dei sistemi umorali dell’immunità innata e adattativa ed è composto da circa 30 proteine, le cui principali sono 9 (C 1 -C 9), sia solubili che di membrana, che innescano una serie di reazioni comprendenti: (1) l’attivazione del processo infiammatorio (2) il reclutamento di cellule fagocitarie per chemiotassi (3) l’opsonizzazione, un meccanismo con cui fattori del complemento aderiscono alla superficie dei patogeni o delle cellule infettate e ne favoriscono la fagocitosi. (4) la distruzione diretta dei patogeni e delle cellule infettate

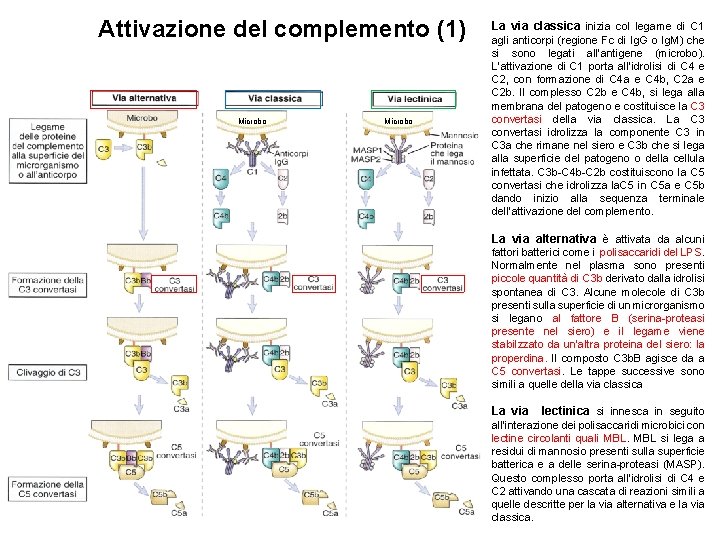
Attivazione del complemento (1) Microbo La via classica inizia col legame di C 1 agli anticorpi (regione Fc di Ig. G o Ig. M) che si sono legati all’antigene (microbo). L’attivazione di C 1 porta all’idrolisi di C 4 e C 2, con formazione di C 4 a e C 4 b, C 2 a e C 2 b. Il complesso C 2 b e C 4 b, si lega alla membrana del patogeno e costituisce la C 3 convertasi della via classica. La C 3 convertasi idrolizza la componente C 3 in C 3 a che rimane nel siero e C 3 b che si lega alla superficie del patogeno o della cellula infettata. C 3 b-C 4 b-C 2 b costituiscono la C 5 convertasi che idrolizza la. C 5 in C 5 a e C 5 b dando inizio alla sequenza terminale dell’attivazione del complemento. La via alternativa è attivata da alcuni fattori batterici come i polisaccaridi del LPS. Normalmente nel plasma sono presenti piccole quantità di C 3 b derivato dalla idrolisi spontanea di C 3. Alcune molecole di C 3 b presenti sulla superficie di un microrganismo si legano al fattore B (serina-proteasi presente nel siero) e il legame viene stabilzzato da un’altra proteina del siero: la properdina. Il composto C 3 b. B agisce da a C 5 convertasi. Le tappe successive sono simili a quelle della via classica La via lectinica si innesca in seguito all’interazione dei polisaccaridi microbici con lectine circolanti quali MBL si lega a residui di mannosio presenti sulla superficie batterica e a delle serina-proteasi (MASP). Questo complesso porta all’idrolisi di C 4 e C 2 attivando una cascata di reazioni simili a quelle descritte per la via alternativa e la via classica.

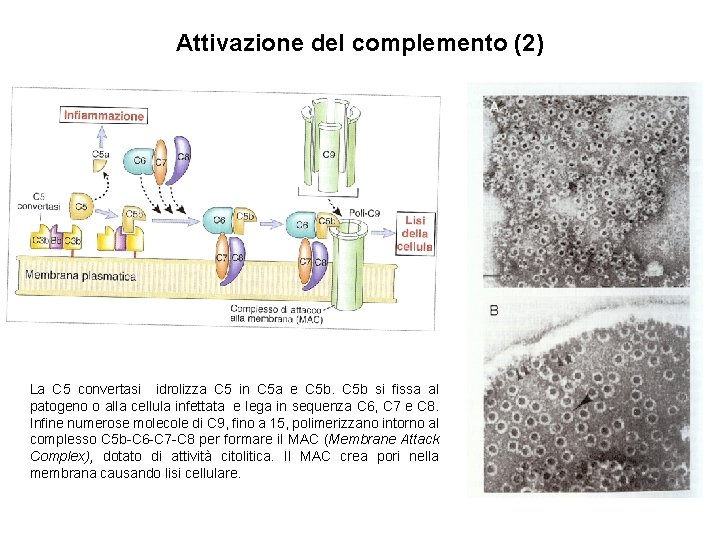
Attivazione del complemento (2) La C 5 convertasi idrolizza C 5 in C 5 a e C 5 b si fissa al patogeno o alla cellula infettata e lega in sequenza C 6, C 7 e C 8. Infine numerose molecole di C 9, fino a 15, polimerizzano intorno al complesso C 5 b-C 6 -C 7 -C 8 per formare il MAC (Membrane Attack Complex), dotato di attività citolitica. Il MAC crea pori nella membrana causando lisi cellulare.

Funzioni biologiche del complemento

Ruolo degli interferoni (IFN) Un ruolo particolarmente importante nell’immunità innata è svolto dagli interferoni (IFN), citochine che rappresentano sia la principale risposta antivirale del nostro organismo sia uno degli esempi di stretto rapporto fra l’immunità innata e quella adattativa.

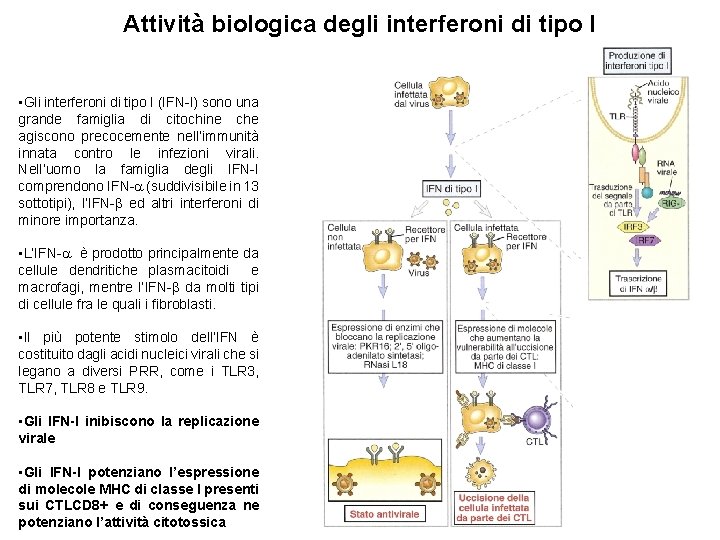
Attività biologica degli interferoni di tipo I • Gli interferoni di tipo I (IFN-I) sono una grande famiglia di citochine che agiscono precocemente nell’immunità innata contro le infezioni virali. Nell’uomo la famiglia degli IFN-I comprendono IFN- (suddivisibile in 13 sottotipi), l’IFN- ed altri interferoni di minore importanza. • L’IFN- è prodotto principalmente da cellule dendritiche plasmacitoidi e macrofagi, mentre l’IFN- da molti tipi di cellule fra le quali i fibroblasti. • Il più potente stimolo dell’IFN è costituito dagli acidi nucleici virali che si legano a diversi PRR, come i TLR 3, TLR 7, TLR 8 e TLR 9. • Gli IFN-I inibiscono la replicazione virale • Gli IFN-I potenziano l’espressione di molecole MHC di classe I presenti sui CTLCD 8+ e di conseguenza ne potenziano l’attività citotossica

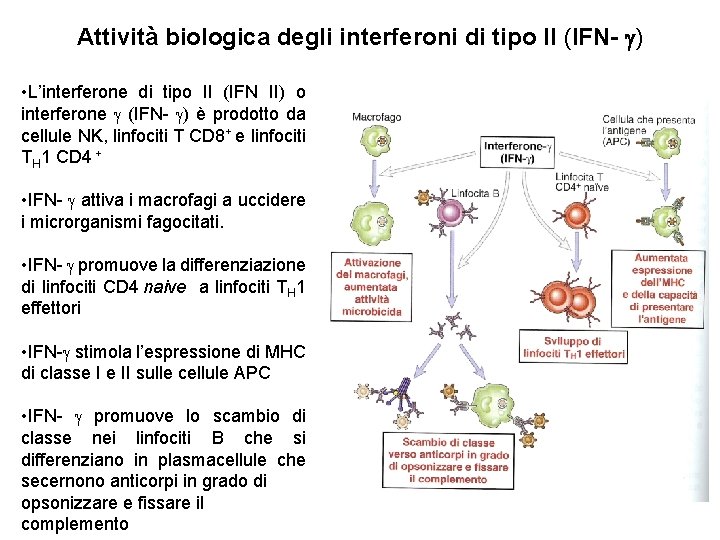
Attività biologica degli interferoni di tipo II (IFN- ) • L’interferone di tipo II (IFN II) o interferone (IFN- ) è prodotto da cellule NK, linfociti T CD 8+ e linfociti TH 1 CD 4 + • IFN- attiva i macrofagi a uccidere i microrganismi fagocitati. • IFN- promuove la differenziazione di linfociti CD 4 naive a linfociti TH 1 effettori • IFN- stimola l’espressione di MHC di classe I e II sulle cellule APC • IFN- promuove lo scambio di classe nei linfociti B che si differenziano in plasmacellule che secernono anticorpi in grado di opsonizzare e fissare il complemento

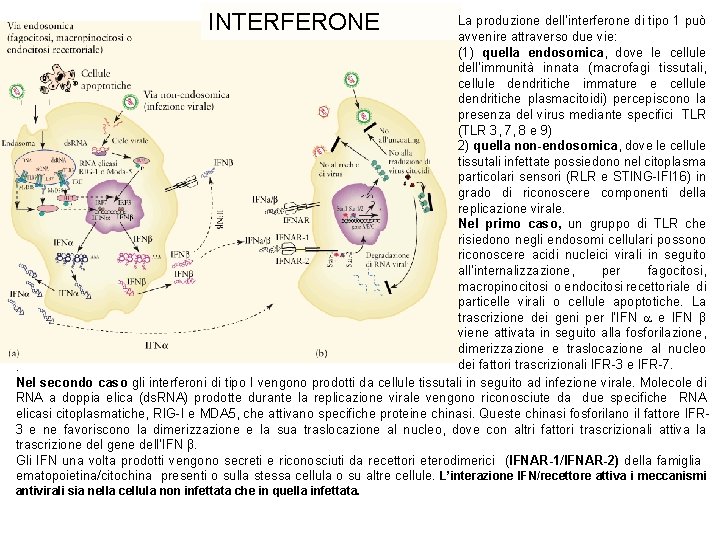
INTERFERONE La produzione dell’interferone di tipo 1 può avvenire attraverso due vie: (1) quella endosomica, dove le cellule dell’immunità innata (macrofagi tissutali, cellule dendritiche immature e cellule dendritiche plasmacitoidi) percepiscono la presenza del virus mediante specifici TLR (TLR 3, 7, 8 e 9) 2) quella non-endosomica, dove le cellule tissutali infettate possiedono nel citoplasma particolari sensori (RLR e STING-IFI 16) in grado di riconoscere componenti della replicazione virale. Nel primo caso, un gruppo di TLR che risiedono negli endosomi cellulari possono riconoscere acidi nucleici virali in seguito all’internalizzazione, per fagocitosi, macropinocitosi o endocitosi recettoriale di particelle virali o cellule apoptotiche. La trascrizione dei geni per l’IFN e IFN β viene attivata in seguito alla fosforilazione, dimerizzazione e traslocazione al nucleo dei fattori trascrizionali IFR-3 e IFR-7. . Nel secondo caso gli interferoni di tipo I vengono prodotti da cellule tissutali in seguito ad infezione virale. Molecole di RNA a doppia elica (ds. RNA) prodotte durante la replicazione virale vengono riconosciute da due specifiche RNA elicasi citoplasmatiche, RIG-I e MDA 5, che attivano specifiche proteine chinasi. Queste chinasi fosforilano il fattore IFR 3 e ne favoriscono la dimerizzazione e la sua traslocazione al nucleo, dove con altri fattori trascrizionali attiva la trascrizione del gene dell’IFN β. Gli IFN una volta prodotti vengono secreti e riconosciuti da recettori eterodimerici (IFNAR-1/IFNAR-2) della famiglia ematopoietina/citochina presenti o sulla stessa cellula o su altre cellule. L’interazione IFN/recettore attiva i meccanismi antivirali sia nella cellula non infettata che in quella infettata.

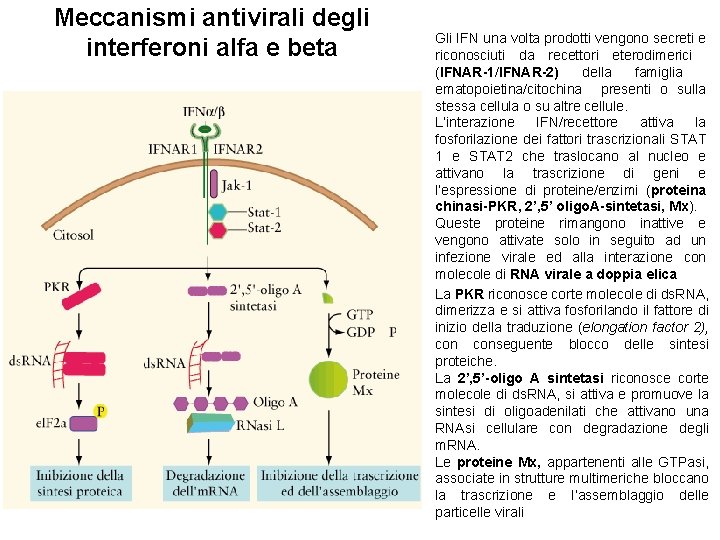
Meccanismi antivirali degli interferoni alfa e beta Gli IFN una volta prodotti vengono secreti e riconosciuti da recettori eterodimerici (IFNAR-1/IFNAR-2) della famiglia ematopoietina/citochina presenti o sulla stessa cellula o su altre cellule. L’interazione IFN/recettore attiva la fosforilazione dei fattori trascrizionali STAT 1 e STAT 2 che traslocano al nucleo e attivano la trascrizione di geni e l’espressione di proteine/enzimi (proteina chinasi-PKR, 2’, 5’ oligo. A-sintetasi, Mx). Queste proteine rimangono inattive e vengono attivate solo in seguito ad un infezione virale ed alla interazione con molecole di RNA virale a doppia elica La PKR riconosce corte molecole di ds. RNA, dimerizza e si attiva fosforilando il fattore di inizio della traduzione (elongation factor 2), conseguente blocco delle sintesi proteiche. La 2’, 5’-oligo A sintetasi riconosce corte molecole di ds. RNA, si attiva e promuove la sintesi di oligoadenilati che attivano una RNAsi cellulare con degradazione degli m. RNA. Le proteine Mx, appartenenti alle GTPasi, associate in strutture multimeriche bloccano la trascrizione e l’assemblaggio delle particelle virali

Applicazioni terapeutiche degli IFN Infezioni virali r. IFN- • Papillomavirus • Infezioni croniche da HBV e HCV Neoplasie r. IFN- • Leucemia mieloide cronica • Leucemia a cellule capellute • Linfoma di Hodgkin • Sarcoma di Kaposi • Melanoma Malattie neurodegenerative r. IFN- • Sclerosi multipla

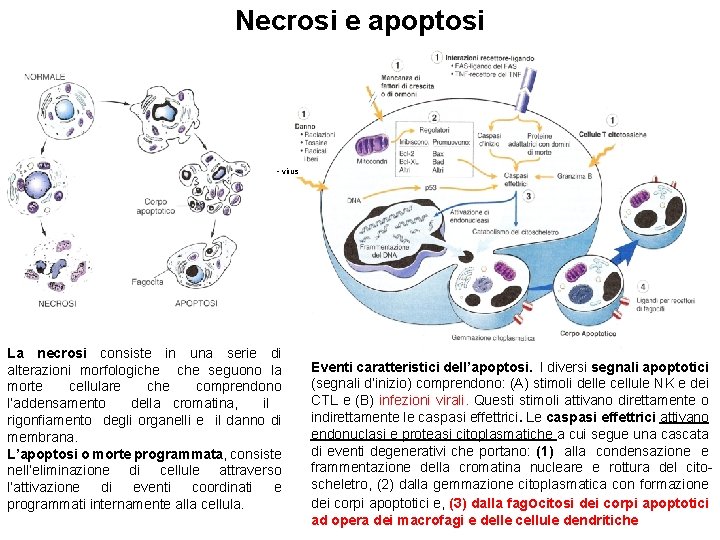
Necrosi e apoptosi • virus La necrosi consiste in una serie di alterazioni morfologiche seguono la morte cellulare che comprendono l’addensamento della cromatina, il rigonfiamento degli organelli e il danno di membrana. L’apoptosi o morte programmata, consiste nell’eliminazione di cellule attraverso l’attivazione di eventi coordinati e programmati internamente alla cellula. Eventi caratteristici dell’apoptosi. I diversi segnali apoptotici (segnali d’inizio) comprendono: (A) stimoli delle cellule NK e dei CTL e (B) infezioni virali. Questi stimoli attivano direttamente o indirettamente le caspasi effettrici. Le caspasi effettrici attivano endonuclasi e proteasi citoplasmatiche a cui segue una cascata di eventi degenerativi che portano: (1) alla condensazione e frammentazione della cromatina nucleare e rottura del citoscheletro, (2) dalla gemmazione citoplasmatica con formazione dei corpi apoptotici e, (3) dalla fagocitosi dei corpi apoptotici ad opera dei macrofagi e delle cellule dendritiche

Eterofagia e Autofagia Eterofagia. Le sostanze provenienti dall’esterno sono portate all’interno della cellula mediante endocitosi. La captazione di particelle è detta fagocitosi. La captazione di piccole macromolecole solubili è detta pinocitosi. I vacuoli formati per endocitosi si fondono con il lisosoma, conseguente degradazione del materiale fagocitato. L’eterofagia è più comune nei fagociti “professionali” come neutrofili e macrofagi. Autofagia. Le sostanze interne al citosol, come organelli intracellulari e porzioni di citosol, sono prima sequestrati all’interno di vacuoli autofagici che si formano a partire dal reticolo endoplasmico rugoso. Questi vacuoli si fondono poi con i lisosomi per formare autofagolisosomi. L’autofagia è un fenomeno comune coinvolto nella rimozione di organelli danneggiati durante il danno cellulare o nel rimodellamento cellulare associato al differenziamento. L'osservazione e la comprensione di questi particolari meccanismi sono state a lungo oggetto di studio e sono valsi il Premio Nobel per la Medicina nel 2016 a Yoshinori Osumi. B. Vacuolo autofagico

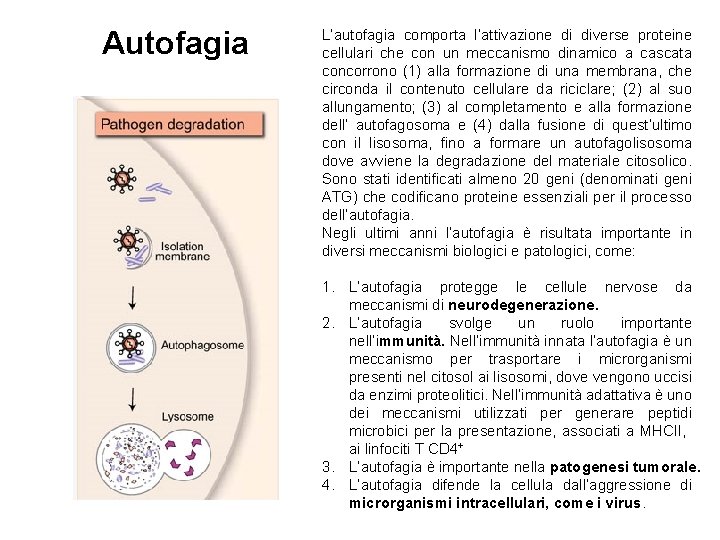
Autofagia L’autofagia comporta l’attivazione di diverse proteine cellulari che con un meccanismo dinamico a cascata concorrono (1) alla formazione di una membrana, che circonda il contenuto cellulare da riciclare; (2) al suo allungamento; (3) al completamento e alla formazione dell’ autofagosoma e (4) dalla fusione di quest’ultimo con il lisosoma, fino a formare un autofagolisosoma dove avviene la degradazione del materiale citosolico. Sono stati identificati almeno 20 geni (denominati geni ATG) che codificano proteine essenziali per il processo dell’autofagia. Negli ultimi anni l’autofagia è risultata importante in diversi meccanismi biologici e patologici, come: 1. L’autofagia protegge le cellule nervose da meccanismi di neurodegenerazione. 2. L’autofagia svolge un ruolo importante nell’immunità. Nell’immunità innata l’autofagia è un meccanismo per trasportare i microrganismi presenti nel citosol ai lisosomi, dove vengono uccisi da enzimi proteolitici. Nell’immunità adattativa è uno dei meccanismi utilizzati per generare peptidi microbici per la presentazione, associati a MHCII, ai linfociti T CD 4+ 3. L’autofagia è importante nella patogenesi tumorale. 4. L’autofagia difende la cellula dall’aggressione di microrganismi intracellulari, come i virus.

FINE