Chimica Fisica Canale MZ Aula T 8 Gio
















- Slides: 22

Chimica Fisica Canale M-Z Aula T 8, Gio. 9 -11 Ven. 14 -16 Fino al 30 aprile Prof. Lorenzo Stella Sett. 5 Liv. 1 (Chimica Fisica) Stanza 4 0672594463 stella@stc. uniroma 2. it

Libri di testo • R. Chang Chimica Fisica (Vol. 1). Zanichelli 2003. • M. Venanzi Appunti di chimica fisica per scienze biologiche. Universitalia 2010. (via di Passolombardo 421) Modalità d’esame • Scritto (esercizi) • Voto finale unico con Chimica Organica (media pesata)

Esercitazioni Lunedì: – 12/4 – 19/4 – 3/5 – 10/5 Aula T 8, ore 14: 30 -16: 30 OPZIONALI

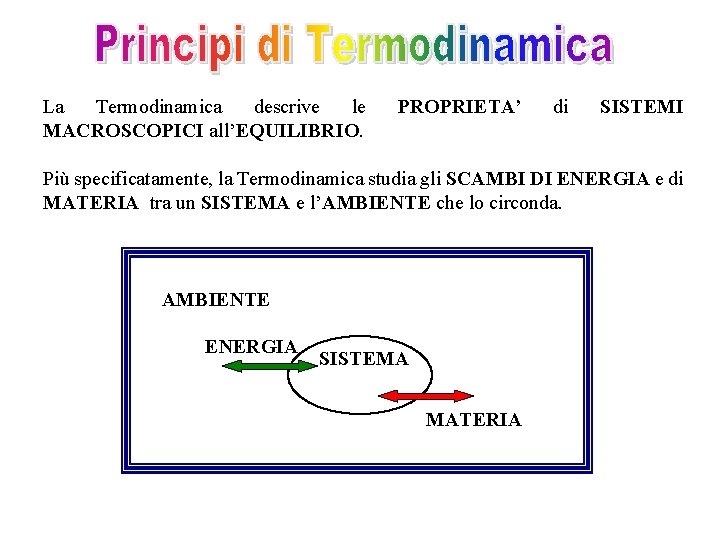
La Termodinamica descrive le MACROSCOPICI all’EQUILIBRIO. PROPRIETA’ di SISTEMI Più specificatamente, la Termodinamica studia gli SCAMBI DI ENERGIA e di MATERIA tra un SISTEMA e l’AMBIENTE che lo circonda. AMBIENTE ENERGIA SISTEMA MATERIA

SISTEMA - Un insieme costituito da un numero macroscopico di molecole, dell’ordine del numero di Avogadro, NA=6. 023 1023. Rappresenta una piccola parte di un sistema molto più grande (AMBIENTE) che lo racchiude interamente. AMBIENTE – Un sistema molto più grande del sistema in esame. Temperatura, volume e pressione dell’ambiente rimangono costanti qualunque siano i cambiamenti del sistema. In particolare, la sua temperatura non cambia qualunque sia l’energia scambiata tra sistema e ambiente.

U = energia scambiata tra sistema e ambiente n = materia scambiata tra sistema e ambiente SISTEMA ISOLATO: ISOLATO non ci sono né scambi di energia, né di materia U = 0 n = 0 SISTEMA CHIUSO: CHIUSO scambia energia, ma non materia U 0 n = 0 SISTEMA APERTO: APERTO scambia energia e materia U 0 n 0

EQUILIBRIO = uno stato durante il quale le proprietà del sistema non cambiano nel tempo. L’equilibrio è sempre di tipo dinamico. Esempio: Liquido puro in equilibrio con la sua fase vapore All’equilibrio: Gas n(gas)=costante n(g→l) n(liq)=costante dn(gas o liq) = dn(g→l) + dn(l→g) = 0 n(l→g) Liquido dn(g→l) = - dn(l→g)

D = rappresenta una variazione finita Ex. T = 10°C, p = 2 atm d = rappresenta una variazione infinitesima (differenziale) Ex. d. T, dp, d. V sono variazioni infinitesime di temperatura, pressione, volume.

Lo stato di equilibrio di un sistema è definito da poche variabili, dette VARIABILI DI STATO ESTENSIVE: DIPENDONO DAL NUMERO DI MOLECOLE CHE COMPONGONO IL SISTEMA. Ex. N = numero di molecole, V = Volume U = Energia interna H = Entalpia S = Entropia G = Energia libera Sono tutte grandezze estensive

VARIABILI DI STATO INTENSIVE NON DIPENDONO DAL NUMERO DI MOLECOLE CHE COMPONGONO IL SISTEMA. p = Pressione, T = Temperatura, = Potenziale chimico Le variabili di stato sono legate tra loro da equazioni dette EQUAZIONI DI STATO Ex. Equazione di stato dei gas ideali p. V=n. RT

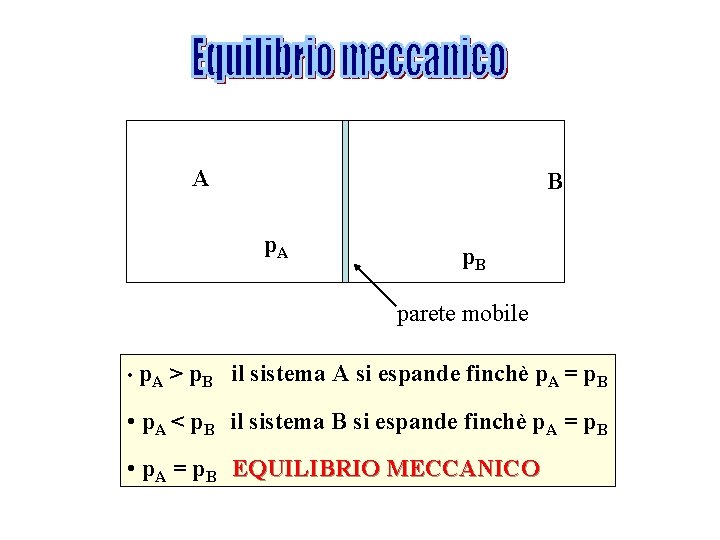
A B p. A p. B parete mobile • p. A > p. B il sistema A si espande finchè p. A = p. B • p. A < p. B il sistema B si espande finchè p. A = p. B • p. A = p. B EQUILIBRIO MECCANICO

1 atm = 760 torr (o mm. Hg) = la pressione esercitata da una colonna riempita di mercurio dell’altezza di 76 cm.

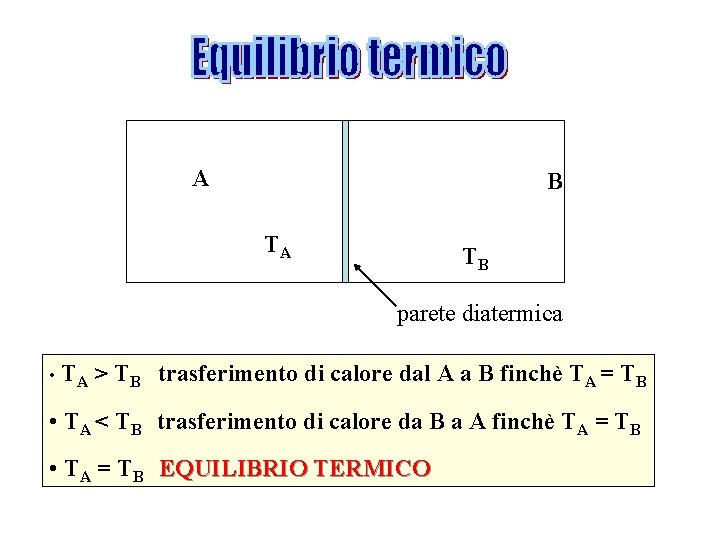
A B TA TB parete diatermica • TA > TB trasferimento di calore dal A a B finchè TA = TB • TA < TB trasferimento di calore da B a A finchè TA = TB • TA = TB EQUILIBRIO TERMICO

GAS IDEALE: un gas di molecole non interagenti e di volume trascurabile Equazione di stato dei gas ideali: p. V=n. RT n = numero di moli p = pressione V = volume T = temperatura R = costante universale dei gas

1. Legge di Boyle: p. V = costante per n e T costanti 2. Legge di Charles: V = cost T per n e p costanti Principio di Avogadro: V = cost n per p e Tcostanti Combinando questi leggi si ottiene l’equazione di stato dei gas ideali. Sono dette leggi limite perché valgono per tutti i gas reali allorchè la pressione è sufficientemente bassa da poter trascurare le interazioni tra le molecole (al limite per p che tende a zero).

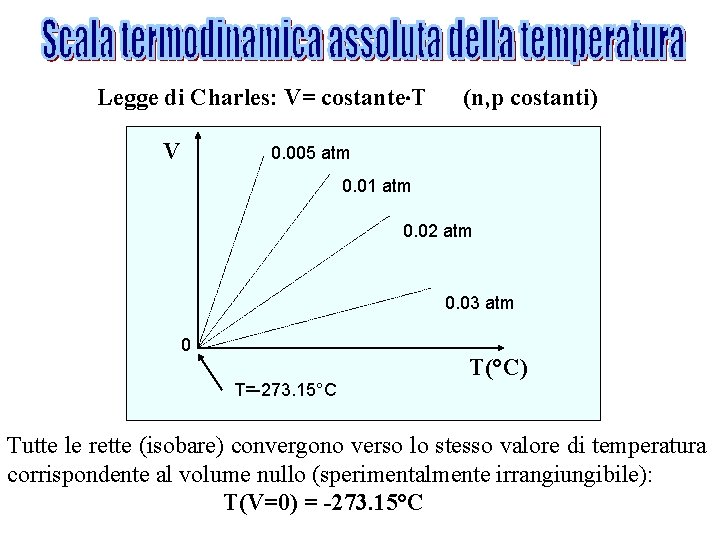
Legge di Charles: V= costante T V (n, p costanti) 0. 005 atm 0. 01 atm 0. 02 atm 0. 03 atm 0 T=-273. 15°C T(°C) Tutte le rette (isobare) convergono verso lo stesso valore di temperatura corrispondente al volume nullo (sperimentalmente irrangiungibile): T(V=0) = -273. 15°C

La scala Kelvin assume una scala lineare di temperature tra T = 0 K (zero assoluto -273. 15 °C) e T=273. 16 K (punto triplo del diagramma di fase dell’acqua 0. 01 °C). T(K) = T(°C) + 273. 15 Punto triplo = unico punto in cui coesistono le fasi solida, liquida e gassosa per l’H 2 O (T=273. 16 K, P=0. 0061173 bar). E’ detta scala assoluta delle temperature poiché tutte le sostanze si comportano come gas ideali al tendere a zero della pressione. In termodinamica si usa esclusivamente la scala assoluta delle temperature.

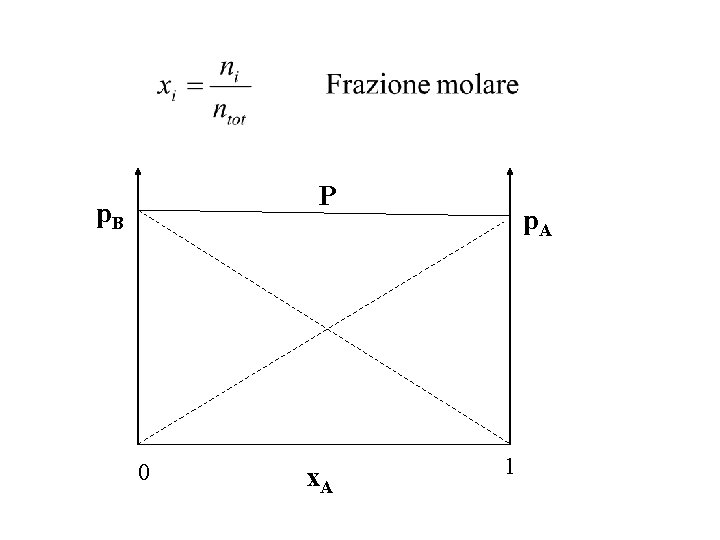
La pressione esercitata da una miscela di gas è data dalla somma delle pressioni parziali dei singoli componenti.

P p. B 0 x. A p. A 1

Condizioni normali: n = 1, p= 1 atm, T = 273. 16 K, V=22. 414 litri Equivalenza meccanica del calore (Mayer-Joule): 1 cal = 4. 184 J

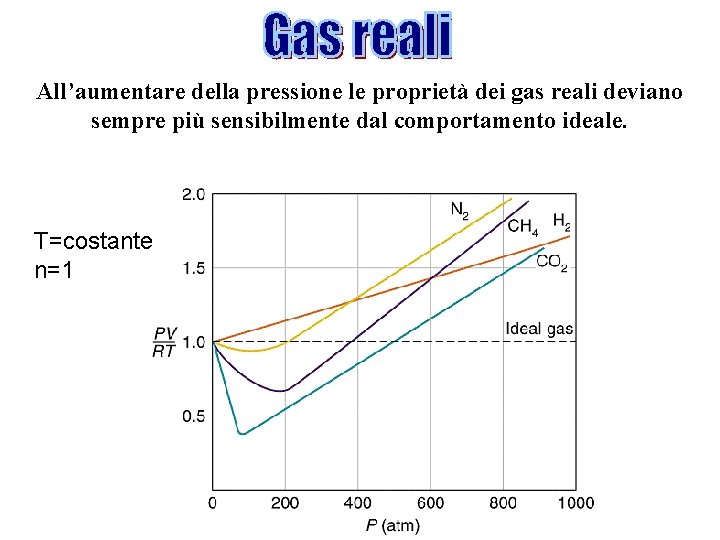
All’aumentare della pressione le proprietà dei gas reali deviano sempre più sensibilmente dal comportamento ideale. T=costante n=1

• Convertire 5 atm in Pa, bar, torr. • Un gas perfetto, in un recipiente a volume costante, ha pressione di 50. 2 torr alla temperatura di 273. 16 K. • Quale variazione di pressione è associata all’aumento di 1 K da questa temperatura? • Quale pressione corrisponde alla temperatura di 100 °C? • Quale variazione di pressione è associata all’aumento di 1 K da questa seconda temperatura? • Un recipiente di 22. 4 L contiene inizialmente 2 moli di idrogeno e 1 mole di azoto, a 273. 15 K. L’idrogeno reagisce completamente con l’azoto per dare ammoniaca. Calcolare la pressione parziale delle specie gassose presenti alla fine della reazione e la pressione totale della miscela finale.
 Schema distillazione frazionata
Schema distillazione frazionata Uftm a inducao eletrostatica consiste
Uftm a inducao eletrostatica consiste Neil jethani
Neil jethani Structura macroscopica a lemnului
Structura macroscopica a lemnului Dragos smeu
Dragos smeu Canale and swain's model of communicative competence
Canale and swain's model of communicative competence Mosfet kanal n
Mosfet kanal n Parete addominale anterolaterale
Parete addominale anterolaterale Michael canale linguist
Michael canale linguist Canale and swain communicative competence
Canale and swain communicative competence Canale de distributie
Canale de distributie Canale giovanni
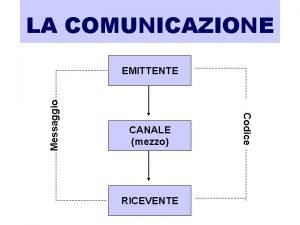
Canale giovanni Emittente ricevente canale codice
Emittente ricevente canale codice Strategia de distributie
Strategia de distributie Anticorpi anti-canale de potasiu voltaj-dependente
Anticorpi anti-canale de potasiu voltaj-dependente Vcanale di suez
Vcanale di suez Organisme autotrofe
Organisme autotrofe Esame icg
Esame icg Dây tơ hồng quấn quanh chuồng lợn
Dây tơ hồng quấn quanh chuồng lợn Gio internet
Gio internet Dưới tầm cánh chú bây giờ
Dưới tầm cánh chú bây giờ Cột đèn giao thông
Cột đèn giao thông A gio
A gio