La chimica di chimica A M O R













- Slides: 16

La chimica « di chimica È A M O R E V V A D ? ? Ì COS non ho mai capito nulla e vivo bene lo ste sso» « tutto quan to è chimico fa male alla salute» «la chimica non serve a niente se n inquinare» o na

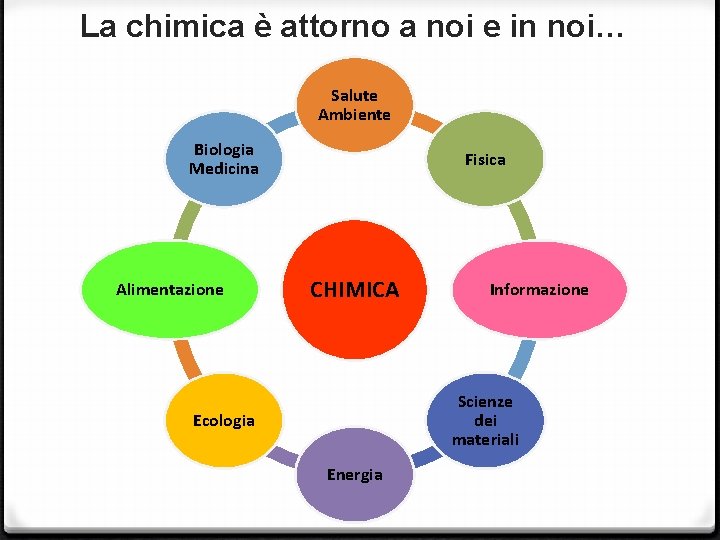
La chimica è attorno a noi e in noi… Salute Ambiente Biologia Medicina Alimentazione Fisica CHIMICA Informazione Scienze dei materiali Ecologia Energia

Ma di cosa è fatto il mondo? MOLECOLE ELEMENTI COMPOSTI ATOMO « Le molecole sono combinazioni di atomi come le parole sono combinazioni di lettere; quindi le molecole possono essere considerate come le parole della materia»

ATOMO

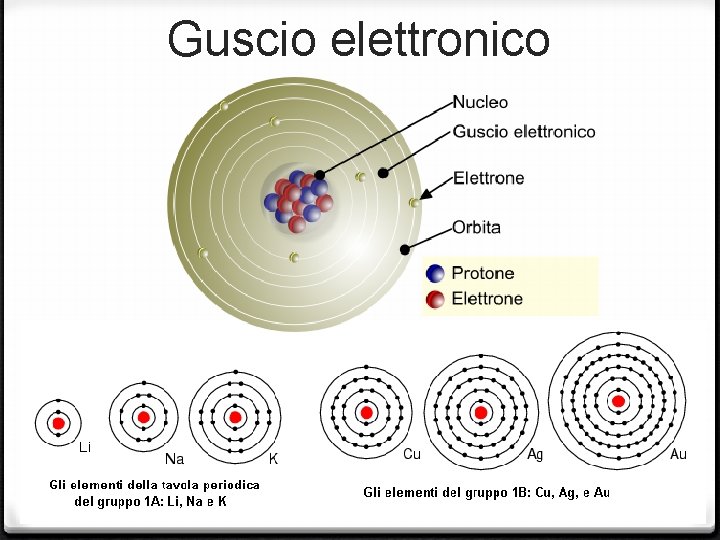
Guscio elettronico

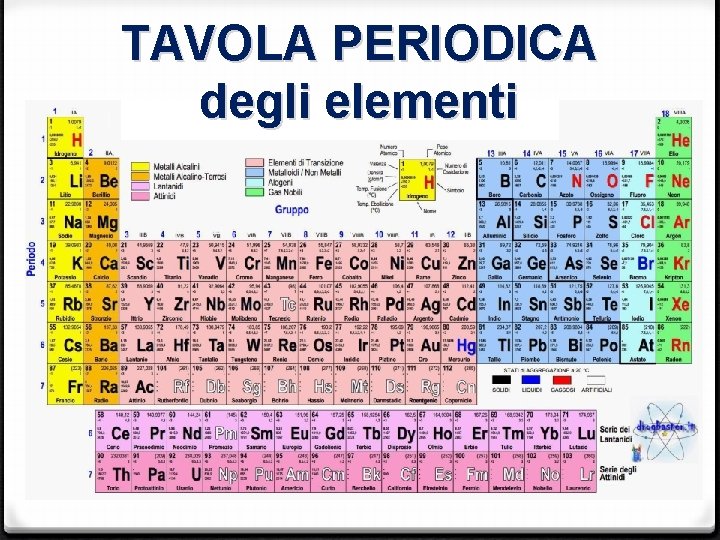
TAVOLA PERIODICA degli elementi

La “grammatica” delle molecole FORMULA CHIMICA indica quali e quanti atomi sono presenti in una molecola FORMULE GREZZE o BRUTE FORMULE di STRUTTURA Sono rappresentate dai simboli degli elementi chimici che costituiscono la sostanza Evidenziano bene i legami fra i vari atomi H 2 S 04

La regola dell’ottetto

LEGAMI CHIMICI “La proprietà più importante degli atomi è la loro capacità di “combinarsi” cioè di legarsi ad altri atomi, secondo leggi ben definite dalla natura, per formare molecole” LEGAME COVALENTE LEGAME IONICO LEGAME METALLICO

Legami COVALENTI si stabilisce quando gli atomi di una molecola condividono una o più coppie di elettroni del guscio esterno

REAZIONE CHIMICA trasformazione di una o più specie chimiche in altre specie I REAGENTI (atomi presenti nelle specie di partenza) si riordinano, cioè si legano fra loro in maniera diversa, in modo da formare nuove specie, i PRODOTTI. Per descrivere una reazione chimica si usano EQUAZIONI CHIMICHE, scritte utilizzando le formule dei composti. Tali equazioni danno informazioni di tipo: QUALITATIVO attraverso le formule chimiche dei reagenti e dei prodotti. QUANTITATIVO attraverso i numeri posti davanti ad ogni formula che servono per bilanciare le equazioni.

La reazione dell’acqua REAGENTI H 2 + O 2 PRODOTTI H 2 O NULLA SI CREA E NULLA SI DISTRUGGE!! S la em un rea bra z m ato ion che aè m e sia p o d sia dura pe oss i o sp nte rs ib ss ar i i o i ne le c gen to l n he o, ul si la?

Ma…perché si deve bilanciare? Ci deve essere un “pareggio”, cioè tutti gli atomi che sono a sinistra nella reazione, cioè fra i reagenti si devono ritrovare anche a destra perché in una reazione chimica la materia non può scomparire (LEGGE DELLA CONSERVAZIONE DELLA MASSA o LEGGE DI LAVOISIER) Quindi BILANCIARE significa calcolare opportuni coefficienti per i quali è necessario moltiplicare le formule delle specie chimiche partecipano alla reazione affinchè ogni elemento compaia a sinistra e a destra con il medesimo numero di atomi. Ma…. come si fa? 1) Si pareggiano inizialmente gli atomi degli elementi che compaiono in un numero minore di specie chimiche. 2) Bilanciato un elemento si modificherà anche qualche altro elemento che va subito bilanciato.

Ora…. esercitiamoci! Fe 2 (CO 3)3 + 6 HNO 3 2 Fe (NO 3)3 1. + 3 H 2 C 03 Bilanciamo il ferro: tra i reagenti vi sono due atomi di ferro mentre tra i prodotti uno solo quindi moltiplichiamo per 2 il nitrato ferrico ponendogli davanti un coefficiente 2. 2. Bilanciamo l’azoto: tra i reagenti vi è un solo atomo di azoto mentre tra i prodotti 6, quindi poniamo il coefficiente 6 davanti all’acido nitrico. Ferro e Azoto sono bilanciati. 3. Bilanciamo il carbonio: tra i reagenti vi sono tre atomi di carbonio e solo uno tra i prodotti, quindi poniamo il coefficiente 3 davanti all’acido carbonico. 4. Verifichiamo ora se H e 0 sono bilanciati: ci sono 6 atomi di idrogeno tra i reagenti e 6 fra i prodotti. Per l’ossigeno vi sono 27 atomi fra i reagenti e 27 tra i prodotti. l’equazione risulta BILANCIATA!!!

I PRINCIPALI COMPOSTI CHIMICI q OSSIDI = METALLO + OSSIGENO (reazione di ossidazione) 2 Cu + O 2 2 Cu. O = ossido di rame q ANIDRIDI = NON METALLO + OSSIGENO S + O 2 SO 2 = anidride solforosa q IDROSSIDI (o BASI) = OSSIDO + ACQUA Ca. O + H 2 O Ca (OH)2 = idrossido di calce q ACIDI = ANIDRIDE + ACQUA SO 2 + H 2 O q SALI = H 2 S 04 ACIDO + IDROSSIDO = SALE + ACQUA HCl + Na. OH Na. Cl + H 2 O = cloruro di sodio

IN BOCCA AL LUPO PER IL VOSTRO FUTURO!!
 Soluzioni capitolo 5 chimica piu
Soluzioni capitolo 5 chimica piu Ccfs unito
Ccfs unito Scopriamo la chimica zanichelli soluzioni esercizi
Scopriamo la chimica zanichelli soluzioni esercizi Metodi di separazione dei miscugli
Metodi di separazione dei miscugli Soluzioni sature
Soluzioni sature Soluzioni chimica piu capitolo 14
Soluzioni chimica piu capitolo 14 Filtro a pieghe chimica
Filtro a pieghe chimica Alluminio chimica
Alluminio chimica Chimica analitica ambientale
Chimica analitica ambientale Condensazione chimica
Condensazione chimica Calcolo stechiometrico
Calcolo stechiometrico Posca chimica soluzioni
Posca chimica soluzioni Schema atomo
Schema atomo Legami secondari chimica
Legami secondari chimica Principi di chimica moderna - tomo a soluzioni
Principi di chimica moderna - tomo a soluzioni Concentrazione molare
Concentrazione molare Valitutti soluzioni capitolo 14
Valitutti soluzioni capitolo 14