CHEMICK VLASTNOSTI ALKOHOL KYSELOST I EFEKT ALKYLU POTLAUJE













- Slides: 15

CHEMICKÉ VLASTNOSTI ALKOHOLŮ KYSELOST +I EFEKT ALKYLU POTLAČUJE DISOCIACI - OH SKUPINY → KYSELOST SE SNIŽUJE, ALKOHOLY JSOU SLABŠÍ KYSELINY NEŽ VODA TVORBA SOLÍ - ALKOHOLÁTŮ: R - OH + Na. OH → netvoří se R - OH + Na R - O-Na+ alkoholát sodný + 1/2 H 2 → TVORBA ESTERŮ - ESTERIFIKACE kyselina + alkohol → ester + H 2 O REAKCE PROBÍHÁ S ORGANICKÝMI I MINERÁLNÍMI KYSELINAMI ODLIŠNÁ TVORBA VODY → ZJIŠTĚNO POMOCÍ SLOUČENIN OBSAHUJÍCÍCH IZOTOP 18 O

ESTERIFIKACE S MINERÁLNÍMI KYSELINAMI GLYCEROL A KYSELINA DUSIČNÁ → TRINITRÁT GLYCEROLU NITROGLYCERIN, VÝBUŠNINA POUŽITÍ: DYNAMIT NEPLÉST NITRÁTY (ESTERY) A NITROSLOUČENINY!!! REESTERIFIKACE VÝROBA BIONAFTY

DEHYDRATACE ALKOHOLŮ PROBÍHÁ VLIVEM DEHYDRATAČNÍCH ČINIDEL (H 2 SO 4, H 3 PO 4, P 2 O 5) PRŮBĚH PODLE ZAJCEVOVA PRAVIDLA SNADNOST DEHYDRATACE TERCIÁRNÍ → SEKUNDÁRNÍ → PRIMÁRNÍ ALKOHOLY DEHYDRATACÍ (= ELIMINAČNÍ REAKCÍ) VZNIKÁ NENASYCENÁ VAZBA POKUD VZNIKNE NESTABILNÍ STRUKTURA, NAPŘ. ENOLOVÁ, MOLEKULA SE STABILIZUJE PŘESMYKEM DEHYDRATACE GLYCEROLU

DEHYDROGENACE = ODŠTĚPENÍ VODÍKU KATALYTICKÁ REAKCE 1) katalyzátor Ni, Pt, vysoký tlak (150 atm) 2) enzymová dehydrogenace DEHYDROGENACE PROBÍHÁ POUZE U PRIMÁRNÍCH A SEKUNDÁRNÍCH ALKOHOLŮ: PRIMÁRNÍ ALKOHOLY → ALDEHYDY SEKUNDÁRNÍ ALKOHOLY → KETONY TERCIÁRNÍ ALKOHOLY ZA TĚCHTO PODMÍNEK ODŠTĚPUJÍ VODU = DEHYDRATUJÍ TERCIÁRNÍ ALKOHOLY → NENASYCENÁ SLOUČENINA

OXIDACE ZA RŮZNÝCH PODMÍNEK: MÍRNÁ NEBO ENERGICKÁ MÍRNÁ OXIDACE: PRIMÁRNÍ ALKOHOL → MONOTOPICKÝ DIOL → ALDEHYD SEKUNDÁRNÍ ALKOHOL →MONOTOPICKÝ DIOL → KETON TERCIÁRNÍ ALKOHOL → reakce neprobíhá VZNIKLÉ ALDEHYDY MOHOU OXIDOVAT AŽ NA KYSELINY ENERGICKÁ OXIDACE: OXIDAČNÍ ŠTEPENÍ MOLEKULY ZA VZNIKU SMĚSI KYSELIN TAKTO PROBÍHÁ U VŠECH TYPŮ ALKOHOLŮ, ZEJMÉNA SEKUNDÁRNÍCH A TERCIÁRNÍCH

FENOLY Ar - OH BENZENOL - FENOL BENZENDIOLY - PYROKATECHOL, RESORCINOL, HYDROCHINON VLASTNOSTI: TUHÉ LÁTKY - VYTVÁŘEJÍ H-MŮSTKY A MAJÍ VYSOKOU MOLEKULOVOU HMOTNOST ROZPUSTNOST VE VODĚ KLESÁ S MOLEKULOVOU HMOTNOSTÍ A ROSTE S POČTEM OH-SKUPIN ROZPUSTNOST V NEPOLÁRNÍCH ROZPOUŠTĚDLECH MÁ OPAČNÝ TREND KYSELOST: -I EFEKT ZESILUJE KYSELOST → JSOU KYSELEJŠÍ NEŽ ALKOHOLY Ar - OH + Na-OH → Ar - O-Na+ fenolát sodný

BIOLOGICKÉ VLASTNOSTI FENOLŮ FENOL: LEPTAVÝ, JEDOVATÝ BYL POUŽIT JAKO PRVNÍ DESINFEKCE (Joseph Lister, anglický chirurg, 19. století) FENOLOVÝ EKVIVALENT NÁSOBEK ÚČINNOSTI DESINFEKCE VE SROVNÁNÍ S ÚČINNOSTÍ FENOLU SOUČASNÉ DESINFEKCE: 40 - 50 x ÚČINNĚJŠÍ JEDOVATOST KLESÁ S POČTEM OH SKUPIN LYSOL: ROZTOK FENOLU S MÝDLEM KRESOL: METHYLFENOLY (o-, m-, p-) HRUBÁ DESINFEKCE

CHEMICKÉ VLASTNOSTI FENOLŮ OXIDOVATELNOST CHINONY: 1, 2 -BENZENDIOL A 1, 4 -BENZENDIOL ZACHOVÁNA KONJUGACE DVOJNÝCH VAZEB 1, 3 -BENZENDIOL NEOXIDUJE TVORBA BAREVNÝCH KOMPLEXŮ KYS. SALYCILOVÁ + Fe 3+ → FIALOVÉ ZBARVENÍ (LABORKY!!!) PŘÍRODNÍ FENOLY (TANIN) + Fe 3+ → BAREVNÉ SLOUČENINY, ZBARVENÍ RŮZNÉ PODLE POČTU A POLOHY OH SKUPINY → INKOUST např. DUBĚNKOVÝ INKOUST

VÝROBA A POUŽITÍ FENOLU 1) IZOLACE Z ČERNOUHELNÉHO NEBO HNĚDOUHELNÉHO DEHTU 2) KUMENOVÁ SYNTÉZA ALKYLACE BENZENU PROPENEM (SE) NA KUMEN, OXIDACE A ROZKLAD KUMENU, VZNIKÁ FENOL A ACETON POUŽITÍ FENOLU: VÝROBA PLASTŮ FENOL-FORMALDEHYDOVÉ PRYSKYŘICE - FENOPLASTY BAKELIT, ELEKTROSOUČÁSTKY - OBJÍMKY, VYPÍNAČE MOČOVINO-FORMALDEHYDOVÉ PRASKYŘICE - AMINOPLASTY IZOLAČNÍ A NÁTĚROVÉ HMOTY, KELÍMKY EPOXIDOVÉ PRYSKYŘICE LAKY, LEPIDLA

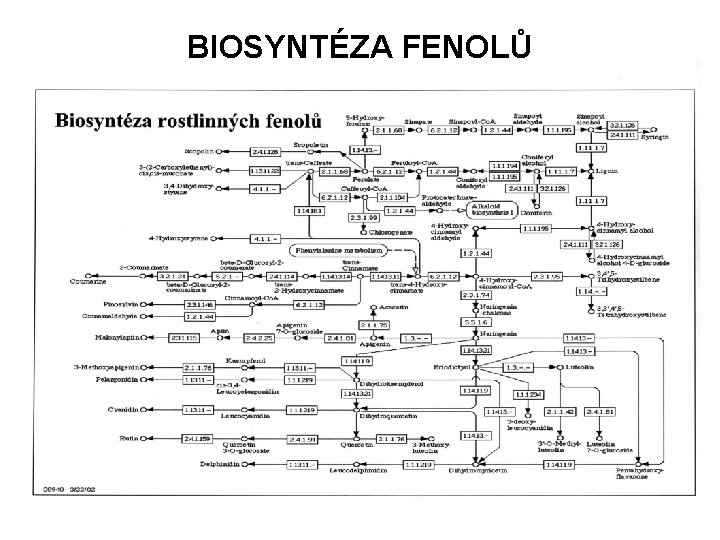
PŘÍRODNÍ POLYFENOLY PŘÍRODNÍ LÁTKY VÝHRADNĚ ROSTLINNÉHO PŮVODU PATŘÍ MEZI TZV. SEKUNDÁRNÍ METABOLITY ZATÍM OBJEVENO A IDENTIFIKOVÁNO NĚKOLIK TISÍC ZÁSTUPCŮ STRUKTURA: DERIVÁTY KYS. BENZOOVÉ DERIVÁTY KYS. SKOŘICOVÉ A ODVOZENÉ FENYLPROPANOIDY (struktura C 6 -C 3) 17 SKUPIN RŮZNÝCH STRUKTUR V BIOLOGICKÉM MATERIÁLU SE VYSKYTUJÍ VOLNĚ NEBO VE VAZBĚ NA SACHARIDY JAKO GLYKOSIDY (větší rozpustnost ve vodě) VLASTNOSTI: ANTIOXIDANTY - OXIDACE NA CHINONY - OCHRANA CITLIVÝCH SLOUČENIN (vit. C, nenasycení mastné kyseliny, DNA) PROTI OXIDACI

BIOSYNTÉZA FENOLŮ

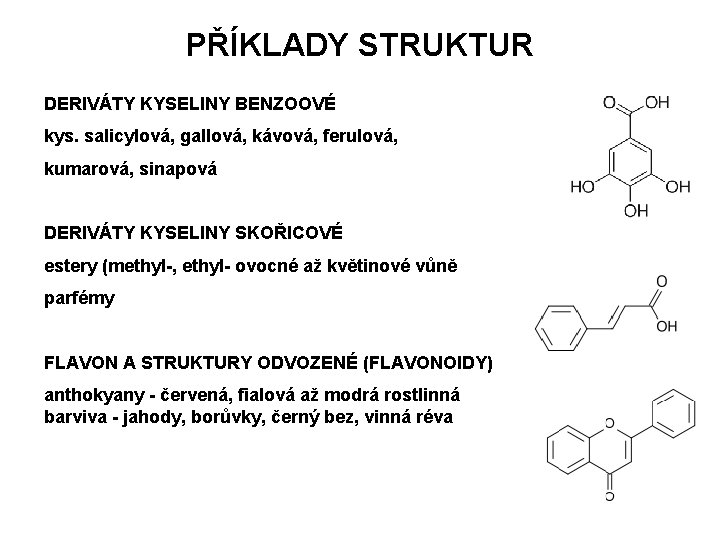
PŘÍKLADY STRUKTUR DERIVÁTY KYSELINY BENZOOVÉ kys. salicylová, gallová, kávová, ferulová, kumarová, sinapová DERIVÁTY KYSELINY SKOŘICOVÉ estery (methyl-, ethyl- ovocné až květinové vůně parfémy FLAVON A STRUKTURY ODVOZENÉ (FLAVONOIDY) anthokyany - červená, fialová až modrá rostlinná barviva - jahody, borůvky, černý bez, vinná réva

VÝZNAM POLYFENOLŮ 1) ŽLUTÁ BARVIVA - ATRAKTANTY - KVĚTY, PLODY, KŮRA, DŘEVO (DUB) 2) FYTOALEXINY - ROSTLINNÉ OBRANNÉ LÁTKY PROTI MIKROBIÁLNÍM PATOGENŮM 3) ALLELOCHEMIKÁLIE - LÁTKY FUNGUJÍCÍ V KONKURENČNÍM BOJI ROSTLINNÝCH DRUHŮ 4) FYTOINSEKTICIDY - LÁTKY PŮSOBÍCÍ PROTI HERBIVORNÍMU HMYZU 5) ANTIOXIDANTY - VÝZNAM PRODUCENTA I PRO KONZUMENTA (tedy i pro člověka), brání oxidaci krevních lipidů (LDL), prevence onemocnění srdce (infarkt) a cév (mrtvice, atheroskleróza), pravděpodobně působí proti rozvoji rakovinového bujení

ETHERY PATŘÍ MEZI HYDROXYSLOUČENINY R 1 - O - R 1 SYMETRICKÉ ETHERY Ar - O - R NESYMETRICKÉ ETHERY VLASTNOSTI: NEVYTVÁŘÍ H-MŮSTKY → NIŽŠÍ TEPLOTY VARU VYSOKÁ TĚKAVOST NÍZKÁ ROZPUSTNOST VE VODĚ TV(ETHANOL) = 78, 5°C, TV (DIMETHYLETHER) = -24, 9°C BIOLOGICKÉ ÚČINKY: DIETHYLETHER - PÁRY VE VZDUCHU (4%) VYVOLÁVAJÍ NARKÓZU VYŠŠÍ KONCENTRACE ZPŮSOBUJÍ OTRAVU AŽ SMRT POUŽITÍ: VYNIKAJÍCÍ NEPOLÁRNÍ ROZPOUŠTĚDLO

SYNTÉZA ETHERŮ NESYMETRICKÉ ETHERY (WILLIAMSONOVA SYNTÉZA) R 1 - ONa + R 2 - X → R 1 - O - R 2 + Na - X SYMETRICKÉ ETHERY R - OH + OH - R → R - O - R+ H 2 O INTERMOLEKULÁRNÍ DEHYDRATACE DEHYDRATAČNÍ ČINIDLO: H 2 SO 4 , KONTROLOVANÉ TECHNOLOGICKÉ PODMÍNKY (TEPLOTA) DIETHYLETHER TVOŘÍ PŘI SKLADOVÁNÍ NA SVĚTLE VÝBUŠNÉ PEROXIDY! → SKLADOVAT V TMAVÉ LAHVI
 Kresol
Kresol Os vzorec
Os vzorec Adriana chemick
Adriana chemick Adriana chemick
Adriana chemick Adriana chemick
Adriana chemick Vzorce hydroxidov
Vzorce hydroxidov Adriana chemick
Adriana chemick Al-kuhl definition
Al-kuhl definition Oxigéntartalmú szerves vegyületek csoportosítása
Oxigéntartalmú szerves vegyületek csoportosítása Semaglutyd tabletki cena
Semaglutyd tabletki cena Alkohol felszívódása
Alkohol felszívódása Ethanal zu ethansäure
Ethanal zu ethansäure Zellgift alkohol
Zellgift alkohol Endokrin akademiska
Endokrin akademiska Kesimpulan penyalahgunaan bahan
Kesimpulan penyalahgunaan bahan Vistula alkohol
Vistula alkohol