CHEMICK REAKCE Mgr Petra Vojtkov Mgr Irena Pluckov








- Slides: 17

CHEMICKÉ REAKCE © Mgr. Petra Vojtěšková, Mgr. Irena Plucková, Ph. D.

CHEMICKÁ REAKCE �Je děj, při kterém z výchozích chemických látek (reaktantů) vznikají jiné chemické látky (produkty).

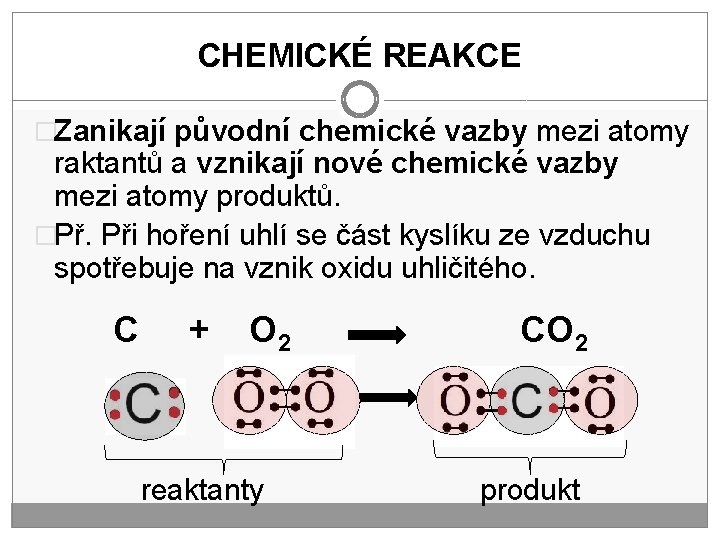
CHEMICKÉ REAKCE �Zanikají původní chemické vazby mezi atomy raktantů a vznikají nové chemické vazby mezi atomy produktů. �Př. Při hoření uhlí se část kyslíku ze vzduchu spotřebuje na vznik oxidu uhličitého. C + O 2 reaktanty CO 2 produkt

CHEMICKÉ REAKCE � � Hoření je děj, při kterém se uvolňuje světelná a tepelná energie. �Reakce tedy můžeme rozdělit na: 1) exotermické – reakce, při které se teplo uvolňuje (např. hoření) 2) endotermické – reakce, při které se teplo spotřebovává (např. tepelnýrozklad vápence)

CHEMICKÉ REAKCE Průběh chemických reakcí ovlivňují reakční podmínky: teplota tlak katalyzátor

ZÁKON ZACHOVÁNÍ HMOTNOSTI Objeven v 18. století ruským přírodovědcem M. V. Lomonosovem a francouzským vědcem A. L. Lavoisierem. �Při chemických reakcích vznikají z výchozích látek látky jiné. �Pro hmotnost chemických látek před reakcí a po ní platí zákon zachování hmotnosti.

ZÁKON ZACHOVÁNÍ HMOTNOSTI Hmotnost chemických látek před reakcí je stejná jako hmotnost chemických látek po reakci. Platí v uzavřené soustavě.

CHEMICKÁ ROVNICE �Používá se pro zápis chemické reakce. �Je vyjádřená značkami a vzorci chemických látek. �Rovnice jsou zapisovány ustáleným zápisem: reaktanty uhlík + kyslík C + O 2 produkty oxid uhličitý CO 2

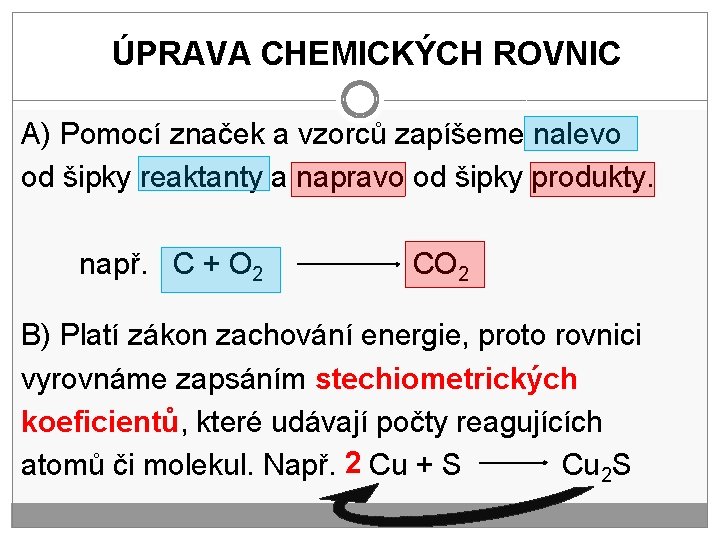
ÚPRAVA CHEMICKÝCH ROVNIC A) Pomocí značek a vzorců zapíšeme nalevo od šipky reaktanty a napravo od šipky produkty. např. C + O 2 CO 2 B) Platí zákon zachování energie, proto rovnici vyrovnáme zapsáním stechiometrických koeficientů, které udávají počty reagujících atomů či molekul. Např. 2 Cu + S Cu 2 S

ÚPRAVA CHEMICKÝCH ROVNIC �Příklad: Zapište chemickou rovnicí rozklad vody, jejímiž produkty jsou vodík a kyslík, které tvoří dvouatomové molekuly. � 1) Zapíšeme reaktanty a produkty. H 2 O H 2 + O 2

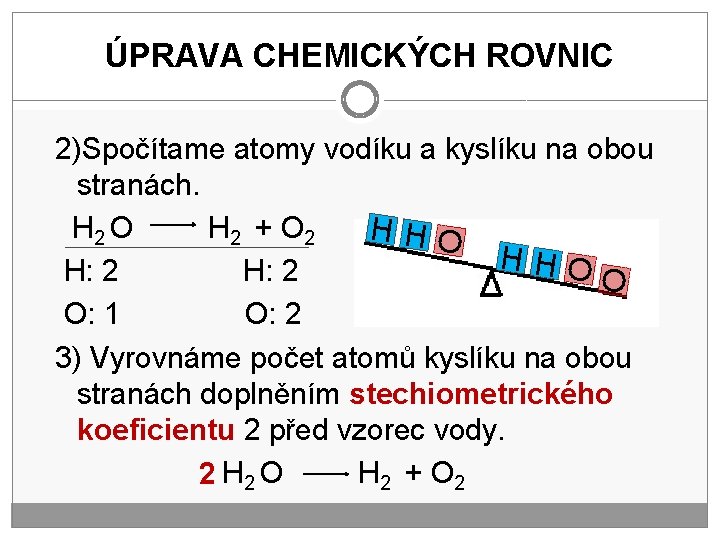
ÚPRAVA CHEMICKÝCH ROVNIC 2)Spočítame atomy vodíku a kyslíku na obou stranách. H 2 O H 2 + O 2 HHO H: 2 O O: 1 O: 2 3) Vyrovnáme počet atomů kyslíku na obou stranách doplněním stechiometrického koeficientu 2 před vzorec vody. H 2 + O 2 2 H 2 O

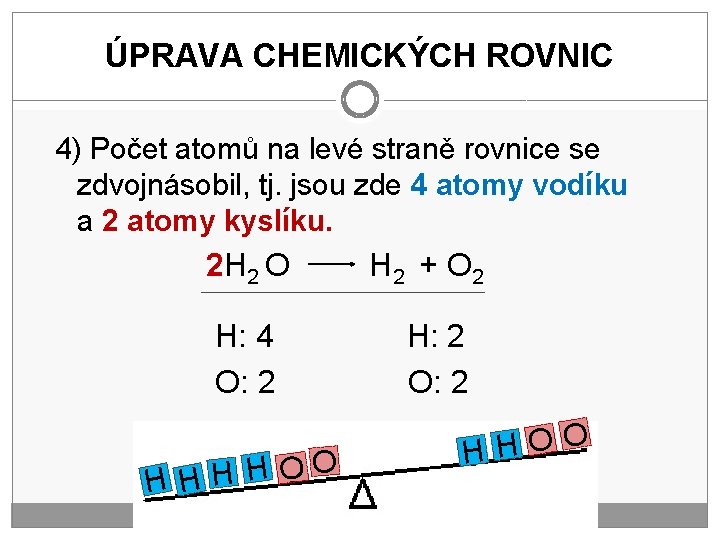
ÚPRAVA CHEMICKÝCH ROVNIC 4) Počet atomů na levé straně rovnice se zdvojnásobil, tj. jsou zde 4 atomy vodíku a 2 atomy kyslíku. 2 H 2 O H: 4 O: 2 O H HH H 2 + O 2 H: 2 O O H H

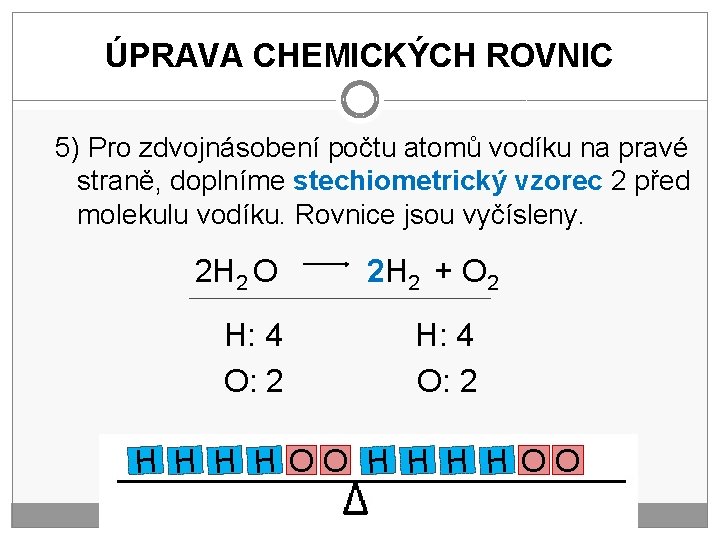
ÚPRAVA CHEMICKÝCH ROVNIC 5) Pro zdvojnásobení počtu atomů vodíku na pravé straně, doplníme stechiometrický vzorec 2 před molekulu vodíku. Rovnice jsou vyčísleny. 2 H 2 O H: 4 O: 2 2 H 2 + O 2 H: 4 O: 2 H H H H OO

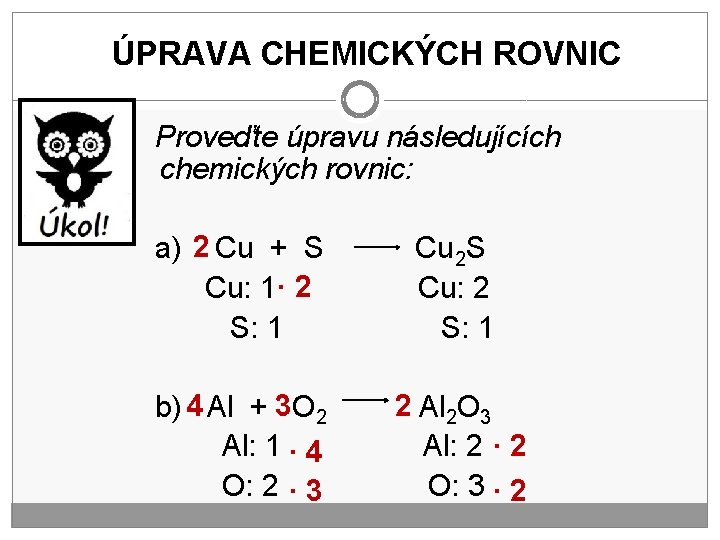
ÚPRAVA CHEMICKÝCH ROVNIC Proveďte úpravu následujících chemických rovnic: a) 2 Cu + S Cu: 1· 2 S: 1 Cu 2 S Cu: 2 S: 1 b) 4 Al + 3 O 2 Al: 1 · 4 O: 2 · 3 2 Al 2 O 3 Al: 2 · 2 O: 3 · 2

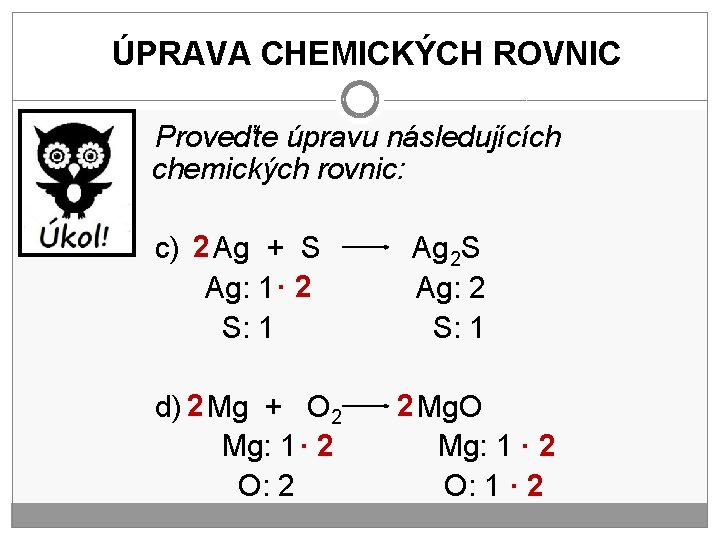
ÚPRAVA CHEMICKÝCH ROVNIC Proveďte úpravu následujících chemických rovnic: c) 2 Ag + S Ag: 1 · 2 S: 1 d) 2 Mg + O 2 Mg: 1 · 2 O: 2 Ag 2 S Ag: 2 S: 1 2 Mg. O Mg: 1 · 2 O: 1 · 2

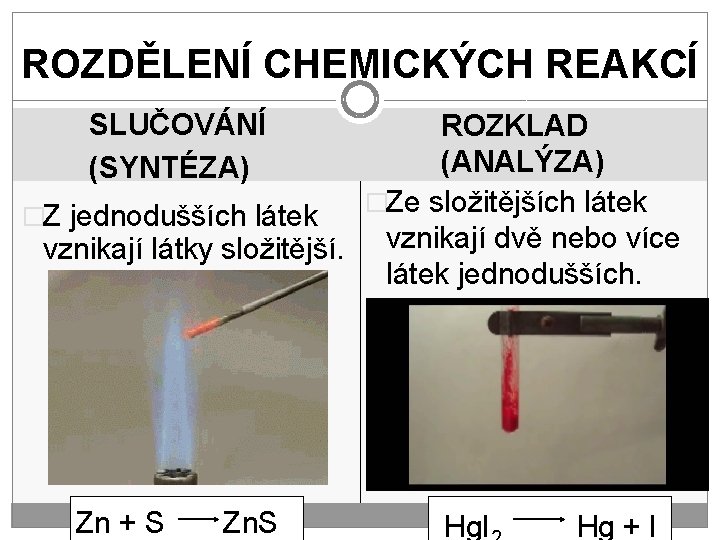
ROZDĚLENÍ CHEMICKÝCH REAKCÍ SLUČOVÁNÍ (SYNTÉZA) ROZKLAD (ANALÝZA) �Ze složitějších látek �Z jednodušších látek vznikají látky složitější. vznikají dvě nebo více látek jednodušších. Zn + S Zn. S Hg. I Hg + I

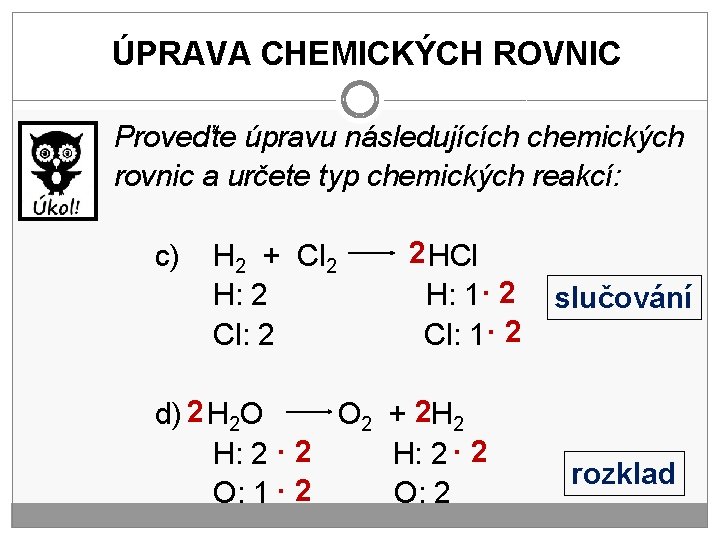
ÚPRAVA CHEMICKÝCH ROVNIC Proveďte úpravu následujících chemických rovnic a určete typ chemických reakcí: c) H 2 + Cl 2 H: 2 Cl: 2 2 HCl H: 1· 2 Cl: 1· 2 d) 2 H 2 O O 2 + 2 H 2 H: 2 · 2 O: 1 · 2 O: 2 slučování rozklad
 Mgr. petra hovězáková
Mgr. petra hovězáková Adriana chemick
Adriana chemick Kyselina manganistá vzorec
Kyselina manganistá vzorec Adriana chemick
Adriana chemick Hydroxidy vzorce
Hydroxidy vzorce Adriana chemick
Adriana chemick Adriana chemick
Adriana chemick Irena horek
Irena horek Nedelea irena
Nedelea irena Irena sendler biografia
Irena sendler biografia Irena sendlerowa życiorys
Irena sendlerowa życiorys Irena fabek
Irena fabek Irena nančovska šerbec
Irena nančovska šerbec Irena 2015
Irena 2015 Parafraziranje
Parafraziranje Ljudska pravljica trap
Ljudska pravljica trap Vita benko
Vita benko Maria jose hansen
Maria jose hansen