Chapitre n 1 corps purs et mlanges I




































- Slides: 47

Chapitre n° 1 corps purs et mélanges

I) corps pur et mélange 1) définition Un corps pur n’est constitué que d’une seule espèce chimique Un corps composé est constitué de plusieurs espèces chimiques

Exemple L’air est un corps composé car il contient du dioxygène et du diazote la vapeur d’eau est un corps pur car elle ne contient que des molécules d’eau


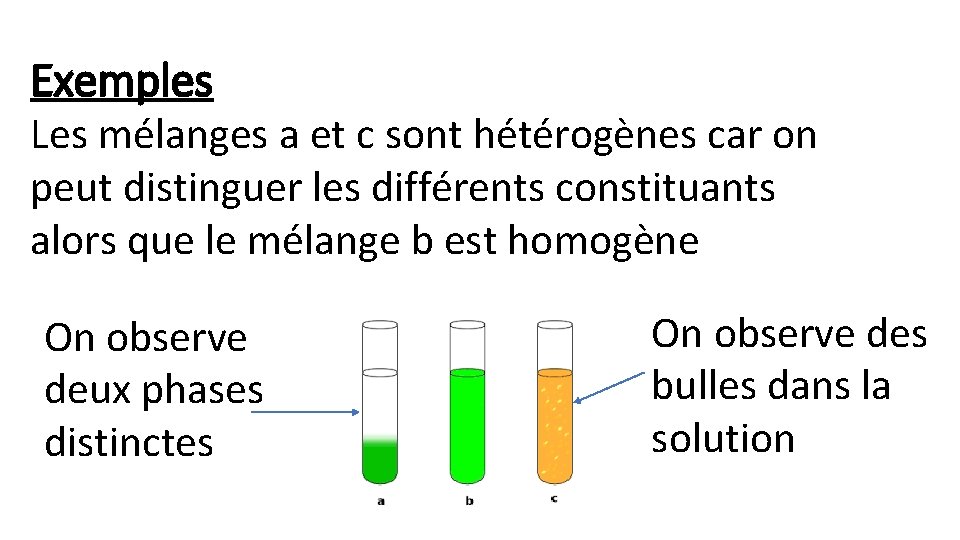
2) Mélange homogène et hétérogène • Un mélange est homogène si on ne peut pas distinguer ses différents constituants. • Un mélange est hétérogène si on peut distinguer ses différents constituants.

Exemples Les mélanges a et c sont hétérogènes car on peut distinguer les différents constituants alors que le mélange b est homogène On observe deux phases distinctes On observe des bulles dans la solution

3) Composition massique a) définition • La composition massique d’un mélange donne le rapport de la masse de chacun de ses constituants sur la masse totale. Ces rapports sont sans unité et peuvent être exprimés en pourcentage. • Exemple pour un composant X • Pm (X)=m. X/m. T

b) Exercice Une pièce de laiton contient en pourcentage 30% de zinc et 70% de cuivre. Quelles sont les masses respectives de ses deux constituants si sa masse est de 50 g? On applique la relation Pm (Zn)=m. Zn/m. T On en déduit la masse de zinc que: m. Zn= Pm (Zn). m. T=0, 3. 50=15 g (30% correspond à 0, 3) On en déduit également la masse de cuivre : m. Cu= Pm (Cu). m. T=0, 7. 50=35 g(70% correspond à 0, 7)

4) L a composition volumique A)Définition • La composition volumique d’un mélange Pvolumique donne le rapport du volume de chacun de ses constituants sur le volume total, ces rapports peuvent être exprimés en pourcentage. • Exemple pour un composant X de masse m. X dans un mélange de masse m. T • PV (X)=VX/VT

b) exercice • Une solution alcoolique a un volume de 50 m. L elle contient 50% d’éthanol et 50% d’eau. Quels sont les volumes respectifs de ces deux liquides ? • On applique la relation PV (eau)=Veau/VT • On en déduit le volume d’eau: • Veau= PV (eau). VT=0, 5. 50=25 m. L • On en déduit le volume d’éthanol: • Véthanol= PV (éthanol). VT=0, 5. 50=25 m. L

II identification d’espèces chimiques • 1) identification par des grandeurs physiques • A) principe • Pour identifier une espèce chimique on compare ses propriétés physiques avec celles d’espèces chimiques connues.

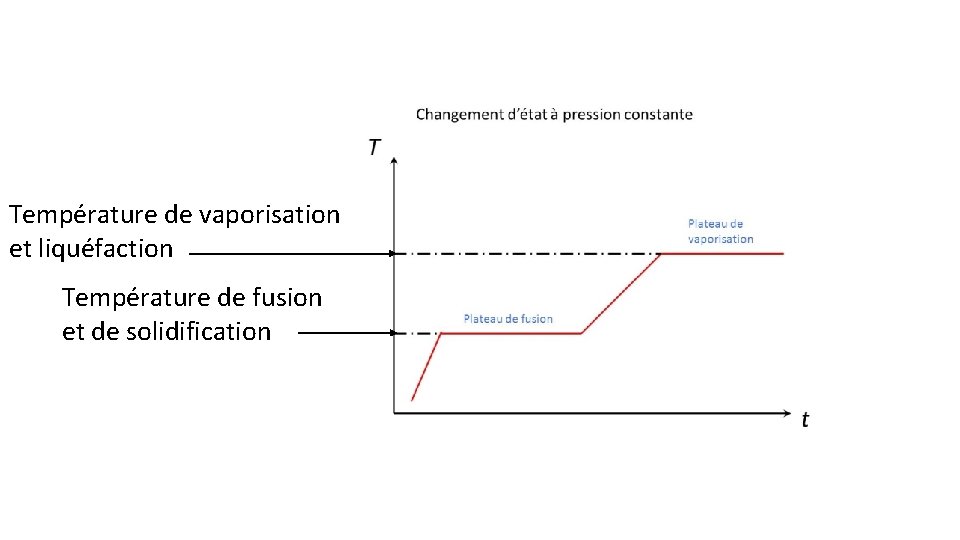
B) température de changement d’état • Pour un corps pur lors d’un changement d’état la température reste constante et est caractéristique pour ce corps pur n io ct fa C ué s en d on liq n io at

Température de vaporisation et liquéfaction Température de fusion et de solidification

c) Masse volumique • La masse volumique d’un corps ρ(kg/m 3 ) ou (Kg. m-3) est le rapport de sa masse m(Kg) sur le volume V(m 3) qu’il occupe • On a relation: ρ =m/V • Cette masse volumique est une caractéristique de ce corps pur. • On peut également l’exprimer en (g/L) ou (g. L-1) • ou en (g/m. L) ou (g. m. L-1)

d) Densité • La densité d’un corps d A est le rapport de sa masse volumique sur celle de l’eau • d. A= ρA/ ρeau • Si la densité d’un corps est supérieure à l’unité il coule sinon il flotte

e) Exercice • Donner la composition massique du mélange de 50% d’eau et 50% d’éthanol en volume si ρéthanol =789 g/L et ρeau =1000 g/L • On a 25 m. L d’éthanol et 25 m. L d’eau • On applique la relation ρ =m/V, on en déduit m= ρ. V • Les applications numériques donnent • méthanol = ρéthanol. Véthanol=789. 0, 025=19, 725 g • meau = ρeau. Veau=1000. 0, 025=25 g • On en déduit PM(éthanol)=19, 725/(19, 725+25)=0, 44 soit 44% • On en déduit PM(eau)=25/(19, 725+25)=0, 56 soit 56%

2) identification par des tests chimique • A) principe • Certaines espèces chimiques peuvent être identifiées par des tests chimiques

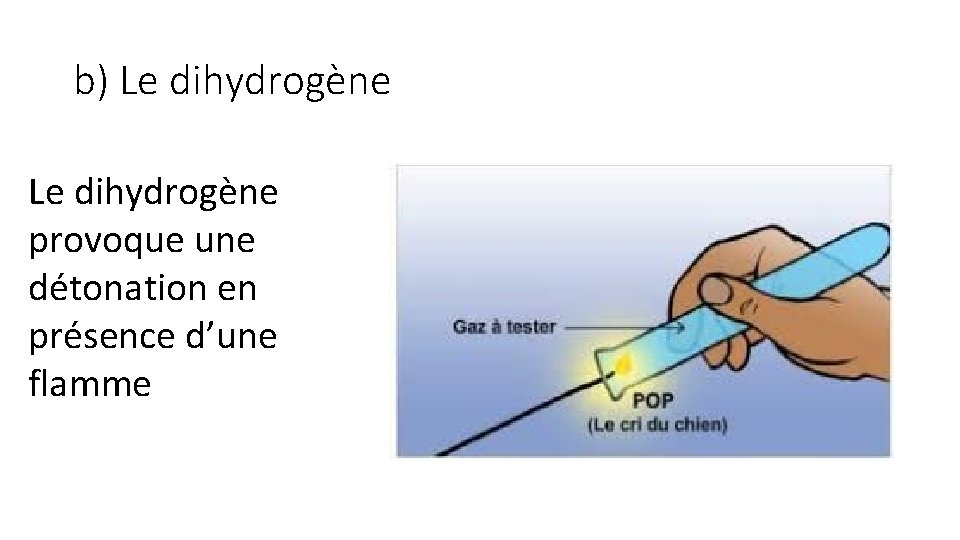
b) Le dihydrogène provoque une détonation en présence d’une flamme

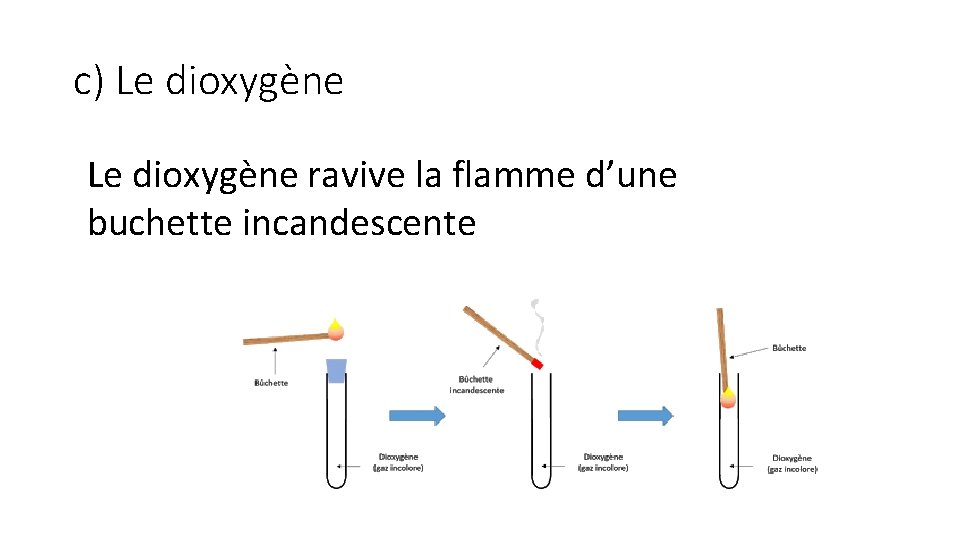
c) Le dioxygène ravive la flamme d’une buchette incandescente

d) Le dioxyde de carbone trouble de l’eau de chaux

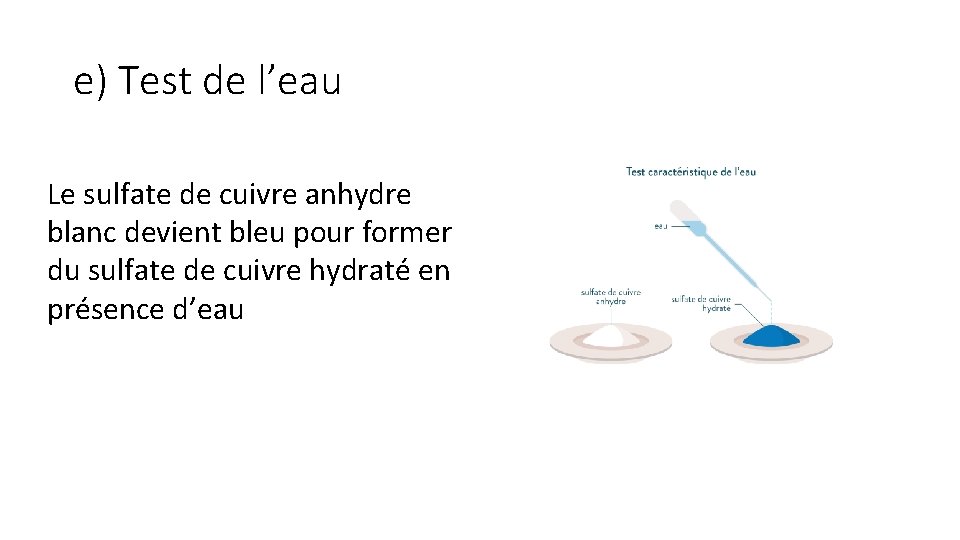
e) Test de l’eau Le sulfate de cuivre anhydre blanc devient bleu pour former du sulfate de cuivre hydraté en présence d’eau

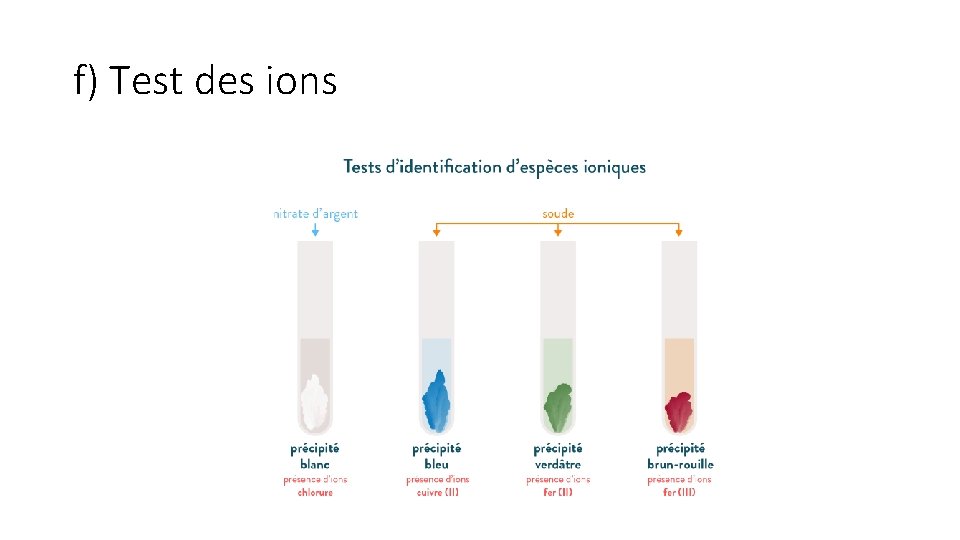
f) Test des ions

• Exercice 3 au 11 pages 24 et 25

Exercice n° 3 L’eau du robinet n’est pas un corps pur car elle contient des ions dissouts qui formes du calcaire sur la robinetterie

Exercice n° 4 L’eau minérale est « équilibrée en minéraux » c’est quelle contient des minéraux dissouts qui sont utiles à son goût, ce n’est pas un corps pur mais un mélange et le slogan est contradictoire

Exercice n° 5 1)Le mélange avant et après agitation des trois liquides est hétérogène car il forme trois phases distinctes avant mélange et deux phases distinctes après mélange 2) La phase du dessous après mélange contient l’alcool et le vinaigre

Exercice n° 6 1) Le mélange (a) est un liquide trouble, la peinture acrylique n’est pas soluble dans l’eau. Le mélange(b) contient deux phases bien distinctes et les liquides sont non miscibles 2) Visiblement aucune des deux peintures n’est soluble dans l’eau mais la peinture acrylique peut être dispersée par l’eau.

Exercice n° 7 Pour le glucose: On applique la relation: Pglucose= mglucose/mtotale On en déduit: mglucose= Pglucose. Mtotale L’application numérique donne: mglucose=0, 025. 250=6, 25 g Pour le chlorure de Sodium m. Chlorure de sodium =0, 045. 250=1, 125 g

Exercice n° 8 1) A est un corps pur car lors de son changement d’état sa température reste constante B est un mélange car lors de son changement d’état sa température ne reste pas constante 2) A est dans l’état liquide B peut être soit dans l’état solide ou dans un état solide + liquide.

Exercice n° 9 A 20°C nous sommes au dessus de la température de fusion du mercure et en dessous de celle de l’argent Le liquide sur la photographie est donc du mercure

Exercice n° 10 Si on divise 7, 8 par un nombre plus grand que 1; soit 1, 1; alors le résultat sera plus petit que 7, 8 et non plus grand. Donc 7, 9 g. m. L-1 n’est pas la masse volumique de cette pièce.

Exercice n° 11 La masse du dichlorométhane est de mdichloro=128, 7 -61, 5=67, 2 g Sa masse volumique est donc ρdichloro= mdichloro/ Vdichloro=1, 35 g. m. L-1 Sa densité est donc de ddichloro= ρdichloro/ ρeau=1, 35

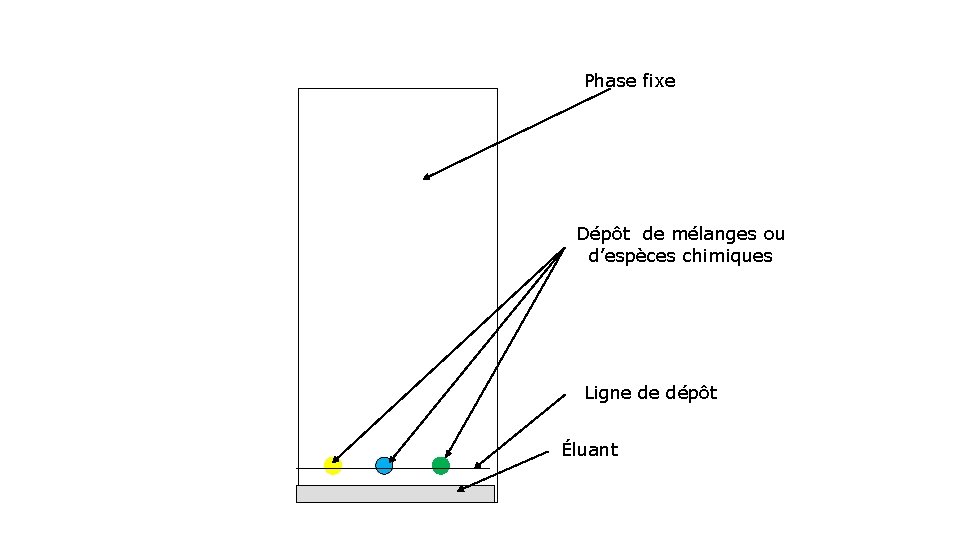
3)Chromatographie a)Principe La chromatographie est une technique de séparation et d’identification des constituants d’un mélange homogène. b) Protocole Les différents mélanges sont déposés sur une plaque appelée phase fixe. Un solvant (appelé éluant) monte sur cette phase fixe et emporte plus ou moins loin les constituants du mélange selon leur solubilité.

Phase fixe Dépôt de mélanges ou d’espèces chimiques Ligne de dépôt Éluant

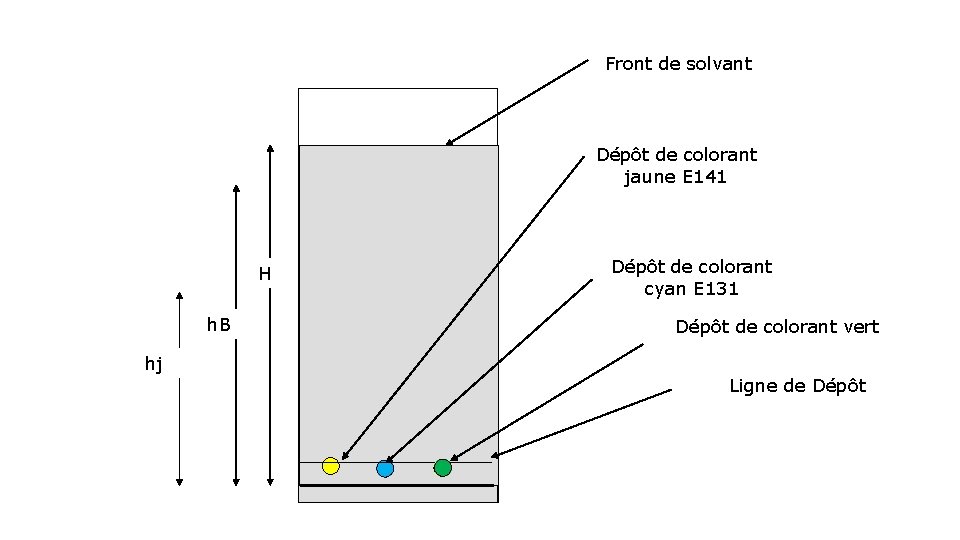
Front de solvant Dépôt de colorant jaune E 141 H h. B hj Dépôt de colorant cyan E 131 Dépôt de colorant vert Ligne de Dépôt

c) Identification Le rapport frontal est défini pour une espèce chimique avec une phase fixe et un éluant donnés. Il correspond au rapport de la hauteur de migration de cette espèce chimique sur la hauteur du front de solvant R=h/H

d) Exercice Déterminer les rapports frontaux des colorants E 131 et E 141 Quelle est la composition du colorant vert? Le rapport frontal du colorant E 131 est RF(E 131)=7/10=0, 7 Le rapport frontal du colorant E 141 est RF(E 131)=5/10=0, 5 Le colorant vert a deux taches qui ont migré aux hauteurs ses colorants E 131 et E 141 donc ce colorant vert contient ces deux colorants

• Exercices 12, 13, 14, 15, 16, 22, 23, 2 4 pages 26 et 27

Correction des exercices

Exercice n° 12 1)La densité du liquide est de ddiéthylique=0, 71 Sa masse volumique est donc ddiéthylique= ρdiéthylique/ ρeau On en déduit: ρdiéthylique= ddiéthylique. Ρeau L’ Application numérique donne ρdiéthylique==0, 7. 100=70 g 2) Pour prélever ce volume il faut se munir d’un masque, d’une blouse et de gants. Il faut réaliser le prélèvement sous une sorbonne avec une fiole jaugée. Si on veut procéder par la masse, il faut alors utiliser une balance de précision avec un bécher

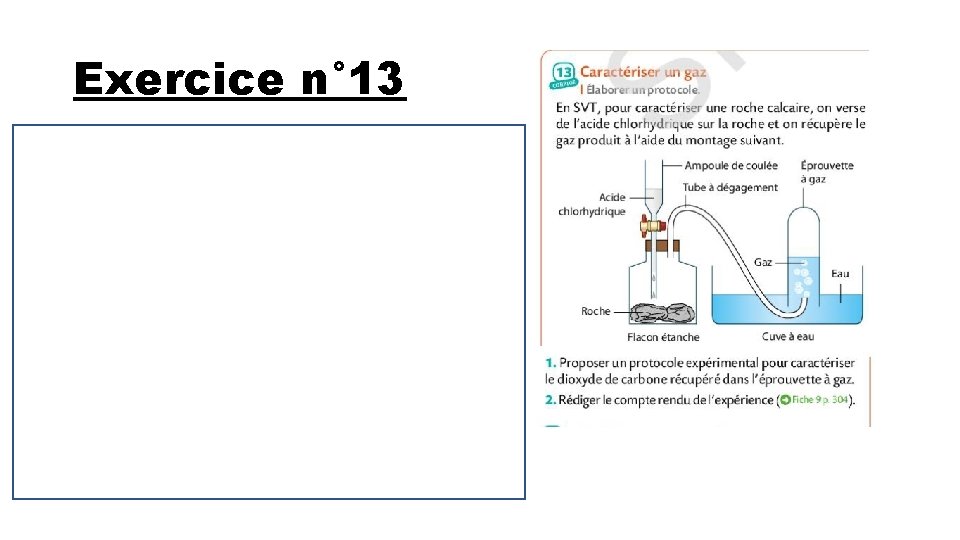
Exercice n° 13 1)Le dioxyde de carbone est caractérisé par de l’eau de chaux. Il faudrait enlever le tube à dégagement. Placer un couvercle sous l’éprouvette graduée. Retourner l’éprouvette à gaz. Ajouter de l’eau de chaux. Agiter l’éprouvette à gaz. 2)l’eau de chaux doit se troubler

Exercice n° 14 Si le sulfate de cuivre est devenu bleu c’est qu’il est entré en contact avec de l’eau, pourtant il n’est qu’exposé à l’air libre. L’humidité contenue dans l’air a du réagir avec le sulfate de cuivre anhydre.

Exercice n° 15 1) J’observe qu’ après migration de l’éluant l’huile essentiel de menthe en 1 s’est décomposée en 5 taches j’en déduis que ce n’est pas un corps pur, alors que les autres dépôts le sont 2) On constate sur le chromatogramme que trois taches de l’huile essentielle ont migré aux mêmes hauteurs respectives du menthol, de menthane et du menthofurane. On peut alors en déduire que la menthe contient ces trois espèces chimiques.

Exercice n° 16 a→ couvercle b → Cuve chromatographique c → front de solvant d →phase fixe e → ligne de dépôt f → Eluant

Exercice n° 22 1)Un clou est plongé dans de l’acide chlorhydrique, on observe une effervescence. Le gaz émis lors de cette réaction chimique provoque une détonation en présence d’une flamme. L’ajout de soude dans la solution provoque un précipité vert. 2)La détonation observée en présence d’une flamme met en évidence la formation de dihydrogène lors de cette réaction chimique car c’est ainsi qu’il est identifié. Le précipité vert en présence de soude montre la formation d’ion fer II Fe 2+ car c’est ainsi qu' ils sont identifiés

Exercice n° 23 1)La densité du Destop est d. Destop =1, 23 Sa masse volumique est donc ρDestop= d. Destop. ρ eau L’application numérique donne ρ Destop=1230 g/L 2)La bouteille fait VDestop=1, 25 litre La masse de la solution est m. Destop =ρDestop. V Destop L’application numérique donne m Destop =1537 g 3)La solution contient 10% de soude On a la relation Psoude=(msoude/m Destop ). 100 On en déduit msoude= (Psoude. m Destop) /100 L’application numérique donne: msoude=(1537. 10)/100=153, 7 g

Exercice n° 24 La densité de cette huile peut être considérée égale à 0, 916 soiot une masse volumique de ρHuile=0, 916 g/m. L La masse de 40 m. L d’huile est donc de m Huile= ρHuile. V Huile L’application numérique donne: 36, 64 g le pourcentage en oléine est donc de Poléine =moléine /m. Huile). 100 L’application numérique donne Poléine=2, 5% L’huile est fdonc ordinaire