Cours 6 Changement de phase des corps purs







- Slides: 18

Cours 6 : Changement de phase des corps purs 6. 1 Coefficient de compressibilité 6. 2 Changement de phase 6. 3 Diagrammes d’état 6. 4 Cas particulier de l’eau

6. 1 Les gaz réels : coefficient de compressibilité PV = Z n R T Z « coefficient de compressibilité du gaz » Z = 1 gaz parfait • Domaines d’application de l’équation des gaz parfaits : - À Pression faible - Lorsque T est élevée, à des pressions plus élevées • Variation de la compressibilité gaz parfaits , à P 0 : V 0 , compression à 10 P 0 : V 0/10 gaz réel , à P 0 : V 0 (Z=1) , compression à 10 P 0 : V 0/2 (Z=5) • à P élevée ou à T faible, pente de Z de +en+ élevée, le gaz devient de moins en moins compressible, il va se liquéfier Changement de phase - Liquéfaction en comprimant un gaz (utilisé dans les frigo) - Liquéfaction en refroidissant un gaz (phénomène de brouillard)

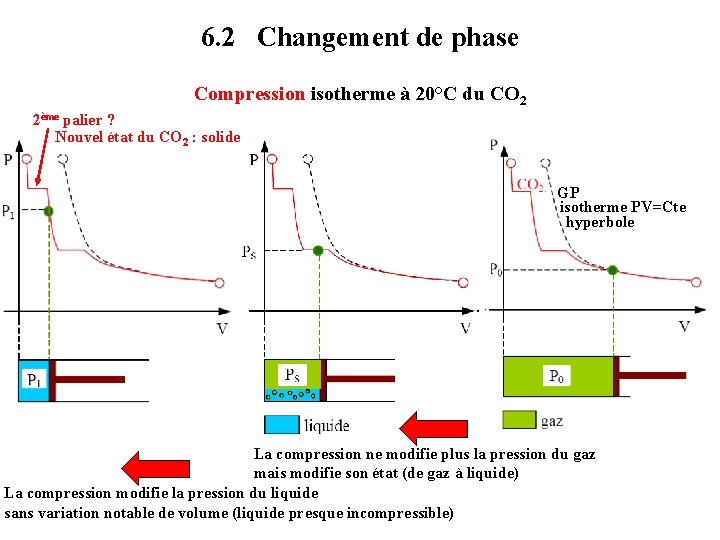
6. 2 Changement de phase Compression isotherme à 20°C du CO 2 2ème palier ? Nouvel état du CO 2 : solide GP isotherme PV=Cte hyperbole La compression ne modifie plus la pression du gaz mais modifie son état (de gaz à liquide) La compression modifie la pression du liquide sans variation notable de volume (liquide presque incompressible)

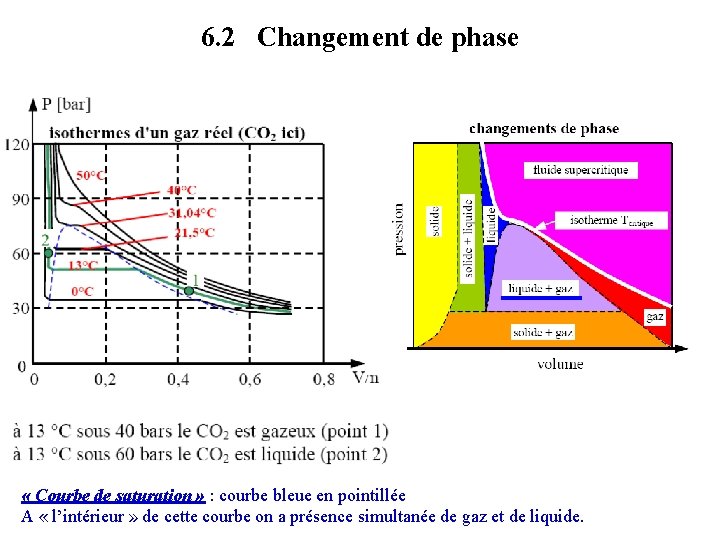
6. 2 Changement de phase « Courbe de saturation » : courbe bleue en pointillée A « l’intérieur » de cette courbe on a présence simultanée de gaz et de liquide.

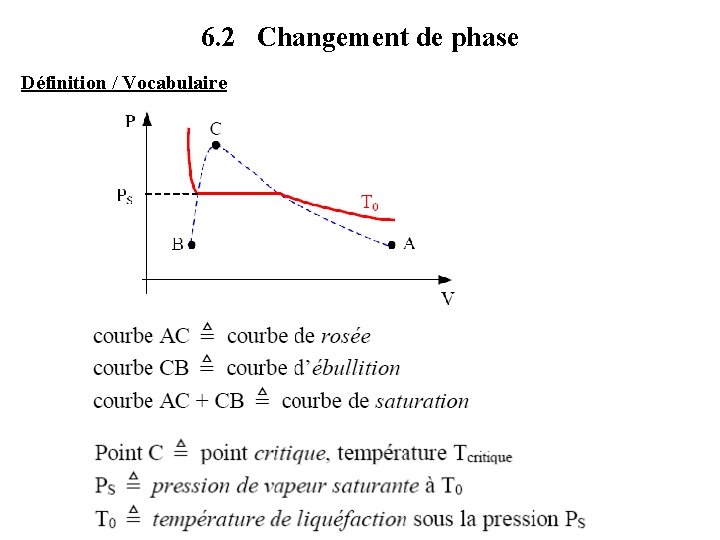
6. 2 Changement de phase Définition / Vocabulaire

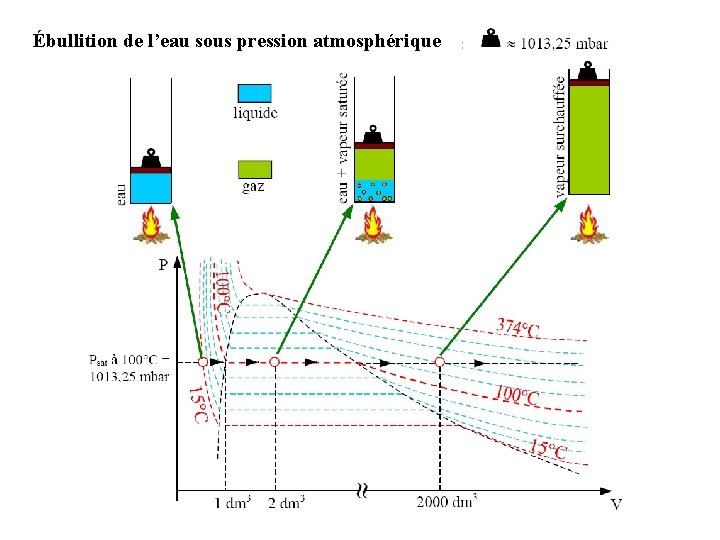
6. 2 Changement de phase Ébullition de l’eau sous pression atmosphérique

6. 2 Changement de phase Exercices 1, 2

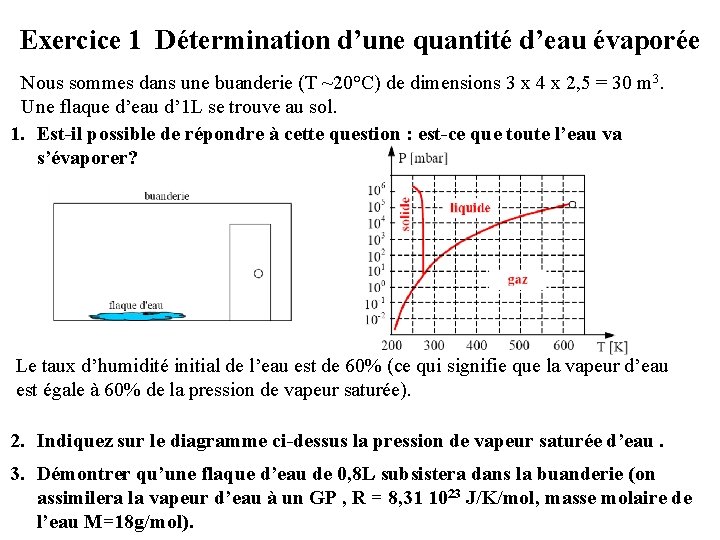
Exercice 1 Détermination d’une quantité d’eau évaporée Nous sommes dans une buanderie (T ~20°C) de dimensions 3 x 4 x 2, 5 = 30 m 3. Une flaque d’eau d’ 1 L se trouve au sol. 1. Est-il possible de répondre à cette question : est-ce que toute l’eau va s’évaporer? Le taux d’humidité initial de l’eau est de 60% (ce qui signifie que la vapeur d’eau est égale à 60% de la pression de vapeur saturée). 2. Indiquez sur le diagramme ci-dessus la pression de vapeur saturée d’eau. 3. Démontrer qu’une flaque d’eau de 0, 8 L subsistera dans la buanderie (on assimilera la vapeur d’eau à un GP , R = 8, 31 1023 J/K/mol, masse molaire de l’eau M=18 g/mol).

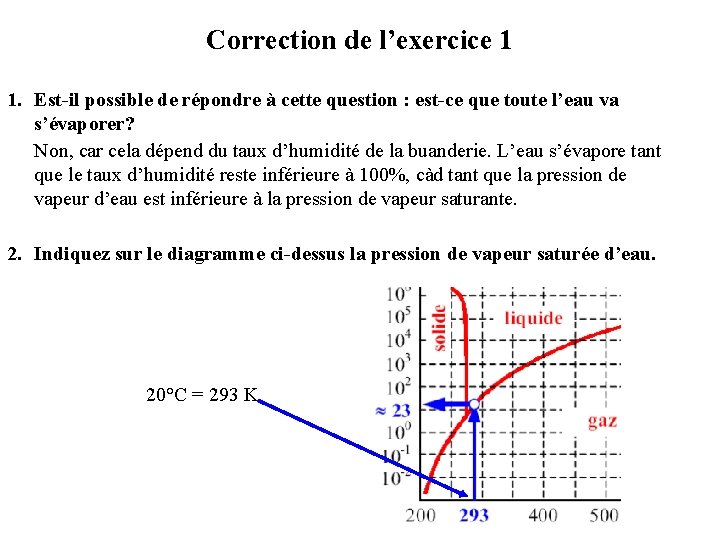
Correction de l’exercice 1 1. Est-il possible de répondre à cette question : est-ce que toute l’eau va s’évaporer? Non, car cela dépend du taux d’humidité de la buanderie. L’eau s’évapore tant que le taux d’humidité reste inférieure à 100%, càd tant que la pression de vapeur d’eau est inférieure à la pression de vapeur saturante. 2. Indiquez sur le diagramme ci-dessus la pression de vapeur saturée d’eau. 20°C = 293 K

Correction de l’exercice 1 3. Démontrer qu’une flaque d’eau de 0, 8 L subsistera dans la buanderie (on assimilera la vapeur d’eau à un GP , R = 8, 31 J/K/mol, masse molaire de l’eau M=18 g/mol). L’évaporation cesse lorsqu’il y aura 100% d’humidité, càd lorsqu’il y aura ns moles de vapeur d’eau à la pression saturante présente dans la buanderie. ns = Ps. V/RT A. N. ns = 23 10 -3 105. 30 / ( 8, 31. 293) = 28, 3 mol Or, il y a initialement un taux d’humidité de 60%, donc ni moles de vapeur d’eau déjà présente dans la buanderie. ni = ns. 60 / 100 = 17 moles Donc seules 11, 3 moles d’eau (28, 3 – 17) pourront s’évaporer de la flaque, soit un volume V : V= ns. M / A. N. V= 11, 3. 18. 10 -3 / 1 = 0, 2 L Il reste donc 0, 8 L d’eau liquide (1 – 0, 2).

Exercice 2 Principe de la cocotte minute ( « auto-cuiseur » ) Nous disposons d’une cocotte minute de 8 litres dans laquelle nous plaçons 1 litre d’eau pure (m=1 kg). On donne la masse molaire de l’eau M=18 g/mol et la constante des gaz parfait R = 8, 31 J/K/mol. L’air de la pièce est à 20°C. On ferme la cocotte-minute. Étant donné que l’air enfermé est d’une composition chimique différente de l’eau, la pression de la vapeur d’eau initiale est de 0 bar. On place la cocotteminute sur le feu. La pression de vapeur saturante de l’eau est donnée par la relation de Duperray : Psat = P 0(t/100)4 où P 0= 1 atm et t= température en °C. 1. Quelle est la température d’ébullition de l’eau sous 1 bar ? 2. La cocotte possède une soupape différentielle de 1 bar : Pour quelle pression des gaz (air + vapeur d’eau) se déclanche-t-elle ? 3. On rappelle que l’eau liquide est soumise à la pression des gaz. Donnez la température atteinte par l’eau bouillonnante lorsque la soupape se déclenche. Pourquoi ne met-on pas de soupape réglée pour une pression plus élevée ? 4. Quelle est la pression de l’air dans la cocotte lorsque la soupape se déclenche ? 5. Pour une masse m d’eau de 1 kg, calculer le nombre de moles de vapeur contenu dans la cocotte lorsque la soupape se déclenche, déduisez-en la masse de vapeur d’eau. 6. Déduisez-en le volume d’eau liquide qui reste dans la cocotte au moment où la soupape se déclenche.

Correction de l’exercice 2 1. Quelle est la température d’ébullition de l’eau sous 1 bar ? La température d’ébullition est donnée par la relation de Duperray : Psat = P 0(t/100)4 2. La cocotte possède une soupape différentielle de 1 bar : Pour quelle pression des gaz (air + vapeur d’eau) se déclanche-t-elle ? La soupape s’ouvre lorsque la pression totale à l’intérieur est 1 bar plus élevée qu’à l’extérieur, càd : Ptot = 2 bars Ce surplus de pression est dû à la pression de vapeur d’eau qui s’ajoute à la pression de l’air: Ptot = somme des pressions partielles de chaque gaz = Pvap + Pair 3. On rappelle que l’eau liquide est soumise à la pression des gaz. Donnez la température atteinte par l’eau bouillonnante lorsque la soupape se déclenche. Pourquoi ne met-on pas de soupape réglée pour une pression plus élevée ? Pour une pression de déclenchement plus élevée, la température des aliments serait pus importante : les aliments cuiraient plus vite mais perdraient leurs qualités gustatives (bouillie!).

Correction de l’exercice 2 4. Quelle est la pression de l’air dans la cocotte lorsque la soupape se déclenche ? Initialement (T=20°C et P= 1 bar) : on a un volume d’air enfermé dans la cocotte qui est de 7 L (volume de la cocotte moins le volume occupé par l’eau). On a donc nair moles d’air enfermées dans la cocotte: nair = PV / (RT) = 105 x 7. 10 -3 / (8, 31. 293) = 0, 29 mol Lorsque la soupape se déclenche (T= 120°C, Ptot=2 bar, Pair? ) : l’air se trouve à une température de 120°C, elle occupe toujours un volume de 7 L, et son nombre de moles n’a pas encore varié. La pression de l’air est donc : Pair = nair. RT / V = 0, 29. 8, 31. 393 / (7. 10 -3 ) = 1, 34 105 Pa = 1, 34 bar 5. Pour une masse m d’eau de 1 kg, calculer le nombre de moles de vapeur contenu dans la cocotte lorsque la soupape se déclenche, déduisez-en la masse de vapeur d’eau. Lorsque la soupape se déclenche : Ptot= Pair+Pvap = 2 bars. Donc la pression de vapeur d’eau présente est Pvap= 2 – 1, 34 = 0, 66 bar Le nombre de moles de vapeur est donc : nvap = Pvap. V / (RT) = 0, 66. 105 x 7. 10 -3 / (8, 31. 393) = 0, 14 mol donc mvap = nvap. M = 0, 14 x 18 = 2, 5 g

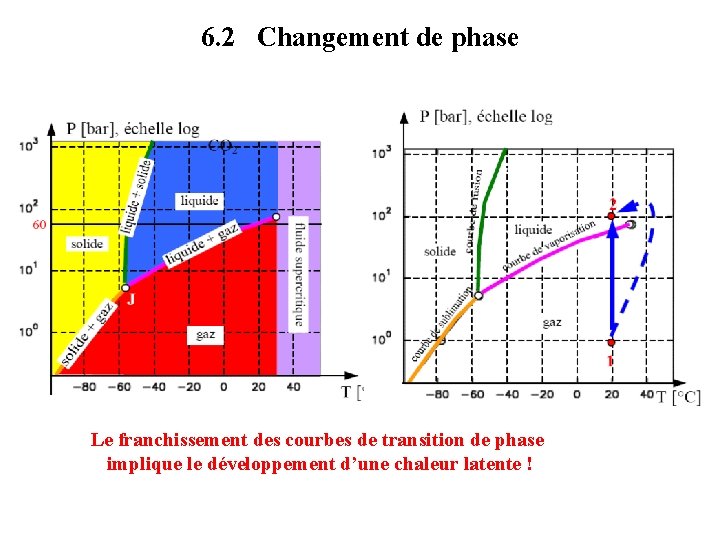
6. 2 Changement de phase Le franchissement des courbes de transition de phase implique le développement d’une chaleur latente !

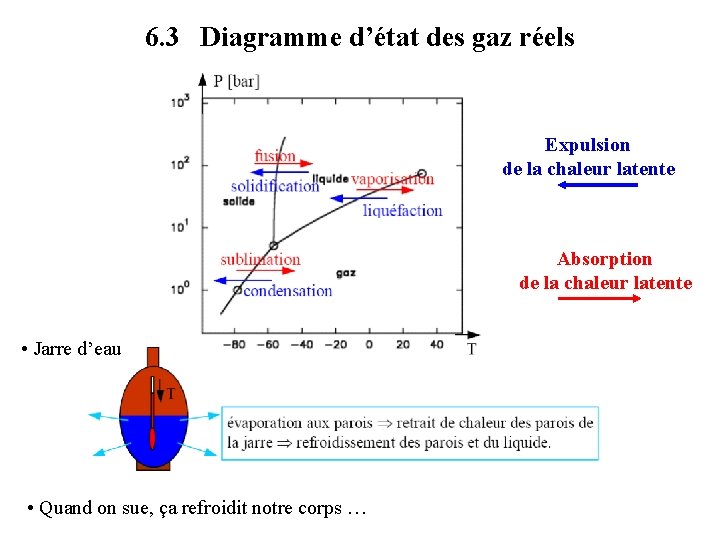
6. 3 Diagramme d’état des gaz réels Expulsion de la chaleur latente Absorption de la chaleur latente • Jarre d’eau • Quand on sue, ça refroidit notre corps …

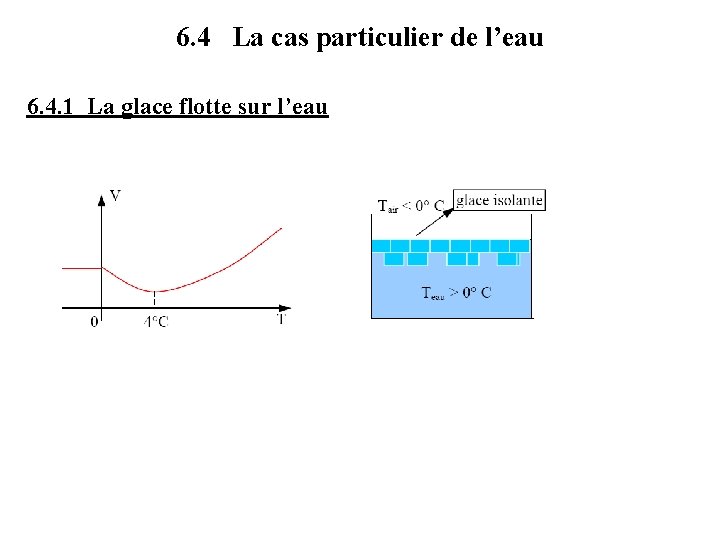
6. 4 La cas particulier de l’eau 6. 4. 1 La glace flotte sur l’eau

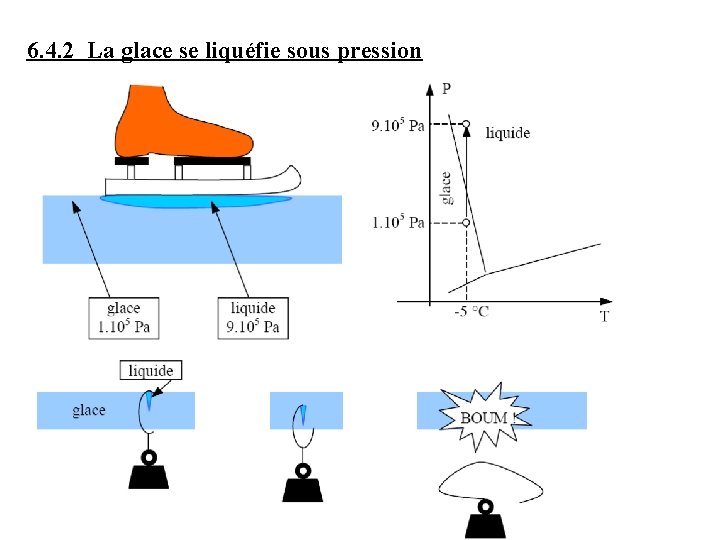
6. 4. 2 La glace se liquéfie sous pression

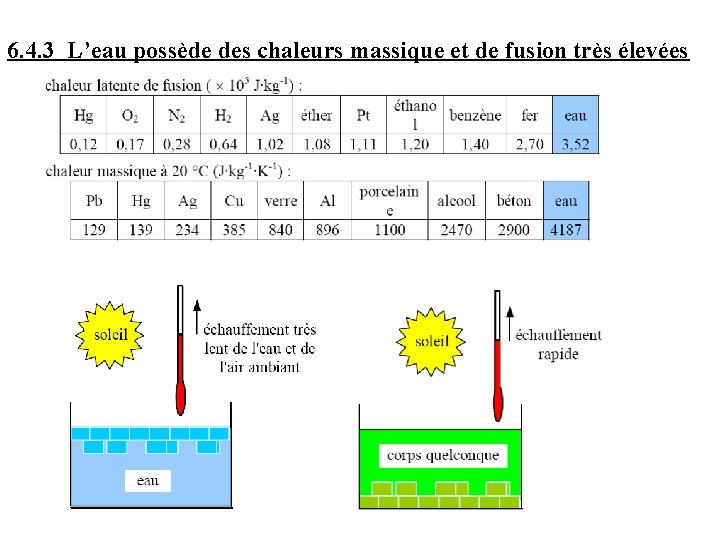
6. 4. 3 L’eau possède des chaleurs massique et de fusion très élevées