AZ TMENETIFMEK LTALNOS JELLEMZSE A nv az s













![ÁTMENETIFÉMEK HALOGENIDJEI Rendkívül változatosak: MXn n=1 -7 oxidációs állapottól függően [MXm]nmmax=2, 4, 6… halogeno ÁTMENETIFÉMEK HALOGENIDJEI Rendkívül változatosak: MXn n=1 -7 oxidációs állapottól függően [MXm]nmmax=2, 4, 6… halogeno](https://slidetodoc.com/presentation_image_h/b06eaa0b0ce6044b96f4fb967bb8cf06/image-15.jpg)












![ÁTMENETIFÉMEK VIZES OLDATOKBAN Fe Fe 2+ [Fe(H 2 O)6]2+, halványzöld Fe 3+ [Fe(H 2 ÁTMENETIFÉMEK VIZES OLDATOKBAN Fe Fe 2+ [Fe(H 2 O)6]2+, halványzöld Fe 3+ [Fe(H 2](https://slidetodoc.com/presentation_image_h/b06eaa0b0ce6044b96f4fb967bb8cf06/image-28.jpg)







- Slides: 37

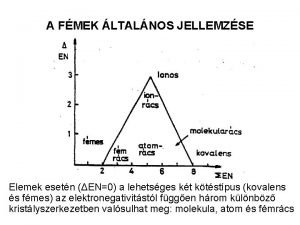
AZ ÁTMENETIFÉMEK ÁLTALÁNOS JELLEMZÉSE A név az s és p mező közötti és nem a fémek és nemfémek közötti átmenetre utal. ELEKTRONSZERKEZETÜK: (n-1)dxns 2 (n-1)= 3, 4, 5, belső d alhéj töltődik fel → vízszintes rokonság a Sc (3. ), a Cu(11. ) és a Zn(12. ) csoport hovatartozása kérdéses Eltérések a szabályos felépüléstől: félig vagy teljesen telített alhéj esetén: Cr: 3 d 54 s 1, Cu: 3 d 104 s 1, de Nb: 4 d 45 s 1, Pt: 5 d 96 s 1; ELEKTRONEGATIVITÁS kis-közepes értékek: 1, 3 -2, 4; a periódusban balról jobbra először nő majd csökken; a csoportban lefelé általában nő; kémiai tulajdonságra alig utalnak: Fe=Si=1, 8; Au=2, 4; I=2, 5;

AZ ÁTMENETIFÉMEK ÁLTALÁNOS JELLEMZÉSE ATOM- ÉS IONMÉRET atomméret: átmenetifém kontrakció (növekvő effektív magtöltés) d 0 d 1 d 2 d 3 d 4 d 5 d 6 d 7 d 8 d 9 d 10 Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn 174 144 132 122 118 117 116 115 117 125 ratom (pm) 175 ionméret: energia) 100 - 86 79 +2 töltésűek (kontrakció + kristálytér stabilizációs 80 csoportban lefelé 82 78 75 69 73 74 rion (pm) r 3 d < r 4 d < r 5 d Elem ratom rion Ti 132 68 Cr 118 52 Zr 145 80 Mo 130 62 Hf 144 81 W 130 68 (lantanoida kontrakció, ami tovább csökkenti az 5 d sor méretét. )

AZ ÁTMENETIFÉMEK ÁLTALÁNOS JELLEMZÉSE SŰRŰSÉG nehézfémek ρ(3 d): 3 -9; ρ(4 d): 4, 5 -12, 5; ρ(5 d): 6 -22, 5; 5 d elemek kiugróan nagy sűrűsége: r 4 d ~ r 5 d maximum görbe jelleg az atomméret minimumnál (d 6 -d 8) OLVADÁSPONT, FORRÁSPONT általában magas op (>1000 °C) és fp (>2000 °C); kivételek: Zn, Cd, Hg (lezárt d alhéj, a d elektronok nem vesznek részt a fémes kötésben) Olvadáspont Forráspont

AZ ÁTMENETIFÉMEK ÁLTALÁNOS JELLEMZÉSE OXIDÁCIÓS SZÁM a d- és s- alhéj elkülönülése határozza meg s alhéj elkülönül: (+1) és +2 az uralkodó <d 5: az s és d alhéj együttesen alakítják ki a vegyértékhéjat >d 5: s alhéj +1 -2 d elektron alkotja a vegyértékhéjat Elektronszerkezet Oxidációs számok A 4 d és az 5 d elektronok energiája kevésbé különül el az s alhéjétól, így >d 5 -nél is több d elektron vesz részt a vegyértékhéj kialakításában (Pt-fémek nagy pozitív oxidációs állapotai: Ru: +8, Os: +8, Ir: +6, Pt: +6) Vízszintes és függőleges rokonság az átmenetifémek sorában: korai és késői átmenetifémek: függőleges rokonság d 6 -d 8: vízsztintes rokonság

AZ ÁTMENETIFÉMEK ÁLTALÁNOS JELLEMZÉSE KÉMIAI TULAJDONSÁGOK Sok fém esetén védő-oxidréteg→renyhe reakcióképesség, finom eloszlásban nagy reakcióképesség (pl. piroforosság) Nagy a hajlamuk komplexek képzésére: kis méretű, nagy töltésű ionok, üres, alacsony energiájú atompályákkal, melyek alkalmasak elektronpárok akceptálására nagyobb oxidációs állapotban általában stabilisabb komplexeket képeznek, MIVEL? a-osztály: hard; b-osztály: soft a/b osztály: borderline Gyakran képeznek nem-sztöchiometrikus vegyületeket (különösen a kalkogén elemekkel) Fe. O Fe 0, 84 O-Fe 0, 94 O VSe 0, 98 -VSe 1, 2 V 2 Se 3 VSe 1, 2 -VSe 1, 6 Ok: a fém redoxi sajátsága (vegyes vegyértékű vegyületek); rácshibák


AZ ÁTMENETIFÉMEK ÁLTALÁNOS JELLEMZÉSE KÉMIAI TULAJDONSÁGOK Sok fém esetén védőoxid réteg→renyhe reakcióképesség, finom eloszlásban nagy reakcióképesség (pl. piroforosság) Nagy a hajlamuk komplexek képzésére: kis méretű, nagy töltésű ionok, üres, alacsony energiájú atompályákkal, melyek alkalmasak elektronpárok akceptálására nagyobb oxidációs állapotban általában stabilisabb komplexeket képeznek, MIVEL? a-osztály: hard; b-osztály: soft a/b osztály: borderline Gyakran képeznek nem-sztöchiometrikus vegyületeket (különösen a kalkogén elemekkel) Fe. O Fe 0, 84 O-Fe 0, 94 O VSe 0, 98 -VSe 1, 2 V 2 Se 3 VSe 1, 2 -VSe 1, 6 Ok: a fém redoxi sajátsága (vegyes vegyértékű vegyületek); rácshibák

KOMPLEX VEGYÜLETEK A elektronpár akceptor központi fém(ion) (Lewis sav) és B elektronpár donor ligandumok közötti donor-akceptor (koordinativ) kötés, amely többé-kevésbé meghatározott koordinációs számú és geometriai elrendeződésű új kémiai minőséget hoz létre. pl. : Ni 2+ + 6 NH 3 ↔ [Ni(NH 3)6]2+; de az S(VI) + 4 O 2 - ↔ SO 42 - nem. Gyakori koordinációs számok és kapcsolódó geometria N=2 lineáris [Ag(NH 3)2]+ N=4 tetraéderes [Be. F 4]2 síknégyzetes [Pt(NH 3)2 Cl 2] N=5 trigonális bipiramis [Fe(CO)5] tetragonális piramis [VO(acac)2] N=6 oktaéderes Ni(NH 3)6]2+ trigonális hasáb [V(cat)3]2 N=7 pl. pentagonális bipiramis, fedett trigonális hasáb vagy oktaéder N=8 pl. kocka, négyzetes antiprizma, dodekaéder N=9 vagy ennél nagyobb a lantanoidáknál fordul elő

IZOMÉRIA A KOMPLEX VEGYÜLETEK KÖRÉBEN Konformációs izoméria pl. síknégyzetes vagy tetraéderes geometria Geometriai (cisz-transz) izoméria pl. síknégyzetes (2/2), vagy oktaéderes (2/4) vagy (3/3) elrendeződés esetén Koordinációs izoméria pl. [Co(NH 3)6][Cr(ox)3] vagy [Cr(NH 3)6][Co(ox)3] Ionizációs izoméria pl. [Co(NH 3)5 Br]SO 4 vagy [Co(NH 3)5 SO 4]Br Hidrát izoméria [Cr(H 2 O)6]Cl 3 ibolyáskék [Cr(H 2 O)5 Cl]Cl 2∙H 2 O zöldesibolya [Cr(H 2 O)4 Cl 2]Cl∙ 2 H 2 O zöld Kötési izoméria (ambidentát ligandumok) pl. [Co(NH 3)5 NO 2]2+ vagy [Co(NH 3)5 ONO]2+ Optikai izoméria (tükörképi formák)

KOORDINATÍV (DONOR-AKCEPTOR) KÖTÉS Központi fématom/ion: jellemző rá a betöltetlen alhéj, elektronpár akceptálására alkalmas alacsony energiájú atompályák Ligandum: jellemzően elektronpár donorok, nemkötő pályán levő elektronpárok révén egy vagy több donor-akceptor (koordinatív) kötés kialakítására képesek A ligandum elektronszerkezete és a fém-ligandum-kötés szimmetriája szerint az alábbi kötésfajták jöhetnek létre: σ-donor: σ szimmetriájú alacsonyabb energiájú ligandum atompályával átfedés révén, pl. : NH 3, aminok, H- p-donor: p szimmetriájú magasabb energiájú ligandum atompályával való átfedés révén, pl: X-, NH 2 -, S 2 - p-akceptor: p szimmetriájú alacsony energiájú, üres ligandum pályával való átfedés révén (viszontkoordináció), pl: CO, Cn-, aromás-aminok Delokalizált p pályákkal való átfedés révén: alkének, ciklopentadienil

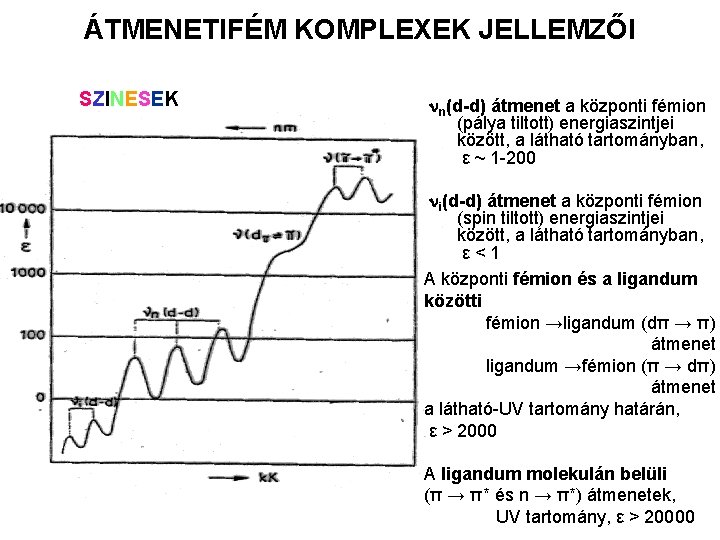
ÁTMENETIFÉM KOMPLEXEK JELLEMZŐI SZINESEK nn(d-d) átmenet a központi fémion (pálya tiltott) energiaszintjei között, a látható tartományban, ε ~ 1 -200 ni(d-d) átmenet a központi fémion (spin tiltott) energiaszintjei között, a látható tartományban, ε<1 A központi fémion és a ligandum közötti fémion →ligandum (dπ → π) átmenet ligandum →fémion (π → dπ) átmenet a látható-UV tartomány határán, ε > 2000 A ligandum molekulán belüli (π → π* és n → π*) átmenetek, UV tartomány, ε > 20000

A KOMPLEXEK MÁGNESES SAJÁTSÁGAI Az anyagok makroszkópikus mennyiségei természetes állapotukban általában nem mágnesesek. A külső mágneses tér azonban minden anyagban elektronjaik és nukleonjaik elektromos tulajdonsága révén mágneses momentumot indukál. mágneses momentum: μ (B. M. ) = e h/4 π m c (atomi paraméter) mólszuszceptibilitás: χm = N 2 μ/3 RT (moláris paraméter) A paramágneses momentum a spinmomentumból (csak a párosítatlan elektronok számától függ) és a pályamomentumból (függ a ligandum térerejétől és a komplex szimmetriájától) tevődik össze: μeff = √ 4 S(S+1)+L(L+1) S= eredő spinkvantumszám, L=eredő mellékkvantumszám

ÁTMENETIFÉMEK KATALITIKUS SAJÁTSÁGAI Ti. Cl 3 Ziegler-Natta katalizátor poliolefinek előállítására V 2 O 5 A kontakt kénsavgyártás nál a SO 2 →SO 3 katalizátora Fe A Haber-Bosch féle NH 3 szintézis katalizátora Pd. Cl 2 A Wacker folyamat C 2 H 4 +H 2 O +Pd. Cl 2 →CH 3 CHO +2 HCl +Pd katalizátora Pd Hidrogénező katalizátor (pl fenol→ciklohexanol) Pt Az autó kipufogó gázok három-fázisú tisztításánál használják Pt/Rh Az NH 3→NO folyamat katalizátora a HNO 3 gyártásnál Cu (CH 3)2 Si. Cl 2→szilikonok folyamatban használt katalizátor Cu/V ciklohexanol→ciklohexanon katalizátora adipinsav előállítására a nylon-66 gyártásánál Ni Raney Ni, számos redukciós folyamat katalizátora (pl. olajok keményítése, margarin előállítása)

ÁTMENETIFÉMEK HIDRIDJEI Intersticiális hidridek képződnek (a H 2 a rácshézagokban „oldódik”, atomizálódik, esetleg ionizálódik); Képződésük térfogatnövekedéssel jár (az s mező elemeinél csökken a térfogat), a fémrács szerkezete és fémes jellege változik (törékennyé válik); Nem-sztöchiometrikusak, összetételük változik a hőmérséklettel és a p(H 2)vel; A kötés természete pontosan nem ismert, a rendszertől, a körülményektől függően a tulajdonságok nagymértékben változnak. H-atom szám/ fématom szám Előállításuk: közvetlenül a fémből H 2 atmoszférában (optimális hőmérsékleten, túl magas hőmérsékleten bomlik a hidrid); elektrolitikusan, a fémet katódként kapcsolva a leváló H 2 részben oldódik a fémben;
![ÁTMENETIFÉMEK HALOGENIDJEI Rendkívül változatosak MXn n1 7 oxidációs állapottól függően MXmnmmax2 4 6 halogeno ÁTMENETIFÉMEK HALOGENIDJEI Rendkívül változatosak: MXn n=1 -7 oxidációs állapottól függően [MXm]nmmax=2, 4, 6… halogeno](https://slidetodoc.com/presentation_image_h/b06eaa0b0ce6044b96f4fb967bb8cf06/image-15.jpg)
ÁTMENETIFÉMEK HALOGENIDJEI Rendkívül változatosak: MXn n=1 -7 oxidációs állapottól függően [MXm]nmmax=2, 4, 6… halogeno komplexek Mm X n fém-fém kötésű klaszterek Kötés- és rácstípusok IONOS halogenidek: (3 d elemek +2, +3, +1 oxidációs állapotokban) gyakran akvakomplexek formájában oldódnak: [M(H 2 O)m]n+ +n. XKOVALENS molekularácsos halogenidek (nagy oxidációs állapotban) gyakran polimerek (átmenet az atomrácsba) RÉTEGRÁCSos (ionos és kovalens kötés között→átmenet az ion és atomrács között); KLASZTEREK (fémfém kötés) 4 d és 5 d halogenidek;

ÁTMENETIFÉMEK HALOGENIDJEI ELŐÁLLÍTÁSUK fémből X 2 atmoszférában magas hőmérsékleten 2 Fe + 3 Cl 2 = 2 Fe. Cl 3 fémoxidból halogénnel (halogén-metallurgia) Ti. O 2 + 2 Cl 2 = Ti. Cl 4 + 2 CO fém oldása sósavban – kristályvizes halogenid Fe. X 2∙n. H 2 O kristályvíz eltávolítható hevítéssel Fe. X 3∙n. H 2 O (oxidálódik) hevítéssel hidrolizál kristályvíztartalmú só+ halogénező szer pl. SOCl 2 Cr. Cl 3∙ 6 H 2 O + 6 SOCl 2 = Cr. Cl 3 + 12 HCl + 6 SO 2 fémoxidból halogénező szerekkel (Cl. F 3, CCl 4, stb. ) Sc. O 3 + 3 CCl 4 = 4 Sc. Cl 3 + 3 CO 2 (600 °C)

ÁTMENETIFÉMEK HALOGENIDJEI TULAJDONSÁGOK Képződésüket és stabilitásukat alapvetően a hard-szoft sajátság és az ionsugár arány határozza meg Fluorid erősen hard, stabilizálja a magasabb oxidációs állapotokat; Ti. F 2 nem szabil, Ti. F 4 stabil, 2 Cu. F ↔ Cu. F 2 + Cu Diszproporcionálódás Jodid erősen szoft, stabilizálja az alacsonyabb oxidációs állapotokat 2 Cu. I 2 ↔ 2 Cu. I + I 2; 2 Fe. I 3 ↔ 2 Fe. I 2 + I 2 sok I- koordinációja sztérikusan gátolt (túl nagy a ligandum) Klorid, bromid közbenső oxidációs állapotokat kedvelik, elvileg mind lehetséges, pl. a Cr(III) stabilis, a Cr(IV), Cr(V) nem stabilis a maximális koordinációs szám elérése sztérikus okok miatt nem mindig lehetséges

ÁTMENETIFÉMEK HALOGENIDJEI SZÍN a d 0 és d 10 kivételével színesek (de a halogenid polarizációja, Ag. X) színük a halogénelem csoportban lefelé mélyül: Ni. F 2 sárga, Ni. Cl 2 sárgás barna, Ni. Br 2 barna, Ni. I 2 fekete OLVADÁSPONT, FORRÁSPONT ionos: F>Cl>Br>I sorrend (Coulomb kölcsönhatás erőssége sorrend) Kovalens: I>Br>Cl>F sorrend (polarizálhatósági sorrend) HIDROLÍZIS az oxidációs szám növekedésével nő (pl Fe(II) és Fe(III)) KOMPLEXKÉPZŐDÉS N=2, 4, 6, 7 és 8 (7 és 8 csak a kisméretű F- ionnal) anionos komplexek képződnek Hard: fluoro- és klorokomplexek, pl [Fe. F 6]3 Szoft: bromo- és jodokomplexek, pl. [Hg. I 4]2 -

ÁTMENETIFÉMEK PSZEUDOHALOGENIDJEI Igen stabilis komplexeket képeznek σ-donor koordináció, π-akceptor viszontkoordináció +1 oxidációs állapot: lineáris [Ag(CN)2]-, tetraéderes [Cu(CN)4]3+2 oxidációs állapot siknégyzetes [Ni(CN)4]2 -, oktaéderes [Fe(CN)6]4+3 oxidációs állapot oktaéderes [Fe(CN)6]3 Ambidentát ligandumok, pl. SCNAg-SCN Zn-NCS

ÁTMENETIFÉMEK OXIDJAI SZTÖCHIOMETRIKUS OXIDOK M 2 O, M 2 O 3, MO 2, M 2 O 5, MO 3, M 2 O 7, MO 4 3 dimenziós ion- és atomrács molekularács NEM-SZTÖCHIOMETRIKUS OXIDOK Ti, V, Cr, Mn, stb. nagyobb oxidációs állapotaiban: oxidkerámiák ELŐÁLLÍTÁSUK: fém levegőn elégetve 4 Fe + 3 O 2 → 2 Fe 2 O 3 nitrátok hőbontása (bázikus oxidok) a legstabilabb, illetve vegyes oxid képződik 2 Pb(NO 3)2 → 2 Pb. O + 4 NO 2 + O 2 3 Mn(NO 3)2 → Mn 3 O 4 + 6 NO 2 +O 2 ammóniumsók hőbontása (NH 4)2 Cr 2 O 7 → Cr 2 O 3 + N 2 + 4 H 2 O (vulkán)

ÁTMENETIFÉMEK OXIDJAI ELŐÁLLÍTÁS Oxoanionok sóiból oldatban savanyítás hatására Mo. O 42 - +H+ → [Mo 7 O 24]6 - → Mo. O 3 hidroxidok, karbonátok, szulfidok hevítése 2 Fe(OH)3 → Fe 2 O 3 + 3 H 2 O 2 Fe. S 2 + 5, 5 O 2 → Fe 2 O 3 + 4 SO 2 TULAJDONSÁGAIK Termikus stabilitás az oxigénhez való affinitásuk határozza meg a hard fémek oxidjai stabilisak, pl. Ti. O 2, Fe 2 O 3; a szoft fémek oxidjai bomlékonyak pl. Au 2 O 3∙n. H 2 O → Au 2 O 3 → Au + O 2

ÁTMENETIFÉMEK OXIDJAI SAV-BÁZIS SAJÁTSÁGAIK az O-atom elektronsűrűségétől (az M elektronegativitásától) függően: bázikus oxidok: M 2 O, M 2 O 3, (MO 2) amfoter oxidok: (M 2 O 3), MO 2, (M 2 O 5) savas oxidok: (M 2 O 5), MO 3, M 2 O 7, MO 4 Pl. Fe. O + Si. O 2 → Fe. Si. O 3 bázis sav só Ca. O + Ti. O 2 → Ca. Ti. O 3 Bázikus oxidok: már kovalensbe hajlanak (nem ionrácsosak, átmenet az atomrács felé), vízben nem, ásványi savakban oldódnak Savas oxidok: inkább molekularácsosak, vízben oldódhatnak pl: 2 Cr. O 3 +H 2 O = H 2 Cr 2 O 7 Amfoter oxidok: savas közegben oxokationok: VO 2+, Mo. O 22+ lúgos közegben oxoanionok: VO 43 -, Mo. O 42 -

ÁTMENETIFÉM HIDROXIDOK • δ+ δ- δ+ • E—→O←—H Ha az E elektronegativitása kicsi, akkor oldáskor az E—O kötés hasad → bázis; Ha az E elektronegativitása nagyobb, vagy több –OH csoport kapcsolódik az E-hez, akkor az O— H kötés hasad → sav MOH nem stabilisak, szilárd halmazállapotban nem, csak oldatban léteznek, de bomlanak, pl. 2 Ag. OH → Ag 2 O + H 2 O M(OH)2, M(OH)3 bázikus hidroxidok, pl. Cu(OH)2, Fe(OH)3 M(OH)3, M(OH)4 amfoter hidroxidok, pl. Ti(OH)4 (Ti. O 2∙n. H 2 O), Ti(OH)4 + 4 HCl = Ti. Cl 4 + 4 H 2 O Ti. O 2∙n. H 2 O + 2 Na. OH = Na 2 Ti. O 3∙n. H 2 O + H 2 O A nem létező H 4 Ti. O 4 ortotitánsavból származtathatő metasav, a H 2 Ti. O 3 sója.

ÁTMENETIFÉM OXISAVAK H 3 MO 4, H 2 MO 4 és HMO 4 OXISAVAK oxidok vízben való oldásával ritkán képződnek, de pl. 2 Cr. O 3 + H 2 O = H 2 Cr 2 O 7 Mn 2 O 7 + H 2 O = 2 HMn. O 4 V: vanadátok (Na 3 VO 4), metavanadátok (Na. VO 3) Cr, Mo, W, Mn, Ru, Os: kromátok (Na 2 Cr. O 4), molibdátok (Na 2 Mo. O 4) Mn, Tc, Re: ‘per’manganátok (Na. Mn. O 4), ‘per’renátok (Na. Re. O 4) Tulajdonságaik: Óriásmolekulákat képeznek a hidroxidcsoportokon keresztüli hidrogénhidakon; Vízkilépéssel MOk(OH)m oxid-hidroxidok képződnek; Hidroxokomplexeket képezenk: [Zn(OH)4]2 -, [Cu(OH)2 Cu]2+

FONTOSABB OXIDOS ÉRCEK, ÁSVÁNYOK Ti. O 2∙Fe. O (ilmenit), Ti. O 2 (rutil), Ca. Ti. O 3 (perovszkit) Zr. O 2 (baddeleyit), 3 Pb 3(VO 4)2∙Pb. Cl 2 (vanadinit) Fe(Nb. O 3)2 niobit, Fe(Ta. O 3)2 (tantalit) Cr 2 O 3∙Fe. O (kromit, krómvaskő), Pb. Mo. O 4 (wulfenit) Mn. Fe(WO 4) (volframit), Ca. WO 4 (scheelit), WO 3 (volframokker) Mn. O 2 (barnakő), Mn 3 O 4 (hauszmanit) Fe 2 O 3 (hematit), Fe 3 O 4 (magnetit), Fe 2 O 3∙n. H 2 O (limonit) Cu 2 O (kuprit), Cu. CO 3∙Cu(OH)2 (malachit)

ÁTMENETIFÉMEK VIZES OLDATOKBAN Alacsony oxidációs állapotban: akvakomplexek Magasabb oxidációs állapotban: oxoionok Oxoanionos formák +5, +6, +7 oxidációs állapotú 4 d, 5 d átmeneti fémek Pl. VO 43 -, Cr. O 42 -, Mo. O 42 -, Mn. O 4 -, WO 42 Színük O→M elektronátmenet) VO 3 Mo. O 42 Cr. O 42 Mn. O 4 Szintelen sárga ibolya v. sárga Oxokationos formák Amfoter +4, +5 oxidációs állapotok [Ti(IV), V(V)] Ti. O 2+ titanil [Ti. O(H 2 O)4]2+ szintelen VO 2+ vanadil (oxovanádium(IV) [VO(H 2 O)4]2+ kék VO 2+ vanadil (dioxovanádium(V) [VO 2(H 2 O)4]+ sárga

ÁTMENETIFÉMEK VIZES OLDATOKBAN Ti V Cr Mn Ti 2+ redukál, bontja a vizet Ti 3+ [Ti(H 2 O)6]3+, ibolya színű, enyhe redukálószer V 2+ ibolya színű, bontja a vizet V 3+ zöld, oxidálódik VO 2+ kék VO 2+ sárga Cr 2+ kék, bontja a vizet Cr 3+ [Cr(H 2 O)6]3+ ibolya, [Cr. Cl(H 2 O)5]2+ zöld igen inert komplexek, a Cr-O kötés felhasadása igen lassú Mn 2+ [Mn(H 2 O)6]2+, rózsaszínű Mn 3+ ibolya, főleg komplexekben létezik Mn 4+ barna, rosszul oldódik vízben Mn. O 3 - kék Mn. O 42 - zöld Mn. O 4 - ibolya
![ÁTMENETIFÉMEK VIZES OLDATOKBAN Fe Fe 2 FeH 2 O62 halványzöld Fe 3 FeH 2 ÁTMENETIFÉMEK VIZES OLDATOKBAN Fe Fe 2+ [Fe(H 2 O)6]2+, halványzöld Fe 3+ [Fe(H 2](https://slidetodoc.com/presentation_image_h/b06eaa0b0ce6044b96f4fb967bb8cf06/image-28.jpg)
ÁTMENETIFÉMEK VIZES OLDATOKBAN Fe Fe 2+ [Fe(H 2 O)6]2+, halványzöld Fe 3+ [Fe(H 2 O)6]3+, halványibolya pl. a Fe(III)(NH 4)(SO 4)2 -ban létezik vizes oldata a [Fe(OH)2 Fe]4+ komplextől sárga Co Co 2+ Ni Co 3+ Ni 2+ Cu Cu+ Cu 2+ [Co(H 2 O)6]2+, rózsaszínű komplexképzéssel a szín változik [Co. Cl)4]2 - kék sárgásbarna, az akvakomplex nem stabilis, oxidál [Ni(H 2 O)6]2+, zöld, komplexképzéssel a szín változik [Ni(NH 3)6]2+ kék, [Ni(CN)4]2 - sárga színtelen, oxidálódik [Cu(H 2 O)6]2+, kék Zn Zn 2+ [Zn(H 2 O)6]2+ színtelen (d 10)

ÁTMENETIFÉMEK VIZES OLDATOKBAN 4 d, 5 d átmentifémek: csak a periódus végén levők hajlamosak kationos formában stabilizálódni Pd, Pt [Pd(H 2 O)4]2+ vagy halogeno komplexek: [Pd. Cl 4]2 -, Pt. Cl 4]2 vagy Pt(Cl)6]2 Au [Au. Cl 4]- Ag [Ag(H 2 O)2]+ Cd [Cd(H 2 O)4]2+ stabilis Hg Hg 2+ és Hg 22+ ionok, de a Hg. Cl 2 csak részben disszociál vizes oldatban, komplexként oldódik

IZOPOLISAVAK ÉS HETEROPOLISAVAK Oxosavak polikondenzációjával többmagvú oxosavakat képeznek IZOPOLISAVAK: egy elemet tartalmaz központi atomként HETEROPOLISAVAK: két különböző központi atomot tartalmaz izopolisavképző nemfémes elemek: B, Si, P, (As), (S) átmeneti fémek: V, Mo, W, (Cr), (Nb), (Ta) Pl. Cr. O 42 - + 2 H+ ↔ Cr 2 O 72 - + H 2 O Az MO 4 n- tetraéderek vagy MO 6 m- oktaéderek közös csúcsok vagy élek mentén kapcsolódnak. Oldatban egyensúlyi rendszert alkotnak, de egyes komplexek preparálhatók is.

HETEROPOLISAVAK Molibdátok, volframátok képeznek elsősorban Jelentőségük: analitikai kémia

ÁTMENETIFÉM SZULFIDOK A szulfidok a megfelelő oxidoknál kovalensebb kötésűek →rosszul oldódó színes vegyületeket képeznek, sok közöttük nemsztöchiometrikus, atomrácsos, rétegrácsos (korai d elemek) vagy fémrácsos (késői d elemek) vegyület Előállításuk elemeiből: fém + kén hevítve Fe + S = Fe. S fémoxidokból kénnel (oxigén távollétében) oldatokban H 2 S-nel illetve alkálifém- vagy ammónium-szulfiddal lecsapva 3 d általában MS, (M 2 S 3), 4 d és 5 d általában MS 2, MS 3 Átmenetifém szulfidok leválasztása vizes oldatokból és oldódásuk Minél oldhatatlanabb egy szulfid annál kisebb [S 2 -] szükséges a leválasztásához, annál savasabb oldatból is leválik: Erősen savas közegből H 2 S-nel a legrosszabbul oldódóak is leválnak: Pl: Cu 2+, Hg 2+, Cd 2+, Ag+, … (d 9, d 10 elektronkonfigurációjúak) A kevésbé rosszul oldódóak csak (NH 4)2 S-dal választhatók le Pl: Co 2+, Ni 2+, Mn 2+, Fe 2+… (a hard Cr 3+ és Al 3+ hidroxidként válik le).

ÁTMENETIFÉM SZULFIDOK AZ ANALITIKÁBAN A S 2 - szoft jellege miatt inkább az alacsonyabb oxidációs állapotokat kedveli; gyakori a redoxi reakció (S kiválás) (Fe 3+, Mn. O 4 -, VO 2+) pl. 2 Fe 3+ + S 2 - = 2 Fe. S + S Az alacsonyabb oxidációs állapotok szulfidjai (Fe. S, Co. S, Ni. S, Mn. S, Ag 2 S, Cu. S) tiobázisanhidridek, oldódnak savakban pl. Fe. S + 2 H+ = Fe 2+ + H 2 S A magasabb oxidációs állapotok tiosavanhidridjei oldódnak (NH 4)2 Sban vagy (NH 4)2 Sx-ban (Mo. S 2, V 2 S 5, WS 2) pl. V 2 S 5 + 3 S 2 - = 2 VS 43 Az erősen hard fémek (kevés d elektron és nagy oxidációs szám) szulfidjai vizes közegben nem léteznek hidrolizálnak: pl. Cr 3+ + (NH 4)2 S + H 2 O = Cr(OH)3 + NH 3 + H 2 S ALKALMAZÁS: kationok Fresenius féle osztályozása és elválasztása

ÁTMENETIFÉM KARBIDOK Zömmel intersticiális (rácsközi) karbidokat képeznek r=130 -190 pm a C a fémrács hézagaiba befér, oda be tud épülni→ a rácsszerkezet nem változik, a C atomok külső elektronjai hozzájárulnak a kötésrendszer kialakulásához – atomrácsos jelleg op: jelentősen nő (Ti: 1940 K, Ti. C: 3414 K, kemények, kémiailag ellenállóak (tűzálló karbidok: Ti, Zr, Hf, V, Nb, Ta, Mo, W karbidjai) r=<130 pm nem tudják a rácshézagokat kitölteni, nem férnek bele, a rácsszerkezet felbomlik; a fém-fém kötések mellett C-C kötések is létrejönnek; C-láncok járják át a fémrácsot→termikus, mechanikai és kémiai ellenállóképesség csökken (Cr, Mn, Fe, Co, Ni) Ionos karbidok: részben átmenet a fémes és az ionos jelleg között (pl. Cd. C 2, Cu 2 C 2, Hg. C 2)

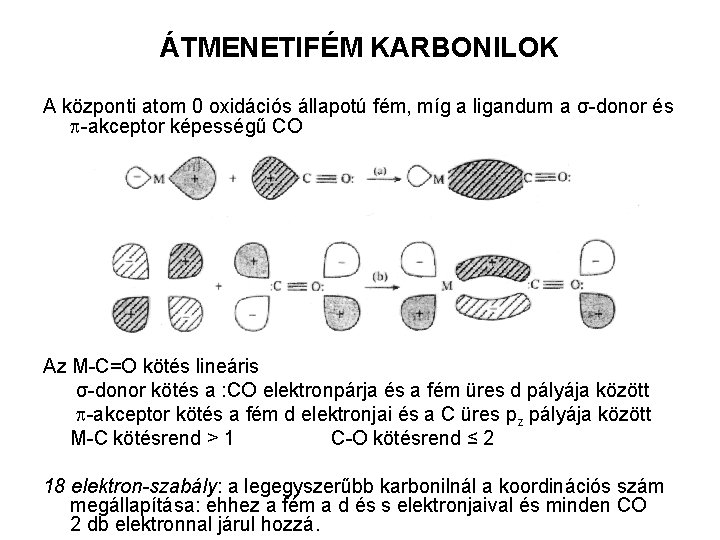
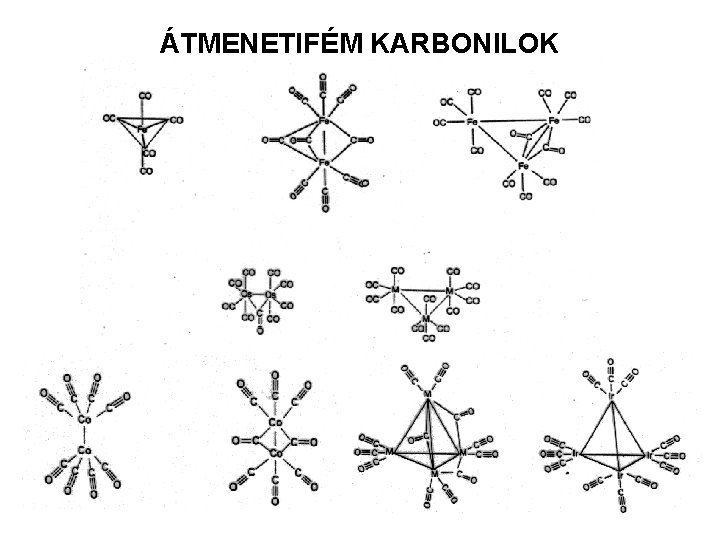
ÁTMENETIFÉM KARBONILOK A központi atom 0 oxidációs állapotú fém, míg a ligandum a σ-donor és p-akceptor képességű CO Az M-C=O kötés lineáris σ-donor kötés a : CO elektronpárja és a fém üres d pályája között p-akceptor kötés a fém d elektronjai és a C üres pz pályája között M-C kötésrend > 1 C-O kötésrend ≤ 2 18 elektron-szabály: a legegyszerűbb karbonilnál a koordinációs szám megállapítása: ehhez a fém a d és s elektronjaival és minden CO 2 db elektronnal járul hozzá.

ÁTMENETIFÉM KARBONILOK Előállításuk Finom eloszlású fém + CO (hőmérséklet, nyomás) Fe + 5 CO → Fe(CO)5 (470 K, 100 bar) Fémhalogenid + CO + Grignard-reagens 2 Cr. Cl 3 + 3 R-Mg. Cl +12 CO = 2 Cr(CO)6 + 3 R-X + 3 Mg. Cl 2 Fémhalogenid + CO + alkálifém redukálószer VCl 3 + 3 Na + 6 CO → V(CO)6 + 3 Na. Cl Karbonilok hevítése, UV-besugárzás (átalakítás) 2 Fe(CO)5→ Fe 2(CO)9 + CO Tulajdonságok alacsony op. szilárd, vagy folyadék halmazállapotú molekulavegyületek termikus stabilitásuk kicsi, csak szerves oldószerekben oldódnak, többmagvú karbonil komplexeket képeznek: fém-fém klaszter, CO hídligandum

ÁTMENETIFÉM KARBONILOK