ADN ftal dans le sang maternel J M
















- Slides: 33

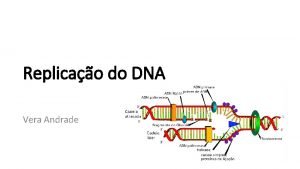
ADN fœtal dans le sang maternel > J. M. COSTA Laboratoire Cerba Colloque ATC Aix-en-Provence 20 Septembre 2010

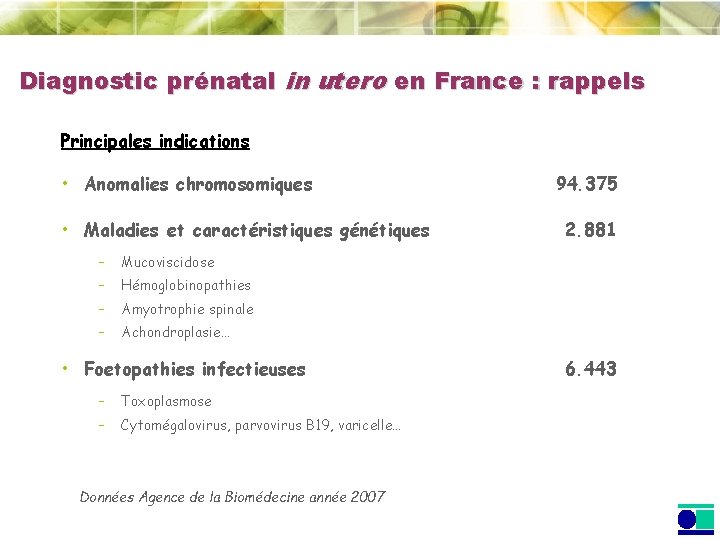
Diagnostic prénatal in utero en France : rappels Principales indications • Anomalies chromosomiques • Maladies et caractéristiques génétiques – Mucoviscidose – Hémoglobinopathies – Amyotrophie spinale – Achondroplasie… • Foetopathies infectieuses – Toxoplasmose – Cytomégalovirus, parvovirus B 19, varicelle… Données Agence de la Biomédecine année 2007 94. 375 2. 881 6. 443

Diagnostic prénatal in utero en France : rappels Diagnostic des anomalies chromosomiques : 94. 375 Indication • Age maternel ( 38 ans) 30. 677 • Marqueurs sériques 38. 377 Þ Soit de 345 à 690 pertes fœtales pour 895 trisomies 21 détectées Données Agence de la Biomédecine année 2007

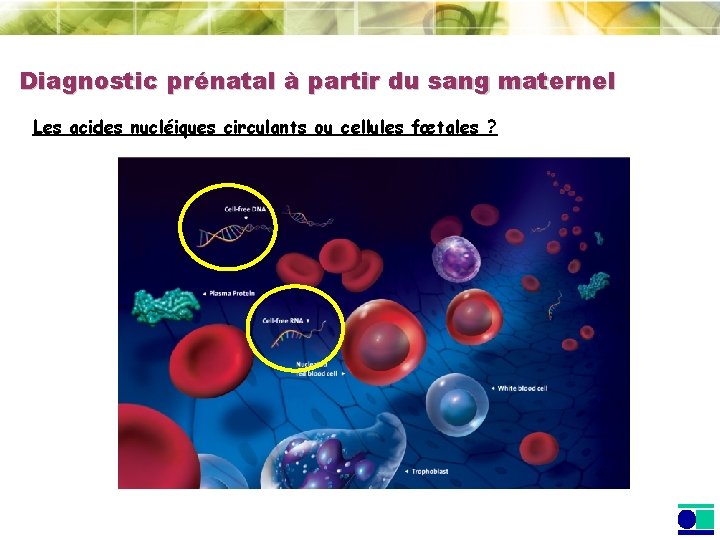
Diagnostic prénatal à partir du sang maternel Les acides nucléiques circulants ou cellules fœtales ?

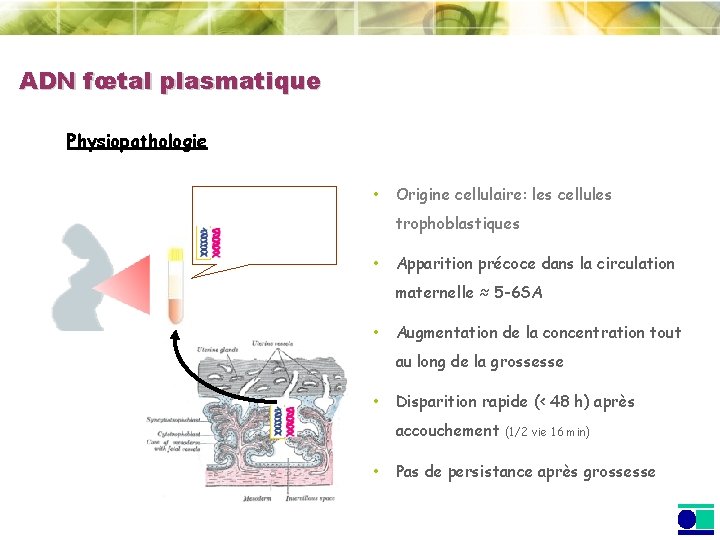
ADN fœtal plasmatique Physiopathologie • Origine cellulaire: les cellules trophoblastiques • Apparition précoce dans la circulation maternelle ≈ 5 -6 SA • Augmentation de la concentration tout au long de la grossesse • Disparition rapide (< 48 h) après accouchement (1/2 vie 16 min) • Pas de persistance après grossesse

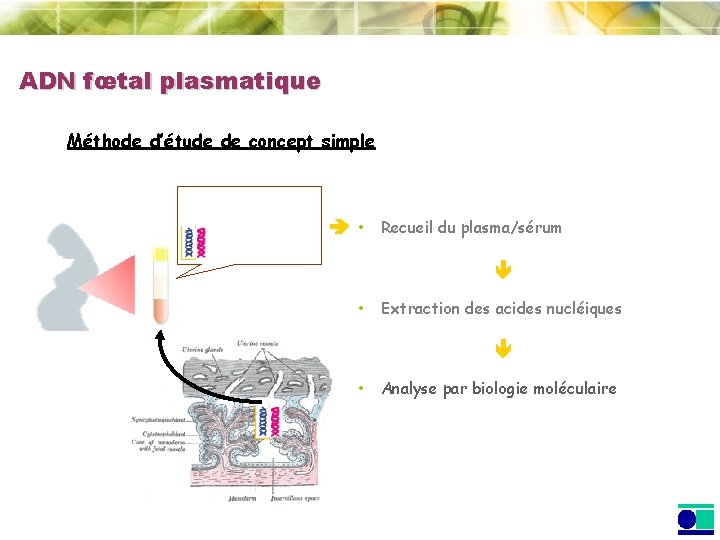
ADN fœtal plasmatique Méthode d’étude de concept simple • Recueil du plasma/sérum • Extraction des acides nucléiques • Analyse par biologie moléculaire

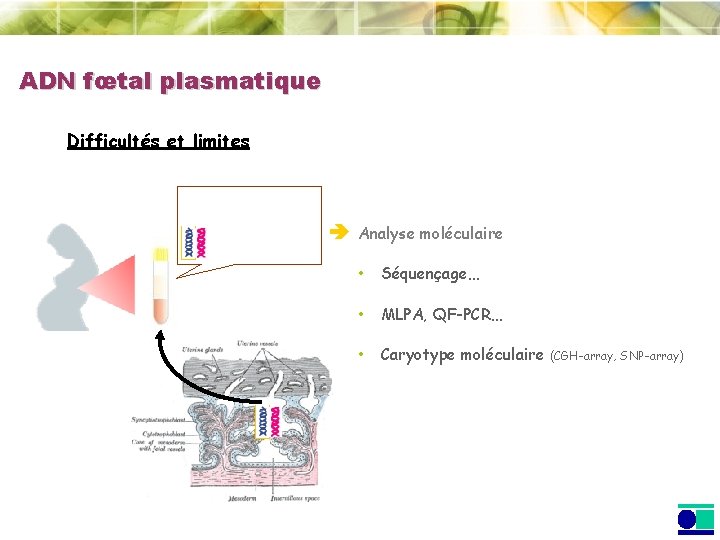
ADN fœtal plasmatique Difficultés et limites Analyse moléculaire • Séquençage… • MLPA, QF-PCR… • Caryotype moléculaire (CGH-array, SNP-array)

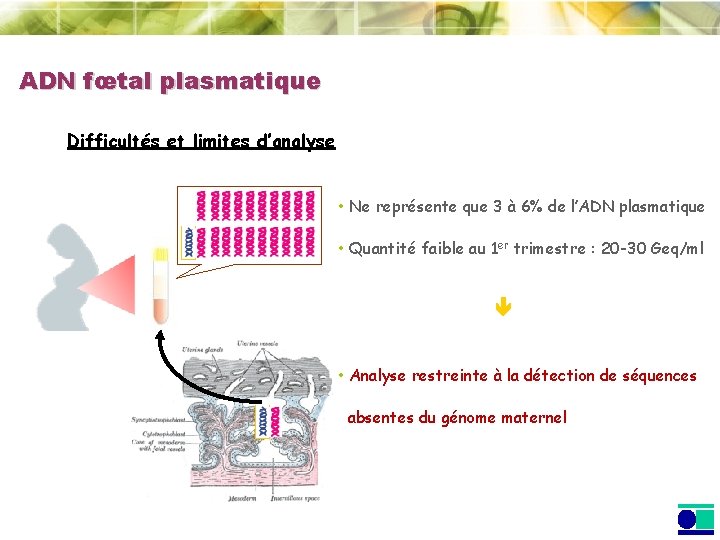
ADN fœtal plasmatique Difficultés et limites d’analyse • Ne représente que 3 à 6% de l’ADN plasmatique • Quantité faible au 1 er trimestre : 20 -30 Geq/ml • Analyse restreinte à la détection de séquences absentes du génome maternel

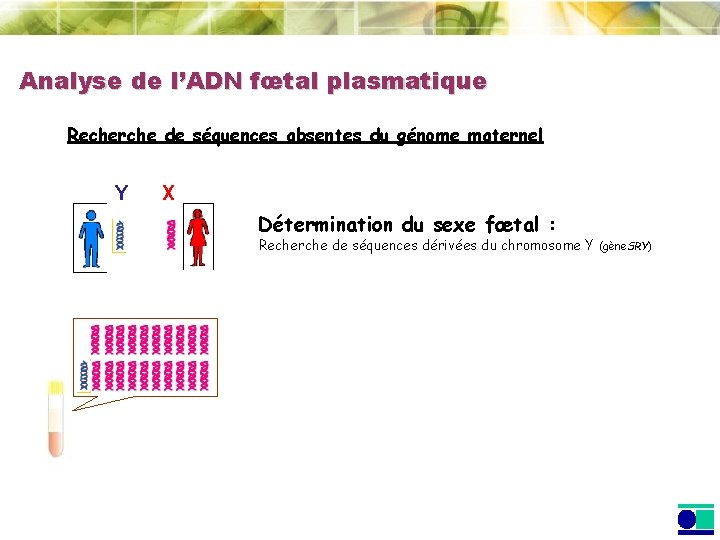
Analyse de l’ADN fœtal plasmatique Recherche de séquences absentes du génome maternel Y X Détermination du sexe fœtal : Recherche de séquences dérivées du chromosome Y (gène. SRY)

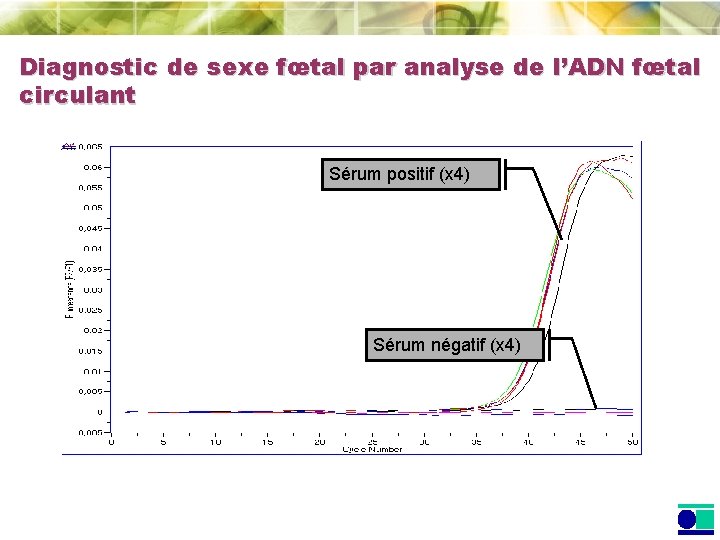
Diagnostic de sexe fœtal par analyse de l’ADN fœtal circulant Sérum positif (x 4) Sérum négatif (x 4)

Détermination du sexe foetal Intérêts – Maladies génétiques liées à l’X – – Hyperplasie congénitales des surrénales – – Eviter un geste invasif (CVS) chez les patientes conductrices qui portent un fœtus de sexe féminin (ne présentant aucun risque) (déficit en 21 -hydroxylase) Eviter le recours à un traitement corticoïde chez les patientes qui portent un foetus de sexe masculin (traitement inutile) Ambiguïtés sexuelles échographiques, discordances caryotypes/échographie – Aide à la prise en charge.

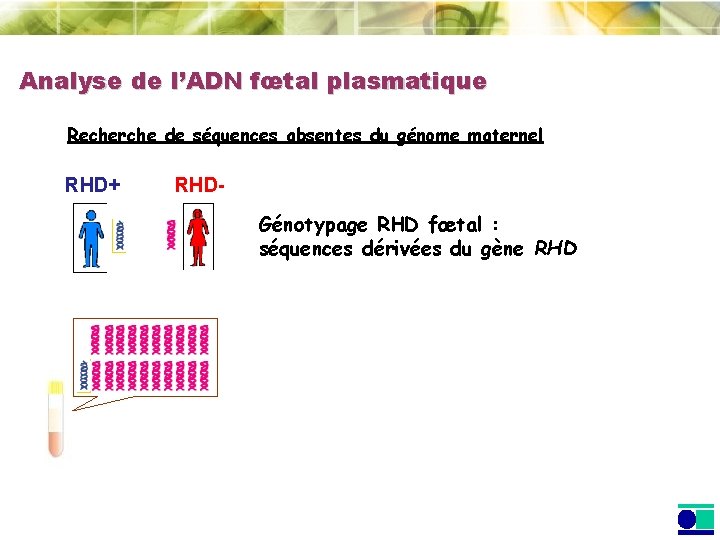
Analyse de l’ADN fœtal plasmatique Recherche de séquences absentes du génome maternel RHD+ RHDGénotypage RHD fœtal : séquences dérivées du gène RHD

Analyse de l’ADN fœtal circulant: application au génotypage RHD Les bases moléculaires du système rhésus 3’UTR Gène RHD Gène RHCE 98 % d’homologie au niveau nucléotidique 92 % d’homologie au niveau protéique

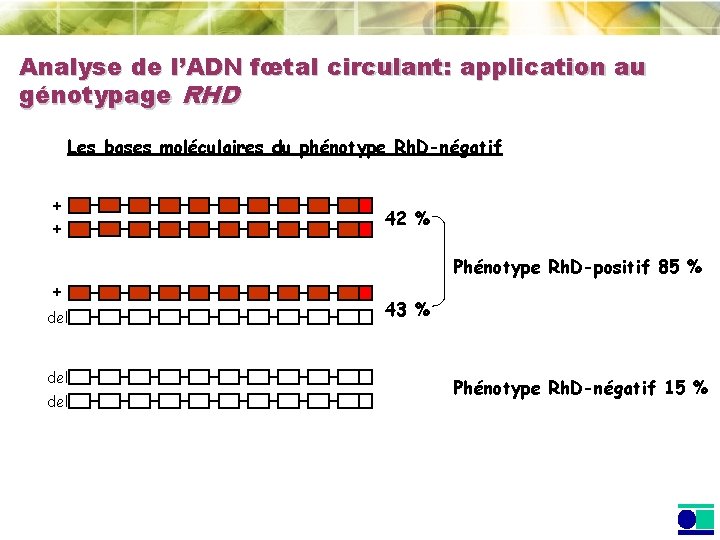
Analyse de l’ADN fœtal circulant: application au génotypage RHD Les bases moléculaires du phénotype Rh. D-négatif + + + del del 42 % Phénotype Rh. D-positif 85 % 43 % Phénotype Rh. D-négatif 15 %

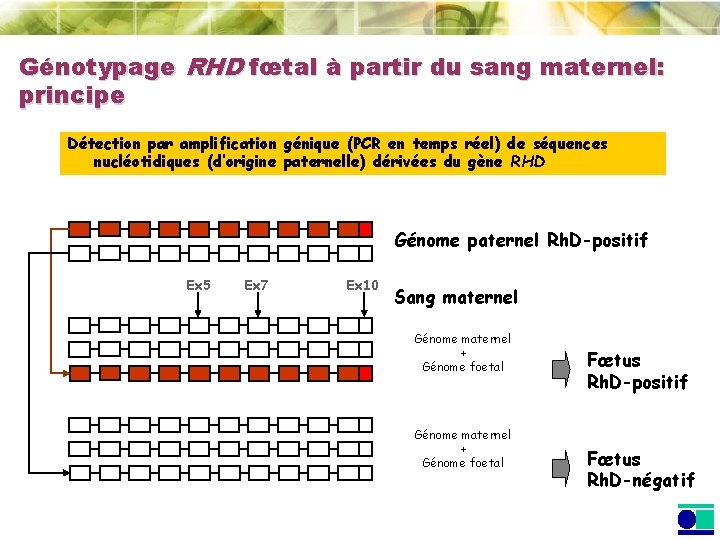
Génotypage RHD fœtal à partir du sang maternel: principe Détection par amplification génique (PCR en temps réel) de séquences nucléotidiques (d’origine paternelle) dérivées du gène RHD Génome paternel Rh. D-positif Ex 5 Ex 7 Ex 10 Sang maternel Génome maternel + Génome foetal Fœtus Rh. D-positif Fœtus Rh. D-négatif

Génotypage RHD fœtal non invasif Indications – Les patientes Rh. D-négatives allo-immunisées • – Eviter un geste invasif qui risque de réactiver l’immunisation Les patientes Rh. D-négatives devant subir un geste invasif • Eviter une prophylaxie anti-D inutile • Mise en place d’une prophylaxie immédiate Intérêt: environ 30% des fœtus sont Rh. D-négatifs o Limiter l’exposition à des produits dérivés du sang o Limiter l’utilisation des immunoglobulines (stocks limités) o Augmente la pertinence de la prophylaxie (Jones et al, BJOG 2004; 111: 8982 - 902). Pour éviter 1 cas d’allo-immunisation, il faut traiter: – 278 femmes en l’absence de génotypage – 166 femmes si le génotype fœtal RHD est connu positif

Diagnostic prénatal non invasif des maladies monogéniques (ou caractéristique génétique)? Un défi technologique majeur-1 ü Délétion/insertion, réarrangement complexe and expansion de triplets : IMPOSSIBLE (? ) ü Détection de mutation ponctuelle: ENVISAGEABLE … si développement de techniques sensible de détection de séquences minoritaires • Real-time PCR (PNA, allele-specific…) • PCR-d. HPLC • PCR-High Resolution Melting • PCR et primer extension (MALDI-TOF)….

Détection d’une population minoritaire d’allèle muté: exemple de la PCR-HRM Proportion de l’allèle muté au sein d’un background « sauvage » 5% 2. 5% 1% 0%

Analyse de l’ADN fœtal plasmatique Recherche de mutations ponctuelles chez le foetus Mutation de novo : achondroplasie Recherche de la mutation G 380 R du gène FGFR 3 Ce qui va changer ? (validation clinique en cours) • Complément à l’analyse échographique Ce qui pourrait se faire ? • • • Hypochondroplasie Nanisme thanatophore Syndrome d’Apert

Analyse de l’ADN fœtal plasmatique Recherche de mutations ponctuelles chez le foetus K 1 K 2 SNP paternel : génotypage KEL (K 1) Recherche du variant Thr 193 Met du gène KEL Ce qui va changer ? (validation clinique en cours) • Plus de recours à l’amniocentèse chez les patientes alloimmunisées pour évaluation fœtale Ce qui pourrait se faire ? • • • Génotypage plaquettaire (HPA 1…) Diagnostic des maladies autosomiques dominantes (paternelle) Test de paternité

Diagnostic prénatal non invasif des anomalies chromosomiques (trisomie 21)? Un défi technologique majeur-2 ü Remaniements chromosomiques complexes: IMPOSSIBLE (? ) ü Aneuploïdies (trisomie 13, 18 et/ou 21) : POSSIBLE … par quantification du nombre de chromosomes du fœtus : • Marqueurs non spécifiques • Marqueurs spécifiques du foetus: ARN (fœtaux) placentaires ou marqueurs épigénétiques

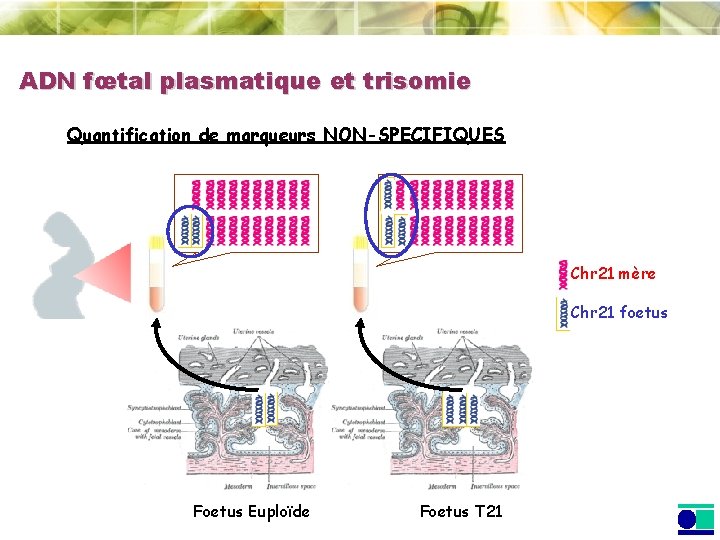
ADN fœtal plasmatique et trisomie Quantification de marqueurs NON-SPECIFIQUES Chr 21 mère Chr 21 foetus Foetus Euploïde Foetus T 21

ADN fœtal plasmatique et trisomie 21 Dosage chromosomique relatif (RCD) par Digital PCR

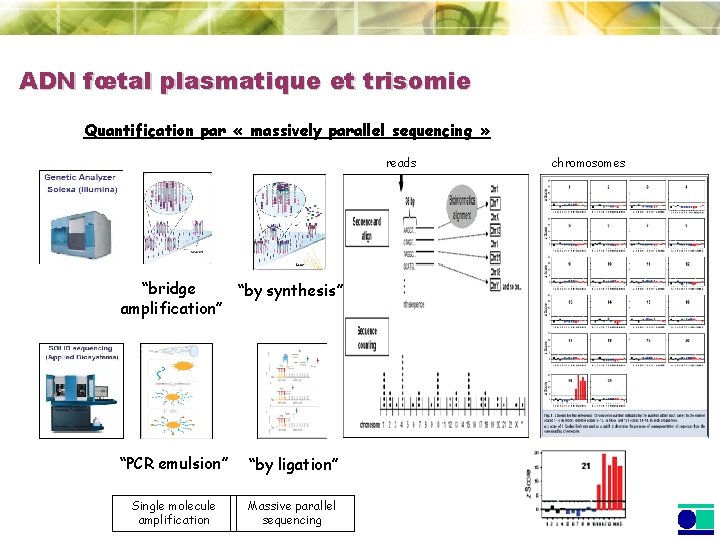
ADN fœtal plasmatique et trisomie Quantification par « massively parallel sequencing » reads “bridge “by synthesis” amplification” “PCR emulsion” “by ligation” Single molecule amplification Massive parallel sequencing chromosomes

ADN fœtal plasmatique et trisomie 21 Quantification par « massively parallel sequencing » 18 patientes (terme médian: 18 semaines) Tous les cas (9) correctement identifiés 15 patientes (terme médian: 14 semaines) Tous les cas (9) correctement identifiés

ADN fœtal plasmatique et trisomie 21 Quantification par « massively parallel sequencing » • Avantages • Démonstration pour la détection des trisomies 13, 18 et 21 • Approche indépendante de polymorphismes • Inconvénients • Coût et quantité de données générées (stockage) • En l’état actuel, formats inadaptés à un haut débit

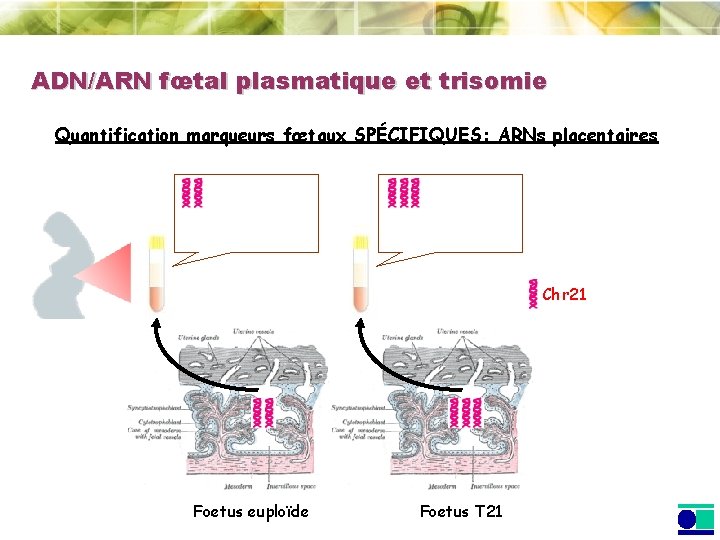
ADN/ARN fœtal plasmatique et trisomie Quantification marqueurs fœtaux SPÉCIFIQUES: ARNs placentaires Chr 21 Foetus euploïde Foetus T 21

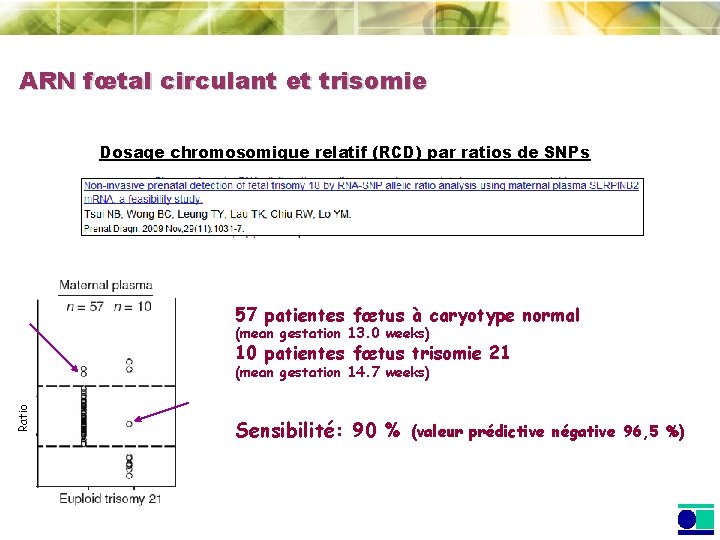
ARN fœtal circulant et trisomie Dosage chromosomique relatif (RCD) par ratios de SNPs Mass. ARRAY® (Maldi-Tof) ACGGGATAAATATCGACTC 5866. 8 Da T C CGGGATAAATATCGACTC 6035. 0 Da C CGGGATAAATATCGACTC 5762. 8 Da CGGGATAAATATCGACTC 5359. 6 Da

ARN fœtal circulant et trisomie Dosage chromosomique relatif (RCD) par ratios de SNPs 57 patientes fœtus à caryotype normal (mean gestation 13. 0 weeks) 10 patientes fœtus trisomie 21 Ratio (mean gestation 14. 7 weeks) Sensibilité: 90 % (valeur prédictive négative 96, 5 %)

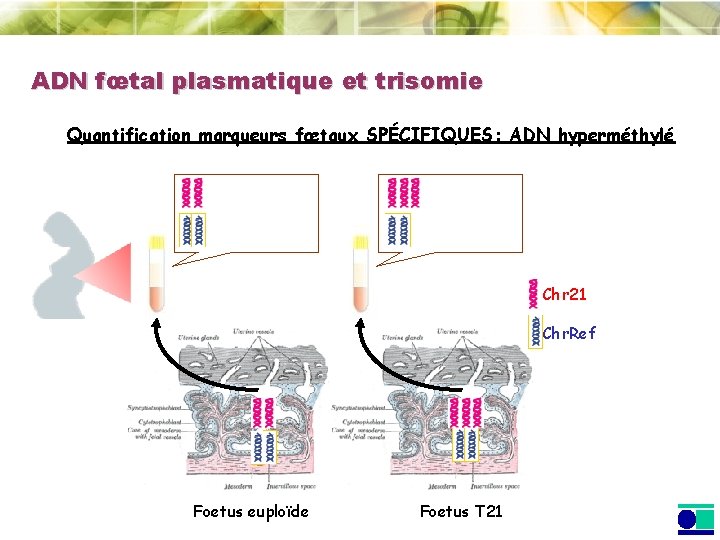
ADN fœtal plasmatique et trisomie Quantification marqueurs fœtaux SPÉCIFIQUES: ADN hyperméthylé Chr 21 Chr. Ref Foetus euploïde Foetus T 21

ADN fœtal plasmatique et trisomie 21 Quantification par dosage chromosomique relatif Ratio de HLCS /ZFY ADNs hyperméthylés 29 patientes (1 er, 2 nd and 3ème trimestre) Tous les cas (5) correctement identifiés

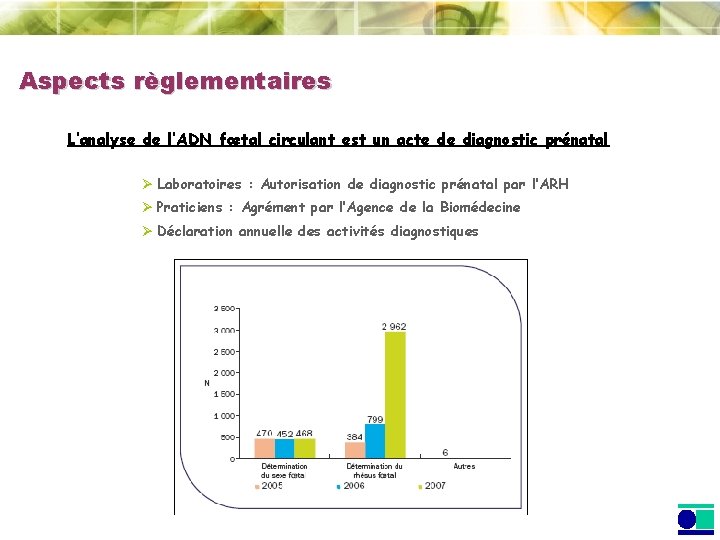
Aspects règlementaires L’analyse de l’ADN fœtal circulant est un acte de diagnostic prénatal Ø Laboratoires : Autorisation de diagnostic prénatal par l’ARH Ø Praticiens : Agrément par l’Agence de la Biomédecine Ø Déclaration annuelle des activités diagnostiques

 Qcm validation formation assistant maternel
Qcm validation formation assistant maternel Uri ng pagtatalo ng dalawang panig
Uri ng pagtatalo ng dalawang panig Schéma passage des nutriments dans le sang
Schéma passage des nutriments dans le sang Quand je suis frais je suis chaud
Quand je suis frais je suis chaud Merodiploides
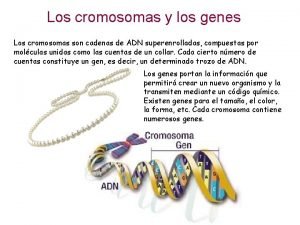
Merodiploides Cromosomas
Cromosomas Curvas cot adn
Curvas cot adn Nursing program glendale ca
Nursing program glendale ca Estructura del adn
Estructura del adn Adam and eve original sin lucas cranach the elder
Adam and eve original sin lucas cranach the elder Adn polymérase
Adn polymérase Adn
Adn Virus con arn
Virus con arn Sintesis de proteinas adn y arn
Sintesis de proteinas adn y arn Formula de adn
Formula de adn Adn
Adn Componenetes del adn
Componenetes del adn Arn mensajero
Arn mensajero Adn
Adn Transporte activo
Transporte activo Grados de compactacion del adn
Grados de compactacion del adn Los cromosomas contienen adn
Los cromosomas contienen adn Ros adn
Ros adn Fragmentos de okazaki
Fragmentos de okazaki Conclusión del adn
Conclusión del adn Ciclinas
Ciclinas Sintesis de proteinas adn y arn
Sintesis de proteinas adn y arn Desnaturalizacion del dna
Desnaturalizacion del dna Secuencias de insercion y transposones
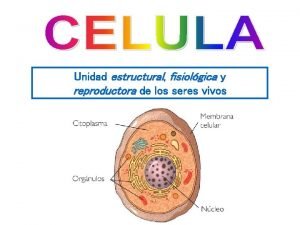
Secuencias de insercion y transposones Organelos celulares
Organelos celulares Bases nitrogenadas del adn
Bases nitrogenadas del adn Purification adn sur colonne de silice
Purification adn sur colonne de silice Información sobre la función del adn
Información sobre la función del adn Adn extracromosomico
Adn extracromosomico