A troposzfra s a sztratoszfra kmija elads Krnyezettudomny















![Sorozatos reakciók: koncentráció lefutások ezt kell tudni! Jellemzői: • [A]0=[A]+[B]+[C] • [A] exponenciálisan lecseng: Sorozatos reakciók: koncentráció lefutások ezt kell tudni! Jellemzői: • [A]0=[A]+[B]+[C] • [A] exponenciálisan lecseng:](https://slidetodoc.com/presentation_image_h/0ef605890fa72605f55f5b58308e543f/image-17.jpg)













![H 2 Br 2 reakció koncentráció-idő görbéi ( [H 2] : [Br 2] = H 2 Br 2 reakció koncentráció-idő görbéi ( [H 2] : [Br 2] =](https://slidetodoc.com/presentation_image_h/0ef605890fa72605f55f5b58308e543f/image-32.jpg)


![[H] számítása [Br] számítására van már egyenletünk: Egy-egy algebrai egyenlet a [H] és [Br] [H] számítása [Br] számítására van már egyenletünk: Egy-egy algebrai egyenlet a [H] és [Br]](https://slidetodoc.com/presentation_image_h/0ef605890fa72605f55f5b58308e543f/image-36.jpg)







- Slides: 45

A troposzféra és a sztratoszféra kémiája előadás Környezettudomány MSc hallgatóknak Kémiai folyamatok a légkörben előadás Meteorológia MSc hallgatóknak TT 1 előadás: A reakciókinetika alapjai Turányi Tamás ELTE Kémiai Intézet

Reakciókinetikai alapismeretek Reakciókinetika tárgya: Hogyan változnak a koncentrációk egy reaktív elegyben és miért? Milyen részlépésekből áll egy reakció? (Mi a kémiai reakciók mechanizmusa? ) Kémiai változások leírása sztöchiometriai (bruttó) egyenlettel: • megmutatja a reaktánsok és termékek arányát • általában nem játszódik le fizikailag 2 H 2 + O 2 = 2 H 2 O 0 = - 2 H 2 -1 O 2 + 2 H 2 O 1 = - 2 2 = - 1 3 = + 2 A 1 = „H 2” A 2 = „O 2” A 3 = „H 2 O” sztöchiometriai együttható: (reaktánsra negatív, termékekre pozitív elemek) Az anyagfajták sorrendje tetszőleges; A sztöchiometriai együtthatók szorzótényező erejéig határozatlanok

Reakciósebesség koncentrációváltozási sebesség: reakciósebesség: r független a j indextől, azaz bármelyik anyagfajta koncentrációváltozásával mérjük is, mindig ugyanazt az értéket kapjuk. [Aj] az Aj moláris koncentrációja [mól dm-3] kis koncentrációtartományban mindig igaz: k j reakciósebességi együttható reakciórend a j-edik anyagfajtára bruttó reakciórend

Sebességi együttható sebességi egyenlet: a reakciósebesség koncentrációfüggését leíró egyenlet gyakran felírható az alábbi alakban: k sebességi együttható a hőmérséklet és a nyomás függvénye (is lehet), de nem függ a koncentrációktól. Az j kitevő a reakció Aj anyagfajtára vonatkozó részrendje, a kitevők összege pedig a reakció bruttó rendje. j rend általában nem egyenlő a sztöchiometriai együtthatóval !!! Például a a reakció NO‑ra és H 2‑re vonatkozó részrendje rendre 2 és 1, a reakció bruttó rendje pedig 3

Összetett reakciómechanizmusok Szinte mindig sok reakciólépés játszódik le egyszerre: A reakciólépések lehetnek elemi reakciók, amik fizikailag így játszódnak le, de lehetnek több elemi reakció összevonásából kapott reakciólépések bal oldali sztöchiometriai együtthatók (pozitív) jobb oldali sztöchiometriai együtthatók (pozitív) sztöchiometriai együtthatók (az eddig is használt; negatív reaktánsokra, pozitív termékekre)

Kinetikai differenciálegyenlet-rendszer tömeghatás törvénye (Guldberg és Waage, 1865): ki ri i-edik reakciólépés reakciósebességi együtthatója i-edik reakciólépés sebessége Kinetikai differenciálegyenlet-rendszer: Egyes esetekben megadják az egyes ri reakciólépés-sebességek koncentrációfüggését. Általában csak a kémiai egyenleteket adják meg és kijelentik, hogy „teljesül a tömeghatás törvénye” vagy „tömeghatás-kinetikát követ” Ebben az esetben a fenti képlettel számítjuk ri –t.

Kinetikai differenciálegyenlet-rendszer: egy példa Chapman mechanizmus: ózonbomlás a sztratoszférában 1. 2. 3. 4. O 2 = O + O 2 = O 3 = O 2 + O O 3 +O = 2 O 2 k 1 k 2 k 3 k 4 A kinetikai differenciálegyenlet-rendszer: r 1 = k 1 [O 2] r 2 = k 2 [O] [O 2] r 3 = k 3 [O 3] r 4 = k 4 [O 3] [O]

Kinetikai diffegyenletrendszer tulajdonságai • Egy anyag koncentrációváltozási sebességére felírt differenciálegyenletrendszer csak elsőrendű deriváltat tartalmaz, ami a koncentrációk nem feltétlenül lineáris függvénye. elsőrendű nemlineáris differenciálegyenlet-rendszer • Mivel általában minden anyag több reakcióban is részt vesz, ezért anyagok koncentrációváltozásai erősen csatoltak. erősen csatolt • A reakciók sebessége igen sok nagyságrendet átfog. (légkörkémiában: 24) erősen merev • Légkörkémiai modellekben a reakciók sebességi állandói explicit módon függhetnek az időtől, a nyomástól, a hőmérséklettől és a napsugárzási viszonyoktól való függésük miatt. légkörkémiában nem autonóm • A valós folyamatok többnyire térben inhomogének, így a kémiai folyamatok mellett transzport és más fizikai folyamatokkal is számolni kell. parciális diffegyenlet-rendszer, kémiai forrástaggal

Kinetikai differenciálegyenletrendszer Tételezzük fel, hogy ismerjük • a reakciólépések kémiai egyenlet • a reakciólépés sebességének képletét A komponensek koncentrációinak időbeli változását a kinetikai differenciálegyenlet-rendszer felírásával és megoldásával adhatjuk meg. 1) Analitikus megoldás: Csak néhány, nagyon egyszerű esetben. Majdnem az összes alapesetet fogjuk tanulni. 2) Numerikus megoldás: Több tucat program letölthető a Webről, ami képes arra, hogy a kémiai egyenletek alapján felírja a differenciálegyenletrendszert numerikus megoldást készít, kiírja és kirajzolja az eredményeket.

Elsőrendű bomlás Koncentráció változása elsőrendű bomlás során: Hasonló a csökkenése a radioaktívan bomló anyag tömegének. Koncentráció – idő görbe: „exponenciális lecsengés” Linearizált ábrázolás: ln ([A]/[A]0) az idő (t) függvényében -k meredekségű, 0 tengelymetszetű egyenes

Elsőrendű bomlásban résztvevő anyag felezési ideje Semmilyen más reakció nem zajlik le, mint egyetlen elsőrendű reakció: A P Milyen ütemben csökken A koncentrációja? Mennyi idő múlva lesz fele a koncentráció? Elsőrendű reakció reaktánsának t 1/2 felezési idejét megkapjuk, ha a linearizált egyenletbe a koncentráció helyére [A]0/2 -t, az idő helyére t 1/2 -et helyettesítünk: Elsőrendű reakció reaktánsának felezési ideje § független a kezdeti koncentrációtól § nem változik időben

Másodrendű bomlás Koncentráció változása másodrendű bomlás során. Koncentráció – idő görbe: lecsengés, hasonlít az exponenciálishoz linearizált alak Linearizált ábrázolás: 1/[A] az idő (t) függvényében k meredekségű, 1/[A]0 tengelymetszetű egyenes

Másodrendű bomlásban résztvevő anyag felezési ideje Semmilyen más reakció nem zajlik le, mint egyetlen másodrendű reakció: Milyen ütemben csökken A koncentrációja? Mennyi idő múlva lesz fele a koncentráció? Másodrendű reakció reaktánsának t 1/2 felezési idejét megkapjuk, ha a linearizált egyenletbe a koncentráció helyére [A]0/2 -t, az idő helyére t 1/2 -et helyettesítünk: Másodrendű reakció reaktánsának felezési ideje § függ a kezdeti koncentrációtól § változik időben

Nemlineáris és lineáris megoldásfüggvények elsőrendű bomlás nemlineáris alak: c – t görbe másodrendű bomlás lineáris alak: ln c/c 0 vs. t görbe meredekség: –k tengelymetszet: 0 nemlineáris alak: c – t görbe lineáris alak 1/c vs. t görbe meredekség: +k tengelymetszet: 1/c 0

Sebességi együttható mértékegysége legyen a koncentráció egysége az idő egysége d c / d t = k M (mol dm-3), s (másodperc) cn (n = 1, 2, 3) M s-1 = ? M vagy M 2 vagy M 3 elsőrendű reakció másodrendű reakció harmadrendű reakció k mértékegysége: s-1 M-1 s-1 M-2 s-1

Sorozatos reakciók ezt nem kell tudni! A anyagfajta: B anyagfajta: C anyagfajta: reaktáns köztitermék (intermedier) végtermék
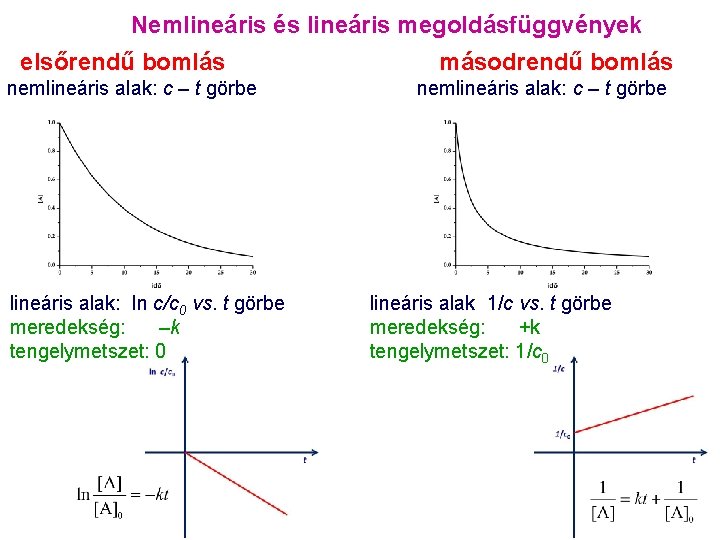
![Sorozatos reakciók koncentráció lefutások ezt kell tudni Jellemzői A0ABC A exponenciálisan lecseng Sorozatos reakciók: koncentráció lefutások ezt kell tudni! Jellemzői: • [A]0=[A]+[B]+[C] • [A] exponenciálisan lecseng:](https://slidetodoc.com/presentation_image_h/0ef605890fa72605f55f5b58308e543f/image-17.jpg)
Sorozatos reakciók: koncentráció lefutások ezt kell tudni! Jellemzői: • [A]0=[A]+[B]+[C] • [A] exponenciálisan lecseng: • [B] maximumgörbe: • [C] telítési görbe: • • [A]0 0 0 max 0 0 [A]0 a leggyorsabb a növekedése, ahol [B] a legnagyobb „babszár növekedési görbéje” [C] görbének inflexiós pontja van ott, ahol [B]-nek maximuma van

Párhuzamos reakciók koncentráció idő függvények: ezt kell tudni! Ha P és Q kezdetben nincs jelen a rendszerben, akkor P és Q koncentrációjának hányadosa mindig megegyezik a megfelelő sebességi állandók hányadosával! a sebességi állandók hányadosa megmérhető koncentrációk hányadosának mérésével!

Többcsatornás reakciók: speciális párhuzamos reakciók H+HO 2 2 OH (láncelágazás!) H 2+O 2 (lánclezárás !) H 2 O+O (láncelágazás!) az elágazási arány (branching ratio) változása a hőmérséklettel nagyon megváltoztatja a bruttó reakció lefolyását Gyakran megadják az összes csatorna együttes (bruttó) sebességi együtthatóját és külön az elágazási arányokat.

Elemi reakciók Elemi reakció: az A + B = C reakció nem csupán a sztöchiometriai viszonyokat jelenti, hanem a tényleges molekuláris történést is: 1 darab A részecske és 1 darab B részecske találkozott és ennek eredményeként a C részecskévé alakultak át. Az elemi reakciólépés sebessége mindig számítható a tömeghatás törvényével A reakcióban reagáló részecskék számától függően az elemi reakció lehet: unimolekulás reakció bimolekulás reakció trimolekulás reakció (1 részecske ütközik) Ilyen nincs is! (2 részecske ütközik) (3 részecske ütközik egyszerre) Trimolekulás reakció valójában nincsen. Igazából minden reakció bimolekulás! Unimolekulás reakció: kémiai átalakulás fényelés (A+h P) vagy nem-reaktív ütközés (pl. A + N 2 P + N 2) következtében.

Összetett reakciók Az összetett reakciók elemi reakciókból tevődnek össze. Az összetett reakciót előállító elemi reakciók összességét + a sebességi együtthatók hőmérséklet, nyomás és közegfüggésére vonatkozó képleteket reakciómechanizmus-nak nevezzük. Nagy, bonyolult mechanizmus nagy, bonyolult kinetikai differenciál-egyenletrendszer Kinetikai egyszerűsítő elvek segítségével a mechanizmus vagy a kinetikai differenciál-egyenletrendszer leegyszerüsíthető úgy, hogy a kapott mechanizmus/egyenletrendszer megoldása csaknem pontosan (pl. 1%-on belül) azonos a teljes mechanizmuséval. • • sebességmeghatározó lépés kvázistacionárius közelítés gyors előegyensúly nagy feleslegben alkalmazott reaktáns

Sebességmeghatározó lépés Sorozatos elsőrendű reakciólépések esetén a legkisebb sebességi együtthatójú reakciólépés a sebességmeghatározó és a végtermék keletkezési sebessége egyenlő a sebességmeghatározó lépés sebességi együtthatója és reaktánsa koncentrációjának szorzatával. k 1 k 2 k 3 k 4 k 5 A B C D E F Ha k 2<< k 1 , k 3 , k 4 , k 5 d [F]/d t = k 2 [B] Tetszőleges mechanizmus esetén az reakciólépés a sebességmeghatározó, amelyik sebességi együtthatójának kis megnövelésére a végtermék termelődési sebessége jelentősen megnő. Ez általában nem a legkisebb sebességi együtthatójú reakció!!!

Kvázistacionárius közelítés (quasi steady-state approximation (QSSA), Bodenstein-elv) A reakciómechanizmus anyagfajtái közül kiválasztunk egyes anyagokat, melyeket kvázistacionárius (QSSA) anyagoknak fogunk nevezni. Ezen anyagok koncentrációváltozását leíró differenciálegyenletek bal oldalát lenullázzuk, a maradék jobb oldalak egy implicit algebrai egyenletrendszert alkotnak, amely leírja hogyan függenek a QSSA anyagok koncentrációi a többi (nem-QSSA) anyagok koncentrációjától. A nem QSSA anyagokra vonatkozó differenciálegyenlet-rendszert és a QSSA anyagokra vonatkozó algebrai egyenletrendszert egyszerre megoldva az eredeti kinetikai differenciálegyenlet-rendszerrel csaknem azonos megoldást kapunk. Szerencsés esetben az algebrai egyenletrendszer külön is megoldható és a megoldást vissza lehet írni a nem-QSSA anyagok differenciálegyenlet-rendszerébe. A QSSA anyagok általában nagy reaktivitású és kis koncentrációjú anyagok, mint pl. a gyökök.

Kvázistacionárius közelítés alkalmazása k 1 k 2 A B C Ha k 1 << k 2 B ”QSSA anyag” A és C ”nem-QSSA anyag” d [B]/d t = k 1 [A] – k 2 [B] 0 = k 1 [A] – k 2 [B] = k 1/k 2 [A] tehát [B] kiszámítható [A] ismeretében

Gyors előegyensúly Ha egy gyors egyensúlyi reakció reaktánsait sokkal lassabb reakciók fogyasztják, akkor az egyensúlyi reakció reaktánsainak koncentrációját csak az egyensúly alapján meg lehet határozni, a többi reakció hatását itt nem kell figyelembe venni. k 1 k 3 A ⇄ B C K= k 1/k 2 ha k 3 << k 2 és d [B]/d t 0 (beállt egyensúly) k 1 [A] = k 2 [B] = k 1/k 2 [A] = K [A] d[C]/dt = k 3 [B] = k 3 K [A]

Nagy feleslegben alkalmazott reaktáns Ha az egyik reaktáns nagy feleslegben van, akkor a reakció során koncentrációja elhanyagolható mértékben változik és állandónak tekinthető. Ennek alapján pl. másodrendű reakciólépés elsőrendűvé alakítható át a nagy feleslegben alkalmazott reaktáns koncentrációjának a sebességi együtthatóba való beolvasztásával: ahol állandó. Például: A légkör (adott magasságban / adott nyomásnál) az O 2 koncentrációja állandó. Gyakran az O 2 koncentrációt beolvasztják a sebességi együtthatóba.

Anyagfajták egy mechanizmusban molekulák általában kevésbé reaktívak és emiatt hosszú élettartamúak példa: H-O-H, CH 4 gyökök általában reaktívak és emiatt rövid élettartamúak gyökök keletkezése: a reakció leszed egy atomot a molekuláról, vagy kettétörik egy molekula. Párosítatlan elektronpárt tartalmaz. példa: . O-H, . CH 3 VIGYÁZAT! Nem minden gyök nagyon reaktív! példa: a légkörben. HO 2, . NO 2 nem nagyon reaktív elektrongerjesztett molekulák és gyökök a legtöbb ilyen nagyon gyorsan visszatér alapállapotba Néhánynak hosszú az élettartama, mint pl. O(1 D) szingulett oxigénatom, „szingulett-D oxigénatom” M [M] = minden jelenlevő anyagfajta koncentrációjának összege

Élettartam 1. felezési idő: Ennyi idő alatt csökken a felére egy anyag koncentrációja, ha nem termelődik és az összes többi anyag koncentrációja változatlan. élettartam: Ennyi idő alatt csökken az e-ed részére egy anyag koncentrációja, ha nem termelődik és az összes többi anyag koncentrációja változatlan. Egyetlen elsőrendű reakció: A P Élettartam: Felezési idő: Több elsőrendű reakció (pl. fénygerjesztett részecske több úton reagál): A P 1 P 2 P 3 Élettartam:

Élettartam 2. légkörkémia: Pi termelő reakciólépések sebességének összege Li fogyasztó reakciólépések sebességének összege Ai koncentrációváltozási sebessége: Ai élettartama: A „fogyasztás” lehet kémiai (elreagál) vagy fizikai (kimosódik, megkötődik) Élettartam másik értelmezése: Egy légkörbe kerülő / légkörben keletkezett részecske várhatóan ennyi ideig létezik a légkörben. (Ez a várható érték; egy adott részecske persze hamarabb és később is kikerülhet / elreagálhat. )

Láncreakciók A láncreakciók lényege: láncindító reakciólépésben láncvivők (más néven aktív centrumok) keletkeznek, amelyek a láncfolytató reakciólépésekben a kiindulási anyaggal reagálva terméket és újabb láncvivőket hoznak létre, amelyekből azután újabb termékmolekulák és újabb láncvivők keletkeznek … Inhibíciós reakciólépés: a reakció a végterméket alakítja vissza, de a lánc nem szakad meg. Láncelágazási reakciólépés: a reakciólépésben egy láncvivőből több keletkezik. A láncvivők a lánczáró reakciólépésekben úgy reagálnak el, hogy nem termelnek a lánc továbbvitelére alkalmas anyagokat, ilyenkor egy‑egy lánc megszakad.

H 2 Br 2 reakció mechanizmusa (a) láncindítás: 1 (b) láncfolytatás: 2 3 (c) inhibíció: 4 (d) láncvégződés: 5
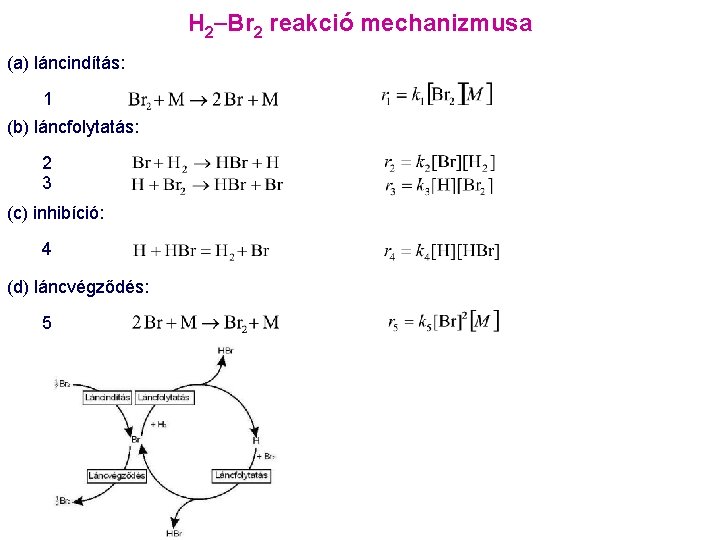
![H 2 Br 2 reakció koncentrációidő görbéi H 2 Br 2 H 2 Br 2 reakció koncentráció-idő görbéi ( [H 2] : [Br 2] =](https://slidetodoc.com/presentation_image_h/0ef605890fa72605f55f5b58308e543f/image-32.jpg)
H 2 Br 2 reakció koncentráció-idő görbéi ( [H 2] : [Br 2] = 1 : 1 elegy, T= 600 K, p= 1 atm )

Viszonylagos sebességek t = 1 másodpercben (minden sebességet r 1 -re normáltunk ) reakciólépések sebessége R 1 Br 2+M 2 Br+M R 2 Br+H 2 HBr+H R 3 H+Br 2 HBr+Br R 1 és R 5 sebessége << R 2 és R 3 sebessége 1, 0 R 1 sebessége = R 5 sebessége 100, 2 Kis HBr koncentrációnál: 100, 1 R 2 sebessége = R 3 sebessége R 4 H+HBr H 2+Br 0, 1 R 5 2 Br+M Br 2+M 1, 0 termelődési sebességek d[H 2]/dt -100, 1 d[Br 2]/dt -100, 1 d[HBr]/dt +200, 2 d[H]/dt +0, 0014 d[Br]/dt +0, 0026

A reakciólépések sebességének és a koncentrációváltozási sebességek viszonya 200, 2 = +100, 2 +100, 1 – 0, 1 0, 0014 = +100, 2 – 100, 1 – 0, 1 0, 0026 = 2, 0 – 100, 2 + 100, 1 + 0, 1 – 2, 0

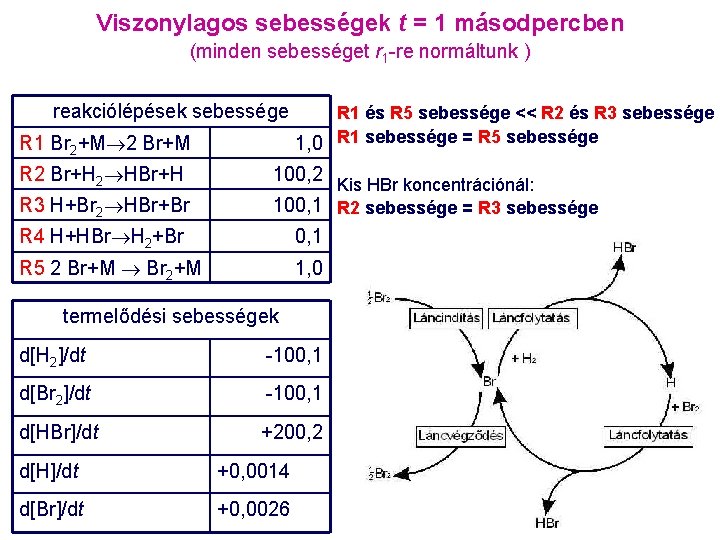
![H számítása Br számítására van már egyenletünk Egyegy algebrai egyenlet a H és Br [H] számítása [Br] számítására van már egyenletünk: Egy-egy algebrai egyenlet a [H] és [Br]](https://slidetodoc.com/presentation_image_h/0ef605890fa72605f55f5b58308e543f/image-36.jpg)
[H] számítása [Br] számítására van már egyenletünk: Egy-egy algebrai egyenlet a [H] és [Br] számítására:

HBr képződési sebességének számítása Behelyettesítés és átrendezés után: Ez azonos Bodenstein és Lind sebességi egyenletével: (ott tapasztalati k és k’ állandók szerepeltek) A reakció elején [HBr] közel nulla: A reakció részrendje H 2 -re 1, Br 2 -re 0, 5 a reakció bruttó rendje 1, 5

Kinetikai lánchossz Egy láncvivő átlagosan hány láncfolytató reakciólépésben vesz részt mielőtt egy láncvégző lépésben elfogyna? láncvivő fogyási sebessége a láncfolytató lépésben láncvivő fogyási sebessége láncvégző lépésben a kinetikai lánchossz t=1 másodpercben a H 2 Br 2 reakcióban, a vizsgált reakciókörülményeknél

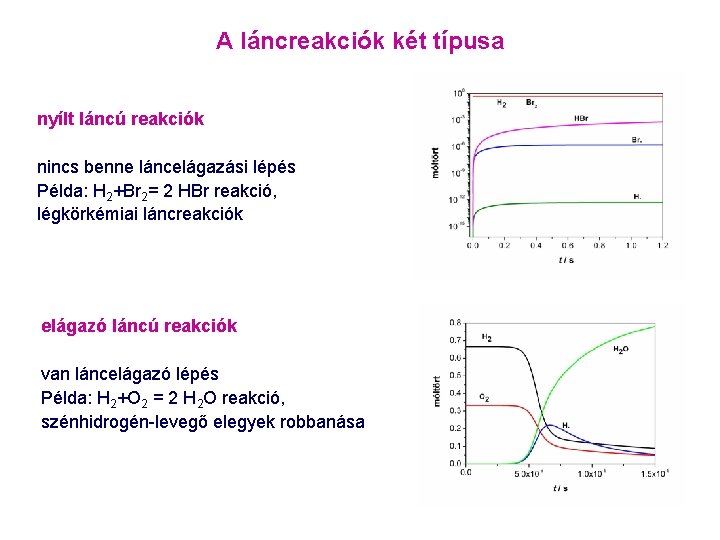
A láncreakciók két típusa nyílt láncú reakciók nincs benne láncelágazási lépés Példa: H 2+Br 2= 2 HBr reakció, légkörkémiai láncreakciók elágazó láncú reakciók van láncelágazó lépés Példa: H 2+O 2 = 2 H 2 O reakció, szénhidrogén-levegő elegyek robbanása

Arrhenius-ábrázolás A sebességi együttható hőmérsékletfüggését az empirikus Arrhenius‑egyenlet írja le: A Ea preexponenciális tényező aktiválási energia Ha több T hőmérsékleten megmérjük az adott reakció k sebességi állandóját, majd az ln k értékeket 1/T függvényében ábrázoljuk, akkor az Arrhenius‑egyenlet értelmében egyenest kell kapnunk, amelynek m = -Ea/R iránytényezőjéből Ea meghatározható. Arrhenius ábrázolás: Svante August Arrhenius (1859 – 1927) svéd vegyész

Termikus és fotokémiai reakciók Termikus reakció: a reakcióhoz nem kell fény; a legtöbb reakció ilyen. k reakciósebességi együttható függ(het) a hőmérséklettől. k reakciósebességi együttható általában növekszik a hőmérséklettel. Fotokémiai reakció: a reakcióhoz („A” molekula bomlásához) fény kell; sok száz ilyen légkörkémiai reakció van! j. A fotolízissebességi együttható függ a fény intenzitásától és hullámhossz eloszlásától. j. A fotolízissebességi együttható függ hőmérséklettől is! 1, 2 ezt a két hullámhossz-határt vesszük figyelembe „A” hatáskeresztmetszete ( és hőmérséklet függő ) „A” fotolízisének kvantumhatás-foka ( és hőmérséklet függő ) napfény (sugárzás) intenzitása (változik a hullámhosszal ! )

Reakciókinetikai adatbázisok: JPL http: //jpldataeval. jpl. nasa. gov/ JPL: Jet Propulsion Laboratory (Sugárhajtás Laboratórium) 1977 óta kb. kétévente új kiadása jelenik meg. Légkörkémiai reakciókinetikai (termikus- és fotokémiai reakciók állandói) és légkörkémiai anyagfajták termodinamikai (pl. képződési entalpiák) adatait tartalmazza. Heterogén kémiai reakciók adatai. A legutóbbi kiadvány: Chemical Kinetics and Photochemical Data for Use in Atmospheric Studies Evaluation Number 17 National Aeronautics and Space Administration Jet Propulsion Laboratory, California Institute of Technology Pasadena, California June 10, 2011

Reakciókinetikai adatbázisok: IUPAC http: //www. iupac-kinetic. ch. cam. ac. uk/ IUPAC: International Union of Pure and Applied Chemistry 1980 -óta rendszeresen új kiadások. Légkörkémiai reakciókinetikai és termodinamikai adatok gyűjteménye. 1) A fenti Web oldal: - kereshető adatbázis - rendszeresen felújítják - innen a „papír” kiadványok (cikkek) is letölthetők 2) „Atmospheric Chemistry and Physics” újságban („Atmos. Chem. Phys. ”) megjelent cikksorozat (2004 -2010) Tematikus kiadványok egy-egy reakciócsaládról.

Köszönöm a figyelmet

Az előadáshoz kapcsolódó számolási gyakorlat - kinetikai differenciálegyenlet-rendszer felírása a mechanizmus alapján - elsőrendű kinetikai példák megoldása - másodrendű kinetikai példák megoldása - felezési idő számítása - élettartam számítása - kvázistacionárius közelítés alkalmazása - kinetikai adatbázis (JPL, IUPAC) egy oldalának értelmezése