Fmek kmija Fmek fizikai s kmiai tulajdonsgai 2























- Slides: 26

Fémek kémiája Fémek fizikai és kémiai tulajdonságai 2

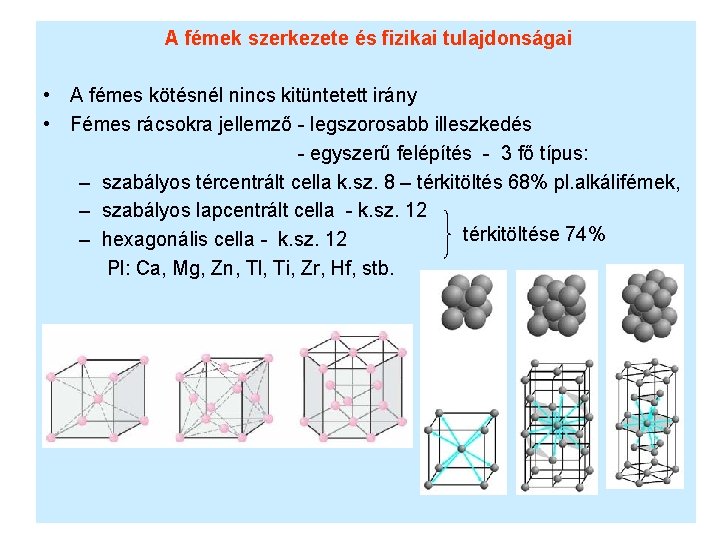
A fémek szerkezete és fizikai tulajdonságai • A fémes kötésnél nincs kitüntetett irány • Fémes rácsokra jellemző - legszorosabb illeszkedés - egyszerű felépítés - 3 fő típus: – szabályos tércentrált cella k. sz. 8 – térkitöltés 68% pl. alkálifémek, – szabályos lapcentrált cella - k. sz. 12 térkitöltése 74% – hexagonális cella - k. sz. 12 Pl: Ca, Mg, Zn, Tl, Ti, Zr, Hf, stb.

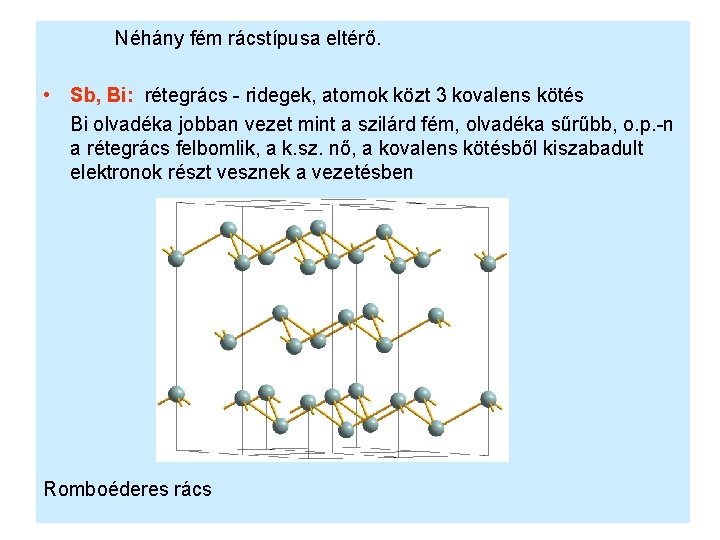
Néhány fém rácstípusa eltérő. • Sb, Bi: rétegrács - ridegek, atomok közt 3 kovalens kötés Bi olvadéka jobban vezet mint a szilárd fém, olvadéka sűrűbb, o. p. -n a rétegrács felbomlik, a k. sz. nő, a kovalens kötésből kiszabadult elektronok részt vesznek a vezetésben Romboéderes rács

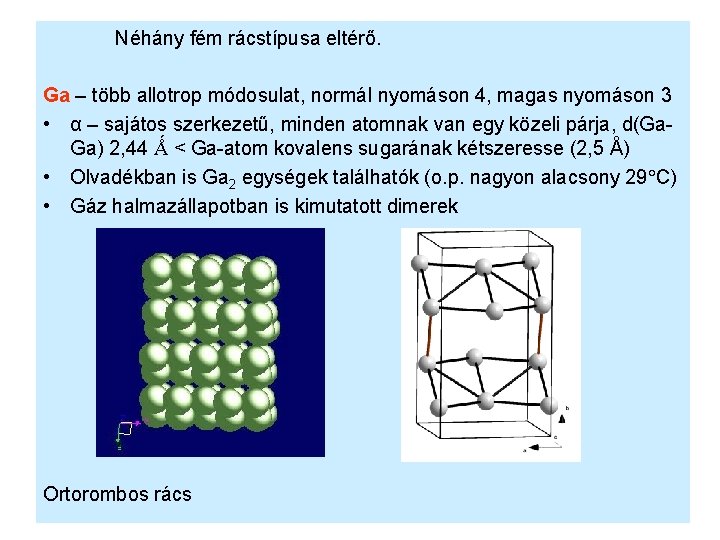
Néhány fém rácstípusa eltérő. Ga – több allotrop módosulat, normál nyomáson 4, magas nyomáson 3 • α – sajátos szerkezetű, minden atomnak van egy közeli párja, d(Ga. Ga) 2, 44 Ǻ < Ga-atom kovalens sugarának kétszeresse (2, 5 Å) • Olvadékban is Ga 2 egységek találhatók (o. p. nagyon alacsony 29 C) • Gáz halmazállapotban is kimutatott dimerek Ortorombos rács

Néhány fém rácstípusa eltérő. • Hg: rácsa romboéderes. • Sn: o közönséges hőmérsékleten stabilis módosulata (a fehér ón, β) tetragonális rendszerben kristályosodik – az ónatom egy torzult tetragonális bipiramis központjában van, k. sz. 4+2 o alacsony hőmérsékleten a szürke ón (α módosulat) stabil, kristályrácsa gyémánt-rács, k. sz. 4

• A fémek főleg elektromos, optikai és mechanikai tulajdonságaikban különböznek a nemfémes elemektől. • Vezetőképesség - fémes rácsok legfontosabb jellemzője, jól vezetik az elektromos áramot és a hőt • A vezetőképességet a fémes rácsban szabadon elmozduló "elektrongázra" vezethetjük vissza. • áramot az elektronok vezetik, a fémek elsőrendű vezetők • A rácspontokban levő atomtörzsek nem vesznek részt a vezetésben, hőmozgásukkal bizonyos mértékben akadályozzák azt, ezért magasabb hőmérsékleten a fémek elektromos ellenállása nagyobb, igen alacsony hőmérsékleten (az abszolut nulla fokhoz közeledve) egyes fémek esetében hírtelen erősen lecsökken az ellenállás, megnő a vezetőképesség (szupravezetés). • Félfémeknél a helyzet fordított, melegítés hatására nő a vezetőképesség


Optikai tulajdonságok • Fémfényűség - általában tömör, összefüggő felületen - sima felület tükröző, finom porok feketék (Pt-korom). • Szín - általában szürkésfehér - a fényt legjobban visszaverők fehérek (ezüstfehér), a többet elnyelők szürkék (acélszürke, ólomszürke). Kivétel: Cu - vörös színű, Au – sárga • fémek színét a felületükön kialakuló vékony oxidréteg befolyásolja, pl. króm kékes, az ólom szürkés. • Nagy fényelő képesség - átlátszatlanok, az igen vékony fémhártyák áttetszőek, rendkívül vékony fémrétegek (kb. 10 -6 cm) átlátszóak.

Mechanikai tulajdonságok • képlékenység: hengerelhető, nyújtható, forgácsolható. • kis erő hatására a kristály rácssíkjai egymáson elcsúszhatnak anélkül, hogy kötési állapotuk megváltozna - mérsékelt alakváltozásra a fémek rugalmasak, nagyobb erő hatására maradó alakváltozás • periodikusan változó fizikai tulajdonságok ha figyelembe vesszük szilárd állapotban a rácstípust • fémek sűrűsége szilárd állapotban széles határok között változik (Li 0, 53 g cm-3, Os 22, 6 g cm-3) könnyűfémek < 5 g cm-3 < nehézfémek • o. p. és f. p. értékek (általában) magasabbak a nemfémeknél, • O. p. s- és p-mező fémei < o. p. átmenetifémek (kivétel Hg, o. p. 38, 48 C)

• Az alkáli- és alkáliföldfémek o. p. értékei a csoportokban a rendszám növekedésével csökken, az átmenetifémek esetében nő. • A fémek o. p. -al párhuzamosan változik a keménységük. • A fémek kémiai tulajdonságai • fémek - kis elektronegativitás – reakciókészség - nagy különbség • A levegő oxigénjével, vízzel különbözően reagálnak: • alkálifémek, tipikus alkáliföldfémek reakcióképesek - levegőn nem tarthatók oxid-, karbonátréteggel vonódnak be (Li, Ca nitridréteg) • nemesfémek (Ag, Au, Pt, Pd, Rh, Ir, Ru, Os) nem oxidálódnak levegőn • p-mező fémei 1, 5 < EN < 2, 0 - felület vékony, tömör oxidréteggel vonódik be, vízzel szemben ellenállók

Osztályozás - reakció savakkal és vízzel: • legnegatívabb standardpotenciálú fémek (alkálifémek, alkáliföldfémek): Na + H 2 O = Na. OH + 1/2 H 2 • hidrogénnél negatívabb standard-elektródpotenciálú fémek: Zn + 2 HCl = Zn. Cl 2 + H 2 • hidrogénnél pozitívabb standard-elektródpotenciálú fémek: 3 Cu + 8 HNO 3 = 3 Cu(NO 3)2 + 2 NO + 4 H 2 O • legpozitívabb standardpotenciálú fémek (Ir, Pd, Pt, Au) királyvízben oldódnak: 3 Au + 3 HNO 3 + 12 HCl = 3 H[Au. Cl 4] + 3 NO + 6 H 2 O

• A negatívabb standardpotenciálú fémek a pozitívabbakat vegyületeikből felszabadítják: Cu. SO 4 + Fe = Fe. SO 4 + Cu • reakciót az oldatban levő komplexképzők befolyásolhatják • egyes fémek a levegő oxigénjével, vagy tömény oxidáló savakkal passziválódnak - nem mutatják standardpotenciál-értékük alapján várt tulajdonságaikat - Pl. Fe, Ni, Al, Cr és a Ta • Negatív standardpotenciál érték alapján kellene oxidálódjanak, de a felületi oxidréteg miatt ellenállók levegővel, nedvességgel • A passzivitás mértéke függ a fém minőségétől és az oldat összetételétől • a passzív állapot megszüntethető, ha felület redukáló hatás éri

• A p-mező fémeinek nagy része (Al, Ga, In, Sn, Pb) lúgokban is oldódik - amfoter jelleg: Sn + 2 Na. OH + 2 H 2 O = Na 2[Sn(OH)4] + H 2 • A fémek nagy része több oxidációs számmal rendelkezhet, ugyanazon fém különböző oxidációs számú vegyületei eltérő sajátságúak • s-elektronok inertsége a periódusos rendszer egy-egy csoportján belül a rendszám növekedésével nő ■ Al csak magas hőmérsékleten lehet egyvegyértékű, Tl a +1 oxidációs számú vegyületek az állandóbbak ■ Sn(IV) stabilisabb mint az Sn(II), Pb a +2 oxidációs számú vegyületei állandóbbak. • d-átmenetifémek oxidációs száma egységenként változhat • EN 1, 3 és 2, 2 között változik, várható, hogy vízzel reagáljanak, a felületi oxidréteg csökkenti reakciókészségüket.

• nemesfémek kémiai behatásokkal szemben ellenállóak • lantanoidák: legstabilisabb oxidációs száma +3 - az (n-1)d 1 ns 2 • ionizációs energiájuk és ionsugaruk gyakorlatilag egyenlő, ezért kémiai tulajdonságaik nagyon hasonlóak • s-mező elemeinél kisebb reakciókészségük a felületi oxidréteg miatt • aktinoidáknál - ionizáció következhet be az f-pályán is, kialakulhatnak +3 -nál nagyobb oxidációs számok • Aktinoidák kémiai tulajdonságai - nagyobb változatosságot mutatnak

Mágneses tulajdonságok • Természetes állapotukban az anyagok kevés kivétellel nem mutatnak mágneses sajátságot • Külső mágneses tér hatására minden anyagban mágneses momentum indukálódik • Mágneses térbe helyezett homogén testek a mágneses tér irányával párhuzamosan vagy rá merőlegesen állnak be • Diamágneses anyagok a mágneses erővonalakat magukból kiszorítják, a paramágneses anyagok magukba sűrítik • H erősségű mágneses tér hatására létrejövő mágnesezettség: M = χ H, χ - térfogati mágneses szuszceptibilitás

A fémek korróziója • A fémek korróziója olyan folyamat, mely során a fémek “szétbomlása” következik be a környező közeg hatására. • A korrózió szabadenergia csökkenéssel jár, önként végbemenő, nem kívánatos folyamat. • azok a fémek korrodálódnak, melyek nem fordulnak elő elemi állapotban, csak ásványok és ércek alakjában. • Fémek korróziója 3 fő típusú lehet: • kémiai, • biokémiai • elektrokémiai

• kémiai korrózió - önként végbemenő folyamat, alapját magas hőmérsékleten, agresszív gázok hatására végbemenő heterogén kémiai reakciók képezik • Ide tartoznak olyan folyamatok is, amikor kizárt a nedvesség, a fém oldódása szerves, nem vezető közeggel való érintkezéssel valósul meg. • biokémiai korrózió (biokorrózió) - különböző mikroorganizmusok életműködése miatt lép fel - a fémet tápanyagként használják, vagy olyan anyagokat termelnek amelyek a fémeket támadják. • Általában a biokorrózió rátevődik más korróziós folyamatokra Kialakulásához bizonyos összetételű talajok, állóvizek vagy különböző szerves vegyületek kedvező feltételeket teremthetnek.

• elektrokémiai korrózió elterjedtebb és veszélyesebb fémek és ötvözetek felületén elektrolitok jelenlétében megy végbe a következő reakciók alapján: - anódtérben: M + n H 2 O → Mx+·n. H 2 O + x e 6 H 2 O → O 2↑ + 4 H 3 O+ + 4 e- katódtérben: H+ redukciója savas közegben víz jelenlétében az oxigén hidroxidionokká átalakulása 2 H+ + 2 e - → H 2 O 2 + 2 H 2 O + 4 e- → 4 OH-

• elektrokémiai korrózió értelmezésére két elméletet dolgoztak ki: galvánelemek lokálelemek (helyi elemek) működésével • Technológiai készülékek számos korróziós folyamata magyarázható galvánelemek kialakulásával. • A korróziós folyamatok hasonlóak lehetnek a Daniell-elemben végbemenő elektrokémiai reakciókhoz - 2 különböző fém 2 különböző elektrolittal érintkezik, az anódként szereplő fém oldódik, a katódra fém válik ki • Más esetben a koncentrációs elemekhez hasonlóak - azonos elektródokat olyan elektrolit-oldatok vesznek körül amelyeknek koncentrációjuk, hőmérsékletük, oxigéntartalmuk, áramlási sebességük különböző • Különböző standard-elektródpotenciálú fémek érintkezésekor helyi elemek képződnek • A fémek nagy része levegőn kis mértékben oxidálódik, nedves felületen jelen vannak pozitív töltésű ionjaik is. Helyi elemek alakulhatnak ki - az oxidáció a negatívabb standard-elektródpotenciálú fémen megy végbe.

• vas és ón érintkezési felületén, víz jelenlétében a vas oxidálódik, oldódik - az ónbádog sérült bevonata elősegíti a vas korrózióját. • cink és vas érintkezésénél viszont a negatívabb standardpotenciálú Zn oxidálódik, így a Zn-bevonat védi a vasat a korróziótól. • Az elektrokémiai korrózió végbemehet: – Gázatmoszférában, a fém felületére víz kondenzálódott (atmoszférikus korrózió) – oldatokban (folyadékkorrózió) – talajban (talajkorrózió) • Az elektrokémiai korrózió a roncsolás jellegétől függően lehet: ▪ általános - a korrózió az egész fémfelületet érinti, ▪ helyi – a korrózió a felület bizonyos részeire lokalizálódik: • szálas vagy pontalakú (pitting korrózió), • szelektív korrózió - érinthet csak egy komponenst, • transzkrisztallitos korrózió - áthaladhat szűk repedéseken • interkrisztallitos - érintheti a különböző fázisok határait

A korrózió sebességét és jellegét a fém és a fémet körülvevő közeg határozza meg ▪ agresszív és ▪ nem agresszív közegek • A védelem különböző módjai: • korrózióálló anyaggal vonják be a védendő fémet • korrózióállóságot a felületen kialakuló tömör, kémiailag ellenálló, jól tapadó védőréteg valósítja meg • A védőbevonatok lehetnek: – fémes - fém bemártásával olvadt bevonó fémbe (horganyozás, ónozás, alumíniumozás, ólmozás), lemezeléssel, porlasztással (vas, acél, alumínium, réz stb. ), diffúzióval (alitálás, kromálás) valamint galvanizálással (rezezés, nikkelezés, krómozás) – nemfémes védőbevonatok • szervetlen bevonatok (foszfát, oxidbevonat, zománc, cement) • szerves bevonatok (festék- és lakkbevonat, műanyag) • Fémek korrózióállósága növelhető ötvözéssel

• korrózióvédelem megvalósítható elektromos módszerrel - fém elektrokémiai sajátságainak polarizációs áram hatására bekövetkező változásain alapszik • Legelterjedtebb a fémeknek katódos polarizációval való védése, mely során a fém potenciálját elektronegatívabb értékek felé tolják el • A katódos polarizáció megvalósításához vagy külső áramkört használnak fel vagy makro galvánelemet alakítanak ki egy kevésbé nemes fémmel (alumínium, magnézium, cink, ötvözetek).

• Diamágneses anyagok: • Paramágneses anyagok: χ < 0 negatív, χ > 0 pozitív • Kritikus hőmérsékleten (Curie-pont, Neél-pont) egyes paramágneses anyagoknál megjelennek a mágnesesség rendezett formái: • ferromágnesesség • antiferromágnesesség • ferrimágnesesség • metamágnesesség. • diamágneses anyagok - nem rendelkeznek permanens mágneses momentummal • páros számú elektront tartalmazó atomok és molekulák • A szuszceptibilitás értéke nem függ a hőmérséklettől, de függ az elektronok számától és az elektronpálya sugarától.

• Paramágneses anyagok - külső mágneses tértől függetlenül is rendelkeznek saját mágneses momentummal, egy vagy több párosítatlan elektronjuk van, mágneses momentumuk eredője ≠ 0 • Külső mágneses tér hatására a részecskék mágneses tengelyei az erővonalakkal párhuzamosan helyezkednek el - ez az orientáció az anyagi sajátságok és a térerősség mellett függ a hőmérséklettől is. • hőmozgás a rendeződést akadályozza, szuszceptibilitás fordítottan arányos a hőmérséklettel. • Ferromágnesesség a paramágnesesség egy partikuláris esete • Egyes anyagok alacsony hőmérsékleten átalakulást szenvednek, a párosítatlan spinek nagy tartományon belül (Weis-domének) párhuzamosakká válnak - külső tér hatására a domének nőnek, végül beállnak a külső tér irányába. • Ez a mágneses állapot hőközléssel, ötvözéssel, a külső tér megszűnése után is stabilizálható → permanens mágnes előállítása

• hőmérséklet emelésével csökken a doménekben a rendezettség, anyagra jellemző hőmérsékleten (Curie-pont) a ferromágnesesség megszűnik → anyag paramágneses • Pl. Fe, Co, Ni, Gd, Dy, ezek ötvözetei, spinell típusú kettős oxidok MO·Fe 2 O 3 M = Mn, Fe, Co, Ni, Cu, Mg, a Mn intermetallikus vegyületei (Mn. As, Mn. Bi, Mn. B stb. ) • Antiferromágnesesség: alacsony hőmérsékleten (Néel pont) - a részecskék mágneses momentumai két ellentétesen beálló párhuzamos rácssíkot képeznek, egymást kompenzálják - a hőmérséklet növelésével a rendezettség megszűnik → paramágneses • Ferrimágneses: atomok mágneses momentumai antiparalell beállásúak, de nem egyenlő nagyságúak → eredőjük nem nulla. • Metamágnesesség - Fe, egyes Mn-sók, Mn-ötvözetek (Mn. Au 2, Mn. As), lantanidák stb. ; • a részecskék mágneses momentumai helikoidálisan helyezkednek el a kristályrács egy szimmetria tengelye körül - alacsony hőmérsékleten, szűk hőmérséklet intervallumban, pl. a Dy 85 - 179 K

• A mágneses szuszceptibilitás kísérleti meghatározásánál mérik az inhomogén mágneses térben levő anyagra ható erőt • Mérés a Gouy- vagy a Faraday-módszerrel • Berendezés: érzékeny mérleg - egyik karjára függesztik a vékony henger alakú mintát úgy, hogy a minta egy mágnes pólusai között legyen • A vizsgálandó minta tömegét mágneses tér mentes állapotban kiegyenlítik, majd mérik a mágneses tér hatására bekövetkező látszólagos tömegnövekedést (paramágneses anyag) vagy tömegcsökkenést (diamágneses anyag). • A mérleget ismert szuszceptibilitású anyagra kalibrálják.