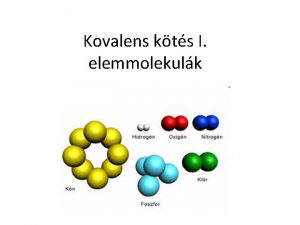
A kovalens kts I ra Kts azonosan nagy











- Slides: 13

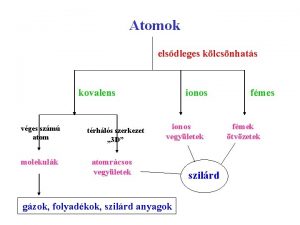
A kovalens kötés I. óra Kötés azonosan nagy elektronvonzó-képességű atomok között.

Stabilizáció • Mely atomok szerkezete stabil? A nemesgázoké. • Hogyan érhetik el ezt az állapotot az atomok. Elektron leadással, vagy elektron felvétellel. • Elektron leadás csak mikor jöhet létre? Ha van a közvetlen közelében egy olyan atom ami a leadott elektront felveszi.

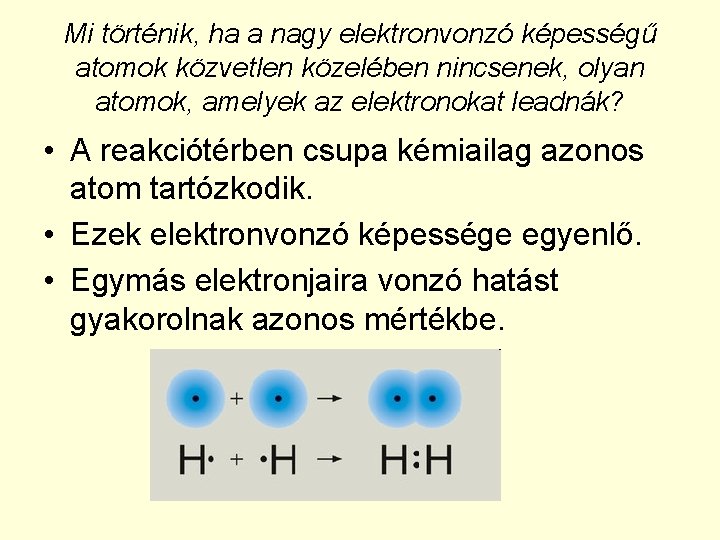
Mi történik, ha a nagy elektronvonzó képességű atomok közvetlen közelében nincsenek, olyan atomok, amelyek az elektronokat leadnák? • A reakciótérben csupa kémiailag azonos atom tartózkodik. • Ezek elektronvonzó képessége egyenlő. • Egymás elektronjaira vonzó hatást gyakorolnak azonos mértékbe.

Milyen kémiai részecske jött létre? • • Az új részecske kémiailag semleges. Több atommagból áll. Egyetlen, közös elektronrendszere van. A részecskét egy elektronpár tartja össze. A kialakuló kémiai részecske a MOLEKULA A molekulát összetartó erő a kovalens kötés.

Mi a kovalens kötés? • Két atom között közös elektronpárral kialakuló kapcsolat a kovalens kötés. • A kovalens kötés erős, elsőrendű kémiai kapcsolat. • A kötést létrehozó elektronpárt kötő elektronpárnak nevezzük. • Ha két atom között a kapcsolatot egy elektronpár hozza létre, egyszeres kovalens kötésről beszélünk.

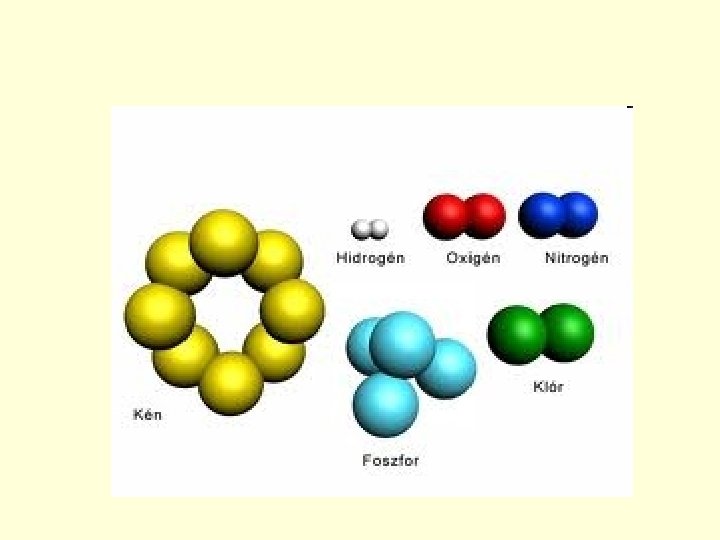
Mi történik ha a kapcsolódó atomoknak egynél több vegyértékelektronja van? • Hány külső elektronja van a klór atomnak? 7 • Rajzoljuk fel! • Hány külső elektronnak van párja? 6 -nak, 3 pár • Hány külső elektronnak nincs párja? 1 -nek A kötésben részt nem vevő elektronpárokat nemkötő-elektronpároknak nevezzük. + • Hány elektront kell közössé tenni, hogy egy atommaghoz 8 külső elektron tartozzon? 1 -et. • Milyen kötés jön létre? Egyszeres kovalens kötés.

A szerkezeti képlet • A szerkezeti képlet kifejezi a kapcsolódó atomok minőségét, számát és a kapcsolódás módját! • Az elektron párokat két pont helyett egy vonalkával is jelölhetjük: Cl Cl • Ez a klórmolekula.

Mi történik akkor, ha egy elektron közössé tétele nem elegendő? • Hány külső elekrtonja van az oxigénnek? 6 Ezek közül hány a párosított? 4, azaz 2 pár Hány a párosítatlan? 2 A 6 vegyérték elektronhoz hány elektronra van még szükség, hogy 8 legyen? 2 -re.

Az oxigén molekula kialakulása • Az oxigén atomok két párosítatlan elektronjukat közössé téve hozzák létre az atomkapcsolatot. O· + · O · · = O=O Ha két atom között két elektronpár tart kapcsolatot kétszeres kovalens kötésről beszélünk.

A nitrogén atomnak hány külső elektronja van? 5 Ebből hány párosított? 1 pár (2 db) Hány párosítatlan vegyérték-elektronja van? 3 Hány elektronra van még szüksége, hogy elérje a 8 külső elektronos szerkezetet? 3 -ra.

A nitrogén molekula kialakulása. • A nitrogén atomok ezt a 3 külső párosítatlan elektronjukat közössé téve hozzák létre a stabil szerkezetet. · N· · + ·N· · = N N • Azt az atomkapcsolatot melyet 3 közös elektronpár hoz létre, háromszoros kovalens kötésnek nevezzük.

Állítsuk erősségük szerinti növekvő sorrendbe a tanult kovalens kötéseket • Egyszeres kovalens kötés • Kétszeres kovalens kötés • Háromszoros kovalens kötés

Hány elektronpár tart kapcsolatot a következő elemmolekulákban? Fluor molekula: 1 Oxigén molekula: 2 Bróm molekula: 1 Klór molekula: 1 Nitrogén molekula: 3 Jód molekula: 1 Hidrogén molekula: 1