2 3 Elads A kovalens kts Elektroneffektusok Konjuglt






![Az effektus előjele: d+ [ ] d- d- d+ ENX>ENC ENY<ENC -I-effektus +I-effektus X: Az effektus előjele: d+ [ ] d- d- d+ ENX>ENC ENY<ENC -I-effektus +I-effektus X:](https://slidetodoc.com/presentation_image_h/fd4ce7379905acd9da7bcc53af572a48/image-18.jpg)
![Halogénatomok -I-effektusa [ALKIL-HALOGENIDEK] EN= F > Cl > Br > I d+ d+ Halogén Halogénatomok -I-effektusa [ALKIL-HALOGENIDEK] EN= F > Cl > Br > I d+ d+ Halogén](https://slidetodoc.com/presentation_image_h/fd4ce7379905acd9da7bcc53af572a48/image-19.jpg)

- Slides: 28

2 -3. Előadás A kovalens kötés. Elektroneffektusok. Konjugált kötés. Másodlagos kötések (H kötés stb). Szénvegyületek négyes, hármas, kettes koordinációs számú szénatommal.

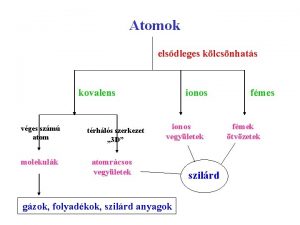
5. A kémiai kötés 5. 1. Definició: Atomok, molekulák között vonzóerők léte esetén létrejövő tartós kapcsolat. 5. 2. Kötéstípusok: Ionos W. Kossel (1916) Kovalens G. N. Lewis (1916) poláros > 600 k. J/mol apoláros 150 – 550 k. J/mol Másodlagos o ion – dipólus o dipólus – dipólus o Van der Waals 4 - 30 k. J/mol 5. 3. Kötések elméleti értelmezése 5. 3. 1. Bohr atommodell – oktett elv (1916) Rendszám (összes elektron) Vegyértékhéj K L Hajtóerő: „lezárt héj” Li………C………. . F 3 6 9 2 2 2 1 4 7 N 10 2 (lezárt) 8 „Módszer”: a) elektron transzfer, b) elektron megosztás

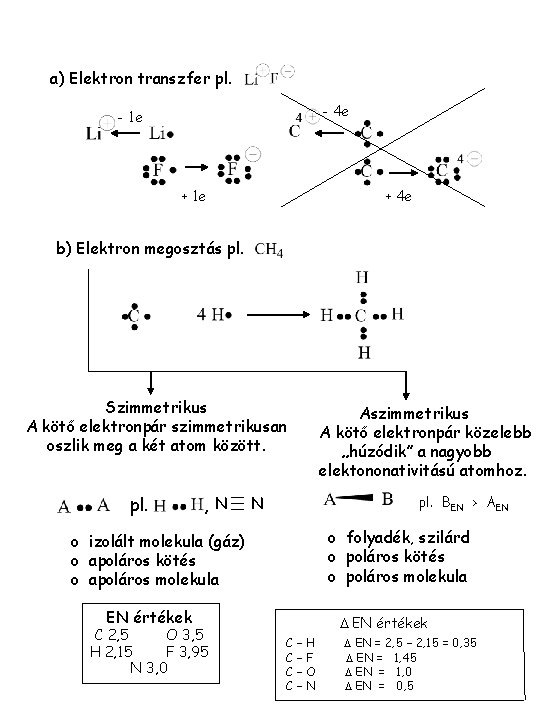
a) Elektron transzfer pl. - 4 e - 1 e + 4 e b) Elektron megosztás pl. Szimmetrikus A kötő elektronpár szimmetrikusan oszlik meg a két atom között. pl. , N N pl. BEN > AEN o folyadék, szilárd o poláros kötés o poláros molekula o izolált molekula (gáz) o apoláros kötés o apoláros molekula EN értékek C 2, 5 O 3, 5 H 2, 15 F 3, 95 N 3, 0 Aszimmetrikus A kötő elektronpár közelebb „húzódik” a nagyobb elektononativitású atomhoz. D EN értékek C–H C–F C–O C–N D EN = 2, 5 – 2, 15 = 0, 35 D EN = 1, 45 D EN = 1, 0 D EN = 0, 5

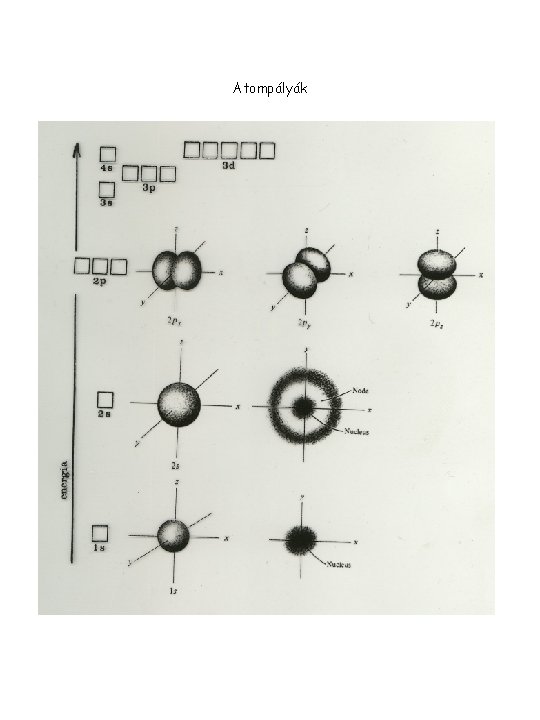
5. 3. 2. Kvantumelméleti megközelítés Kísérletekből adodó tapasztalatok: o Kötéstávolságok eltérőek (egyszeres, kettős, hármas. . ) o Kötésszög eltérő (pl. metán HCH 109 o, víz HOH 104 o, H 2 S 93 o) o Töltéseloszlás aszimmetrikus o Sztereoizoméria, optikai aktivitás o Eltérő kémiai reaktivitás (egyszeres, kettős, hármas. . ) Példák: C C 1, 54 Å HCH, CCC 109 o C C 1, 34 Å HCH 116, 7 o; HCC 121, 6 o C C 1, 29 Å CCH 180 o Elméleti megfontolások: 1924 L. De Broglie 1926 E. Schrödinger Pauli elv: Az elektron részecské és hullám. Az elektron energiája kifejezhető egy hullámfüggvény (Y) megoldásaként. Egyazon atomban két vagy több elektron nem lehet egyidejűleg ugyanabban a kvantumállapotban. Hund szabály: Újabb kvantumpályára elektron nem kerül, amíg van betöltetlen, alacsonyabb energiájú pályán hely. Schrödinger egyenlet: a) differenciál egyenlet b) megoldásai hullámfüggvények (Yn, n = 1, . . . ) c) a hullámfüggvényhez tartozó sajátérték az elektron energiája (E n, n = 1, . . )

Atompályák

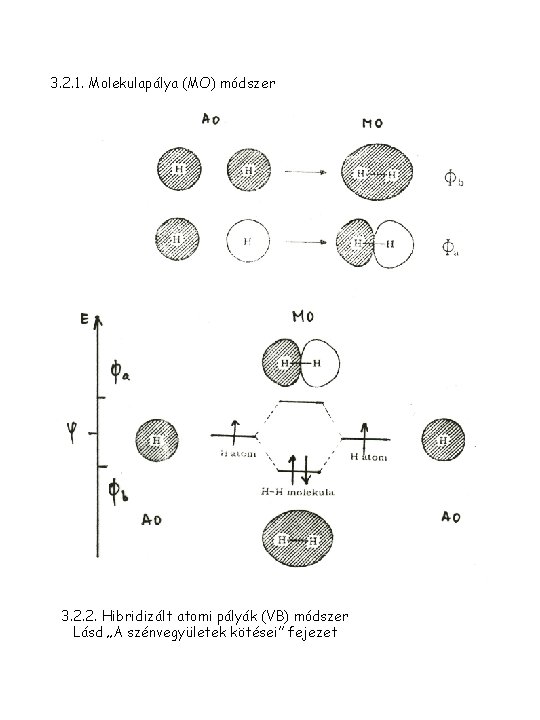
3. 2. 1. Molekulapálya (MO) módszer 3. 2. 2. Hibridizált atomi pályák (VB) módszer Lásd „A szénvegyületek kötései” fejezet

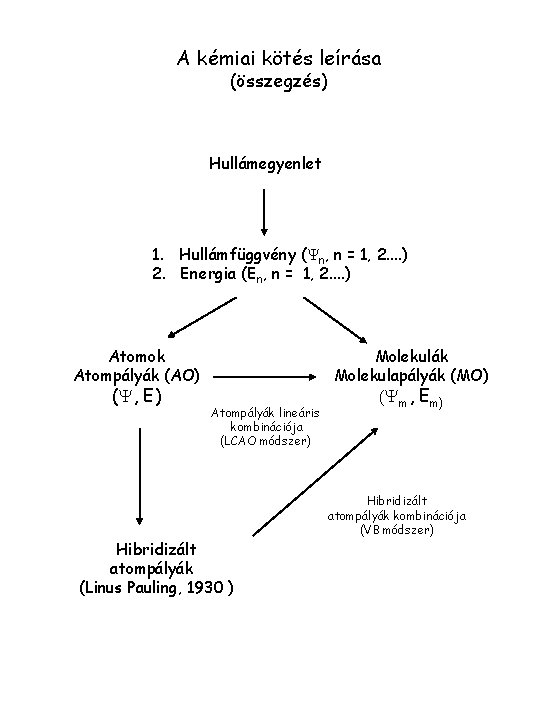
A kémiai kötés leírása (összegzés) Hullámegyenlet 1. Hullámfüggvény (Yn, n = 1, 2. . ) 2. Energia (En, n = 1, 2. . ) Atomok Atompályák (AO) (Y, E) Molekulák Molekulapályák (MO) Atompályák lineáris kombinációja (LCAO módszer) Hibridizált atompályák (Linus Pauling, 1930 ) (Ym, Em) Hibridizált atompályák kombinációja (VB módszer)

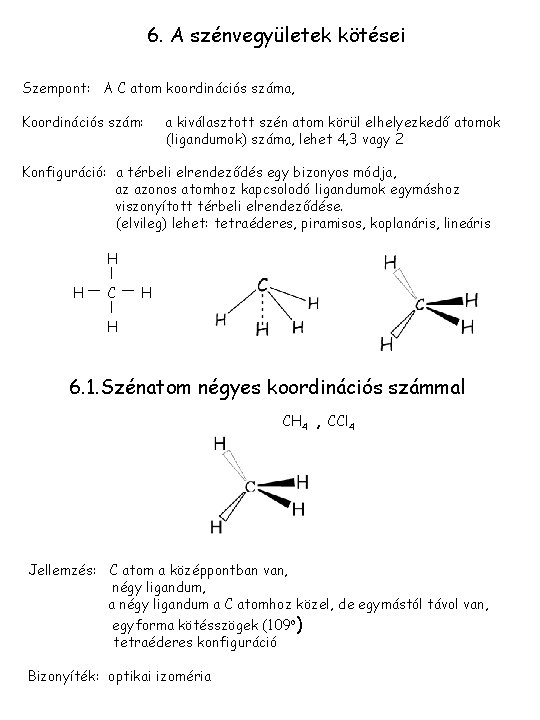
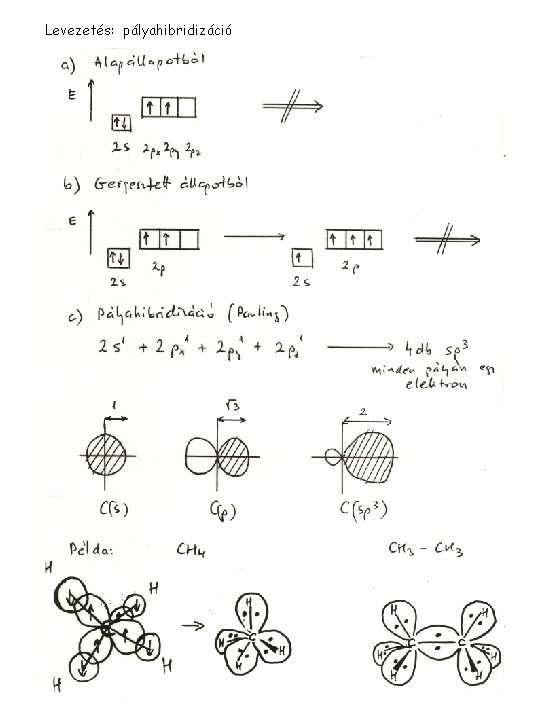
6. A szénvegyületek kötései Szempont: A C atom koordinációs száma, Koordinációs szám: a kiválasztott szén atom körül elhelyezkedő atomok (ligandumok) száma, lehet 4, 3 vagy 2 Konfiguráció: a térbeli elrendeződés egy bizonyos módja, az azonos atomhoz kapcsolodó ligandumok egymáshoz viszonyított térbeli elrendeződése. (elvileg) lehet: tetraéderes, piramisos, koplanáris, lineáris H H C H H 6. 1. Szénatom négyes koordinációs számmal CH 4 , CCl 4 Jellemzés: C atom a középpontban van, négy ligandum, a négy ligandum a C atomhoz közel, de egymástól távol van, egyforma kötésszögek (109 o) tetraéderes konfiguráció Bizonyíték: optikai izoméria

Levezetés: pályahibridizáció


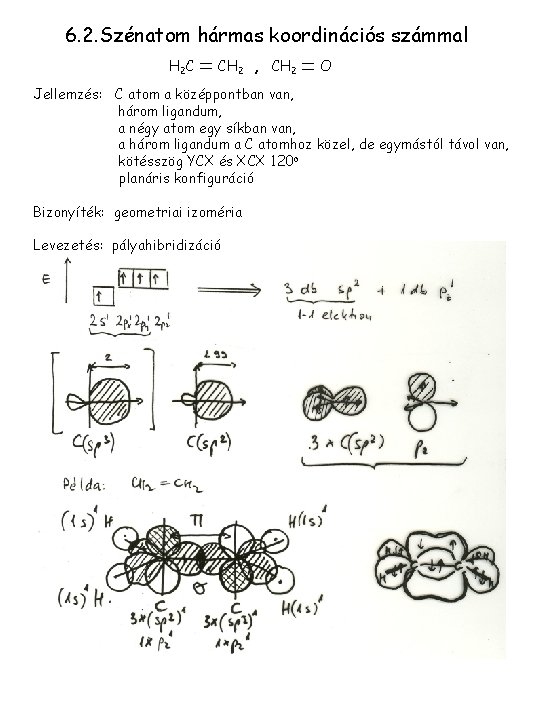
6. 2. Szénatom hármas koordinációs számmal H 2 C CH 2 , CH 2 O Jellemzés: C atom a középpontban van, három ligandum, a négy atom egy síkban van, a három ligandum a C atomhoz közel, de egymástól távol van, kötésszög YCX és XCX 120 o planáris konfiguráció Bizonyíték: geometriai izoméria Levezetés: pályahibridizáció


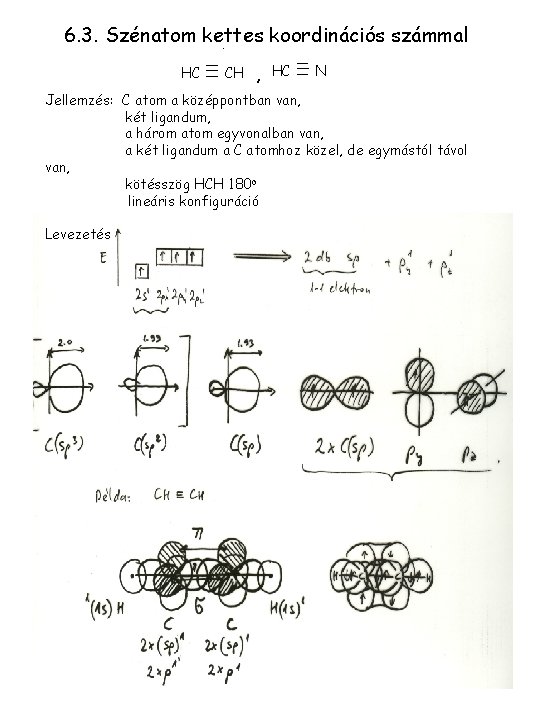
6. 3. Szénatom kettes koordinációs számmal HC CH , HC N Jellemzés: C atom a középpontban van, két ligandum, a három atom egyvonalban van, a két ligandum a C atomhoz közel, de egymástól távol van, kötésszög HCH 180 o lineáris konfiguráció Levezetés


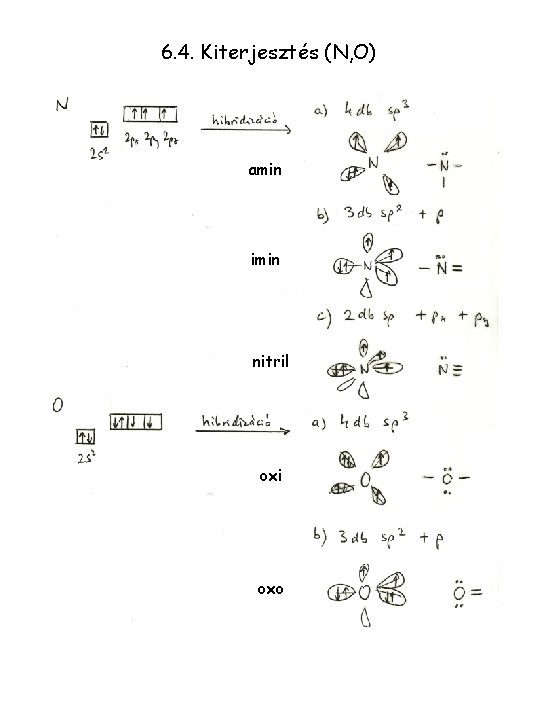
6. 4. Kiterjesztés (N, O) amin imin nitril oxi oxo

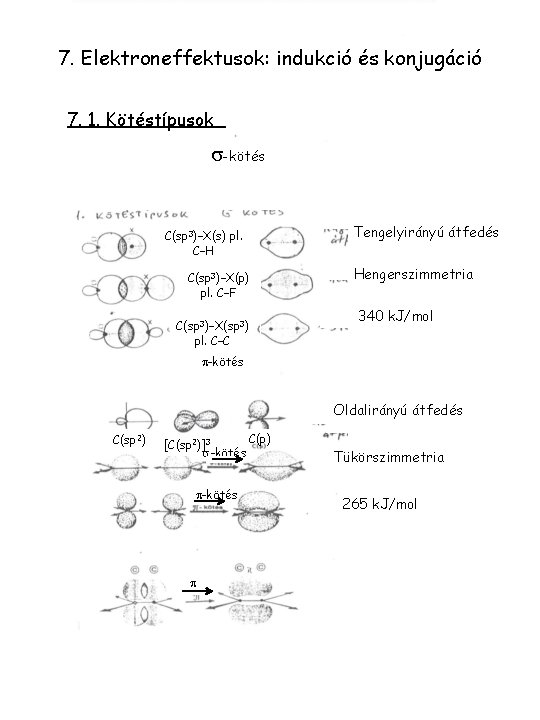
7. Elektroneffektusok: indukció és konjugáció 7. 1. Kötéstípusok s-kötés C(sp 3)–X(s) pl. C–H C(sp 3)–X(p) pl. C–F C(sp 3)–X(sp 3) pl. C–C Tengelyirányú átfedés Hengerszimmetria 340 k. J/mol p-kötés Oldalirányú átfedés C(sp 2) C(p) [C(sp 2)]3 s-kötés p Tükörszimmetria 265 k. J/mol

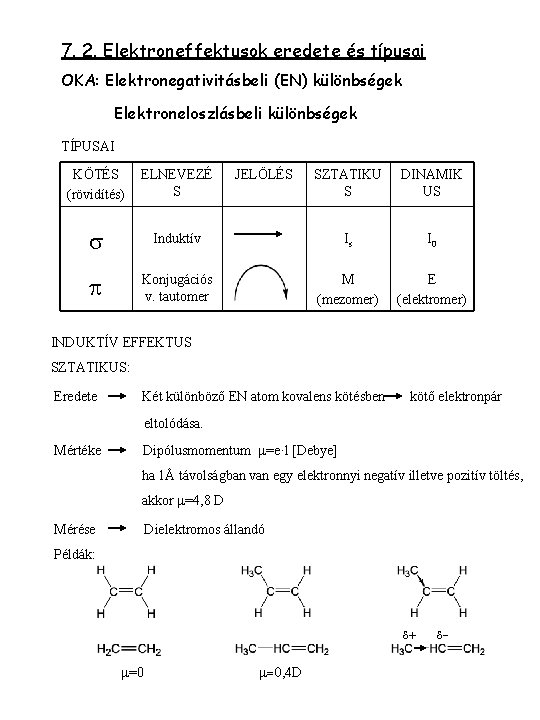
7. 2. Elektroneffektusok eredete és típusai OKA: Elektronegativitásbeli (EN) különbségek Elektroneloszlásbeli különbségek TÍPUSAI KÖTÉS (rövidítés) ELNEVEZÉ S s p JELÖLÉS SZTATIKU S DINAMIK US Induktív Is I 0 Konjugációs v. tautomer M (mezomer) E (elektromer) INDUKTÍV EFFEKTUS SZTATIKUS: Eredete Két különböző EN atom kovalens kötésben kötő elektronpár eltolódása. Mértéke Dipólusmomentum m=e·l [Debye] ha 1Å távolságban van egy elektronnyi negatív illetve pozitív töltés, akkor m=4, 8 D Mérése Dielektromos állandó Példák: d+ m=0, 4 D d-
![Az effektus előjele d d d d ENXENC ENYENC Ieffektus Ieffektus X Az effektus előjele: d+ [ ] d- d- d+ ENX>ENC ENY<ENC -I-effektus +I-effektus X:](https://slidetodoc.com/presentation_image_h/fd4ce7379905acd9da7bcc53af572a48/image-18.jpg)
Az effektus előjele: d+ [ ] d- d- d+ ENX>ENC ENY<ENC -I-effektus +I-effektus X: ”elektronvonzó” Y: ”elektronküldő” C-atomhoz kapcsolódó induktív effektusok Konfiguráció -I-effektus: EN= C(sp) > C(sp 2) >>> C(sp 3) d+ d+ > propin propilén +I-effektus: < Rendűség EN= > > +I-effektus: > d+ +I-effektus: EN= metil-benzol < d+ Lánchossz d+ ; > > t. Butil i. Propil > > d+ d+ > Etil > d+
![Halogénatomok Ieffektusa ALKILHALOGENIDEK EN F Cl Br I d d Halogén Halogénatomok -I-effektusa [ALKIL-HALOGENIDEK] EN= F > Cl > Br > I d+ d+ Halogén](https://slidetodoc.com/presentation_image_h/fd4ce7379905acd9da7bcc53af572a48/image-19.jpg)
Halogénatomok -I-effektusa [ALKIL-HALOGENIDEK] EN= F > Cl > Br > I d+ d+ Halogén milyensége: CH 3 F > CH 3 Cl > CH 3 Br > CH 3 I m 1, 83 1, 86 1, 82 d+ d+ 1, 88 2, 04 C-atom rendűsége: CH 3 CH 2– Br < m d+ d+ 1, 48 d+ – Br < – Br 2, 21 d+ C-lánc hosszúsága: CH 3 Br < CH 3 CH 2 CH 2 Br m 1, 82 d 1, 88 g b 1, 93 a C C Br Szubsztituált karbonsavak aciditása p. Ka H–CH 2–COOH 4, 76 CH 3–CH 2–CHCl–COOH 2, 86 I–CH 2–COOH 3, 12 CH 3–CHCl–CH 2–COOH 4, 05 Br–CH 2–COOH 2, 87 CH 2 Cl–CH 2–COOH 4, 52 F–CH 2–COOH 2, 68 CH 3–CH 2–COOH 4, 82 -I-effektus: F > Cl > Br > I X–CH 2 d+ X> X> X a b g X–CH 2 + H+ -

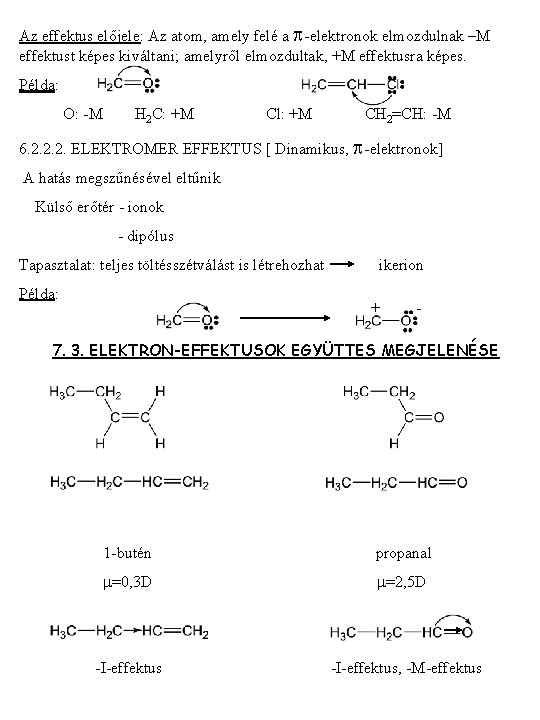
DINAMIKUS: külső erőtér hatására polarizálódik a s-kötés, 1 ea hatás megszűnésével eltűnik Külső erőtér - ionok - dipólus s-kötések érzékenysége: C–C > C–N > C–O > C–F C–I > C–Br > C–Cl > C–F Tapasztalat: Nagy statikus I jelenléte esetén kicsi a dinamikus. Kis statikus I tartalmú kötések érzékenyek KONJUGÁCIÓS EFFEKTUS MEZOMER EFFEKTUS [SZTATIKUS, p-elektronrendszer] 2 atom között lokalizált p-elektronok A p-elektronok példa: eltolódnak (ENO>ENC) A p-elektronok három v. több atom erőterében delokalizálódnak Ha a p-kötések konjugált helyzetben vannak példa: butadién 6. 2. 3. 1. 2. 2. Ha p-kötésben résztvevő atomhoz nemkötő elektronpárt tartalmazó atom is kapcsolódik példa: vinil-klorid

Az effektus előjele: Az atom, amely felé a p-elektronok elmozdulnak –M effektust képes kiváltani; amelyről elmozdultak, +M effektusra képes. Példa: O: -M H 2 C: +M Cl: +M CH 2=CH: -M 6. 2. 2. 2. ELEKTROMER EFFEKTUS [ Dinamikus, p-elektronok] A hatás megszűnésével eltűnik Külső erőtér - ionok - dipólus Tapasztalat: teljes töltésszétválást is létrehozhat Példa: ikerion + - 7. 3. ELEKTRON-EFFEKTUSOK EGYÜTTES MEGJELENÉSE 1 -butén propanal m=0, 3 D m=2, 5 D -I-effektus, -M-effektus

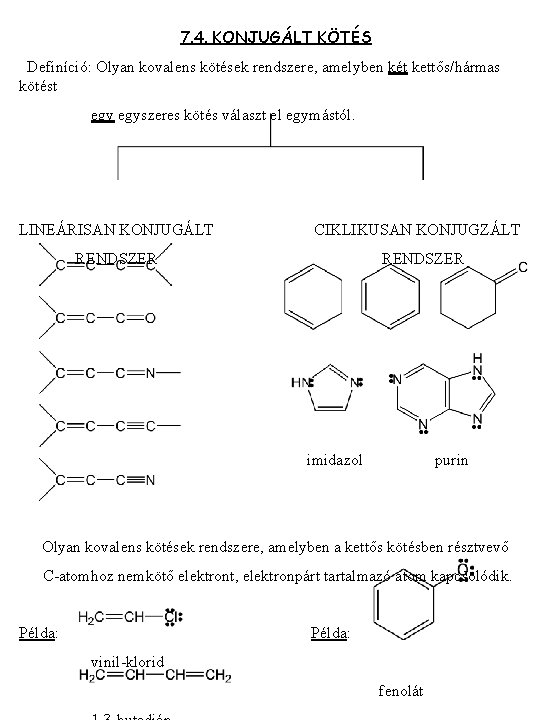
7. 4. KONJUGÁLT KÖTÉS Definíció: Olyan kovalens kötések rendszere, amelyben két kettős/hármas kötést egyszeres kötés választ el egymástól. LINEÁRISAN KONJUGÁLT CIKLIKUSAN KONJUGZÁLT RENDSZER imidazol purin Olyan kovalens kötések rendszere, amelyben a kettős kötésben résztvevő C-atomhoz nemkötő elektront, elektronpárt tartalmazó atom kapcsolódik. Példa: vinil-klorid fenolát

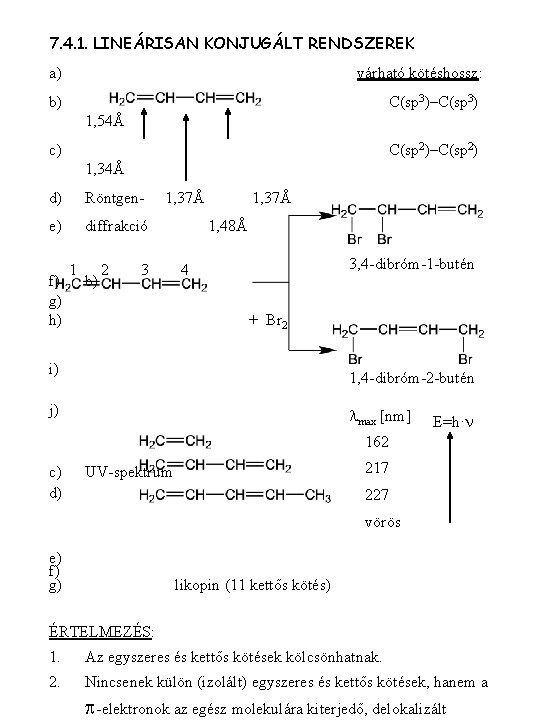
7. 4. 1. LINEÁRISAN KONJUGÁLT RENDSZEREK a) várható kötéshossz: b) C(sp 3)–C(sp 3) 1, 54Å c) C(sp 2)–C(sp 2) 1, 34Å d) Röntgen- e) diffrakció f) g) h) 1 b) 2 1, 37Å 3 1, 37Å 1, 48Å 3, 4 -dibróm-1 -butén 4 + Br 2 i) 1, 4 -dibróm-2 -butén j) lmax [nm] E=h·n 162 c) d) 217 UV-spektrum 227 vörös e) f) g) likopin (11 kettős kötés) ÉRTELMEZÉS: 1. Az egyszeres és kettős kötések kölcsönhatnak. 2. Nincsenek külön (izolált) egyszeres és kettős kötések, hanem a p-elektronok az egész molekulára kiterjedő, delokalizált

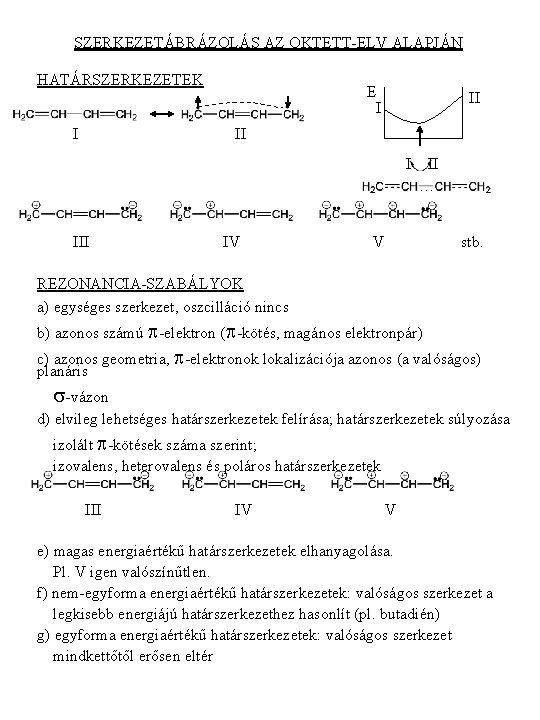
SZERKEZETÁBRÁZOLÁS AZ OKTETT-ELV ALAPJÁN HATÁRSZERKEZETEK I E I II III IV II … V stb. REZONANCIA-SZABÁLYOK a) egységes szerkezet, oszcilláció nincs b) azonos számú p-elektron (p-kötés, magános elektronpár) c) azonos geometria, p-elektronok lokalizációja azonos (a valóságos) planáris s-vázon d) elvileg lehetséges határszerkezetek felírása; határszerkezetek súlyozása izolált p-kötések száma szerint; izovalens, heterovalens és poláros határszerkezetek III IV V e) magas energiaértékű határszerkezetek elhanyagolása. Pl. V igen valószínűtlen. f) nem-egyforma energiaértékű határszerkezetek: valóságos szerkezet a legkisebb energiájú határszerkezethez hasonlít (pl. butadién) g) egyforma energiaértékű határszerkezetek: valóságos szerkezet mindkettőtől erősen eltér

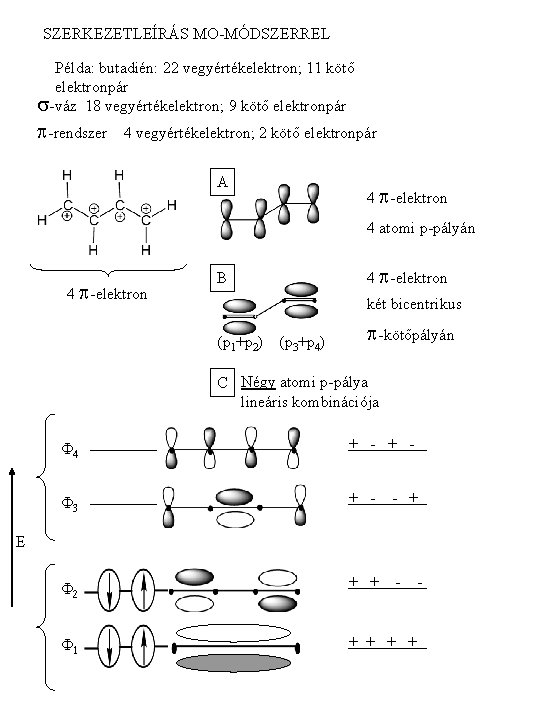
SZERKEZETLEÍRÁS MO-MÓDSZERREL Példa: butadién: 22 vegyértékelektron; 11 kötő elektronpár s-váz 18 vegyértékelektron; 9 kötő elektronpár p-rendszer 4 vegyértékelektron; 2 kötő elektronpár A 4 p-elektron 4 atomi p-pályán 4 p-elektron B két bicentrikus (p 1+p 2) (p 3+p 4) p-kötőpályán C Négy atomi p-pálya lineáris kombinációja F 4 + - F 3 + - - + F 2 + + - F 1 + + E -

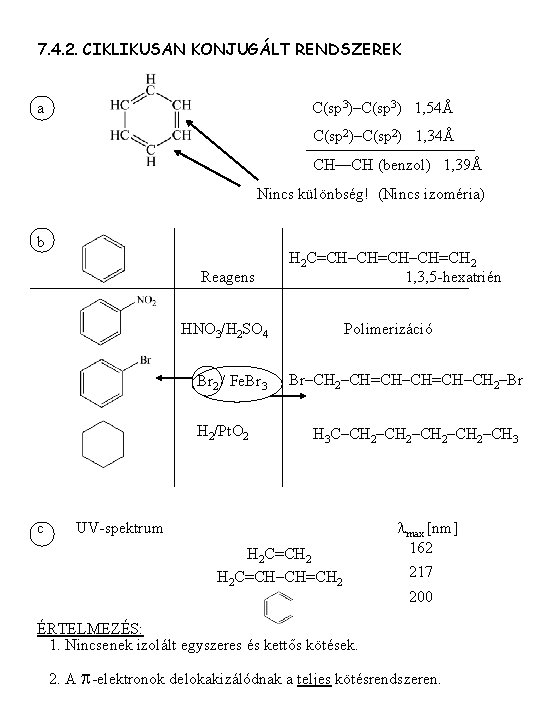
7. 4. 2. CIKLIKUSAN KONJUGÁLT RENDSZEREK a C(sp 3)–C(sp 3) 1, 54Å C(sp 2)–C(sp 2) 1, 34Å CH—CH (benzol) 1, 39Å Nincs különbség! (Nincs izoméria) b Reagens H 2 C=CH–CH=CH 2 1, 3, 5 -hexatrién HNO 3/H 2 SO 4 Br 2 / Fe. Br 3 H 2/Pt. O 2 c Polimerizáció Br–CH 2–CH=CH–CH 2–Br H 3 C–CH 2–CH 3 UV-spektrum H 2 C=CH 2 H 2 C=CH–CH=CH 2 lmax [nm] 162 217 200 ÉRTELMEZÉS: 1. Nincsenek izolált egyszeres és kettős kötések. 2. A p-elektronok delokakizálódnak a teljes kötésrendszeren.

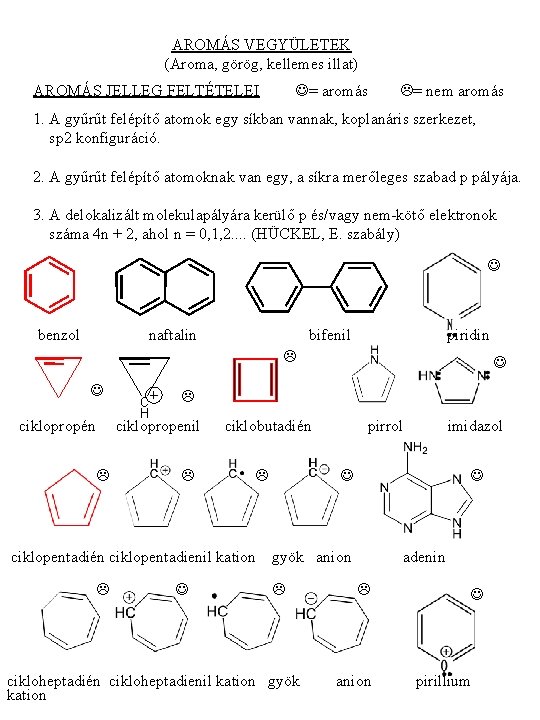
AROMÁS VEGYÜLETEK (Aroma, görög, kellemes illat) = aromás AROMÁS JELLEG FELTÉTELEI = nem aromás 1. A gyűrűt felépítő atomok egy síkban vannak, koplanáris szerkezet, sp 2 konfiguráció. 2. A gyűrűt felépítő atomoknak van egy, a síkra merőleges szabad p pályája. 3. A delokalizált molekulapályára kerülő p és/vagy nem-kötő elektronok száma 4 n + 2, ahol n = 0, 1, 2. . (HÜCKEL, E. szabály) benzol naftalin bifenil piridin ciklopropén C H ciklopropenil ciklobutadién ciklopentadién ciklopentadienil kation pirrol imidazol gyök anion cikloheptadién cikloheptadienil kation gyök kation adenin anion pirillium

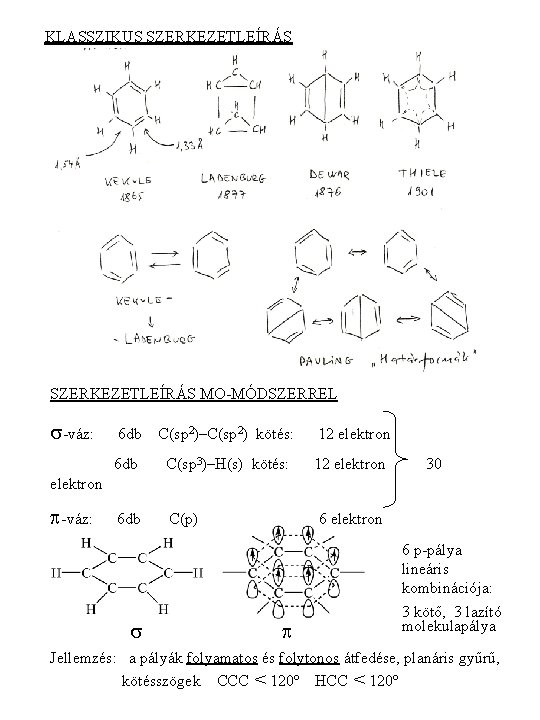
KLASSZIKUS SZERKEZETLEÍRÁS MO-MÓDSZERREL s-váz: 6 db C(sp 2)–C(sp 2) kötés: 12 elektron 6 db C(sp 3)–H(s) kötés: 12 elektron 6 db C(p) 30 elektron p-váz: 6 elektron 6 p-pálya lineáris kombinációja: s p 3 kötő, 3 lazító molekulapálya Jellemzés: a pályák folyamatos és folytonos átfedése, planáris gyűrű, kötésszögek CCC < 120º HCC < 120º