KMIAI KTSEK AZ IONOS KTS 1 Klr 1








- Slides: 23

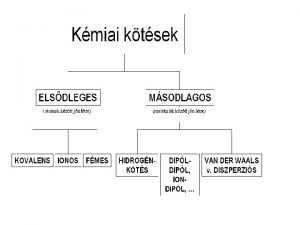
KÉMIAI KÖTÉSEK

AZ IONOS KÖTÉS 1. Klór: 1 s 22 p 63 s 23 p 5 Kloridion: 1 s 22 p 63 s 23 p 6 (Argonszerkezet) Nátrium: 1 s 22 p 63 s 1 Nátriumion: 1 s 22 p 6 (Neonszerkezet) HA KÉT ATOM KÖZÜL AZ EGYIK EGY VAGY TÖBB ELEKTRONT AD ÁT A MÁSIKNAK, ÉS EZÁLTAL MINDKÉT ATOMTÖRZS KÖRÜL NEMESGÁZ-SZERKEZETŰ (NS 2 NP 6) ELEKTRONBUROK JÖN LÉTRE, IONOS KÖTÉSRŐL BESZÉLÜNK. AZ IONKÖTÉS EREDMÉNYEKÉNT KATIONOK ÉS ANIONOK JÖNNEK LÉTRE. Az ionkötés létrejöttének feltétele: EN ≥ 2 Az ionkötésű vegyületekben a pozitív és a negatív ionokat az elektrosztatikus vonzás tartja össze. Az ionkötésű vegyületek képlete csak azt fejezi ki, hogy benne milyen a kationok és az anionok aránya. TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

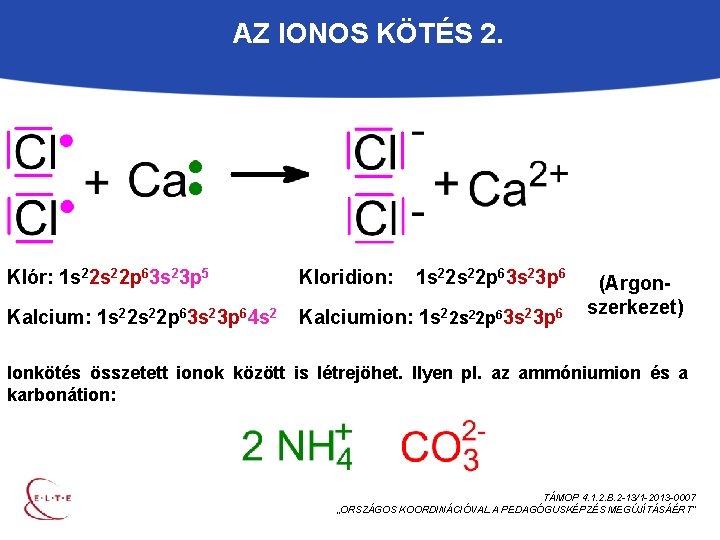
AZ IONOS KÖTÉS 2. Klór: 1 s 22 p 63 s 23 p 5 Kloridion: 1 s 22 p 63 s 23 p 6 Kalcium: 1 s 22 p 63 s 23 p 64 s 2 Kalciumion: 1 s 22 p 63 s 23 p 6 (Argonszerkezet) Ionkötés összetett ionok között is létrejöhet. Ilyen pl. az ammóniumion és a karbonátion: TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

A KOVALENS KÖTÉS AZ ATOMOS ÁLLAPOT A TERMÉSZETBEN ÁLTALÁBAN NEM STABILIS. EZ ALÓL CSAK A ZÁRT, STABILIS ELEKTRONSZERKEZETŰ NEMESGÁZOK KÉPEZNEK KIVÉTELT. Az kovalens kötés létrejöttének feltétele: EN < 2 PÁROSÍTATLAN ELEKTRONOK A KÉT (VAGY TÖBB) ATOMMAG VONZÁSTERÉBEN ÚJ, ÚN. MOLEKULAPÁLYÁT AZAZ KOVALENS KÖTÉST HOZNAK LÉTRE. TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

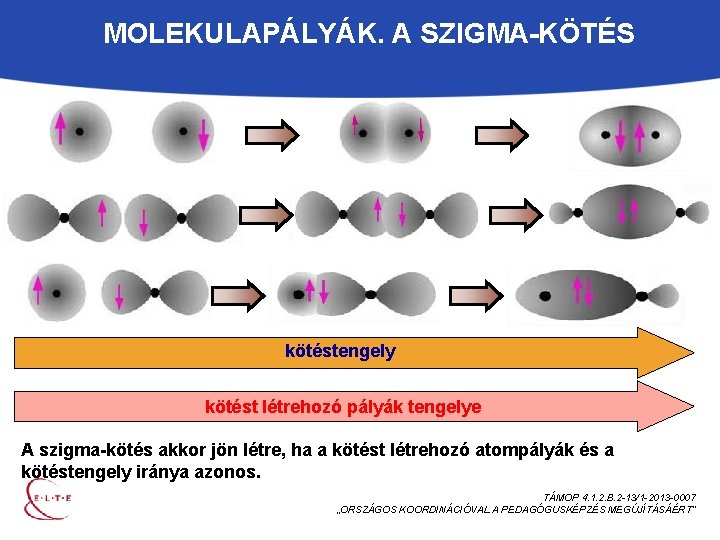
MOLEKULAPÁLYÁK. A SZIGMA-KÖTÉS kötéstengely kötést létrehozó pályák tengelye A szigma-kötés akkor jön létre, ha a kötést létrehozó atompályák és a kötéstengely iránya azonos. TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

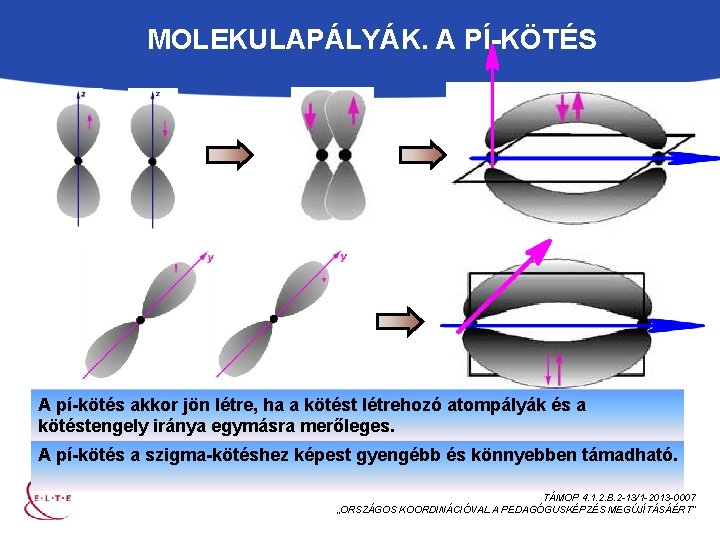
MOLEKULAPÁLYÁK. A PÍ-KÖTÉS A pí-kötés akkor jön létre, ha a kötést létrehozó atompályák és a kötéstengely iránya egymásra merőleges. A pí-kötés a szigma-kötéshez képest gyengébb és könnyebben támadható. TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

A TÖBBSZÖRÖS KOVALENS KÖTÉS Ha a kötésben lévő atomokban két, vagy három párosítatlan elektront van, akkor lehetőség van a kettős illetve a hármas kötés létrejöttére. A többszörös kötésben az egyik mindig szigma-, a többi pedig pí-kötés. szigma-kötés pí-kötés Az egyszerűsített jelölésben nem teszünk különbséget szigma- és pí-kötés között. TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

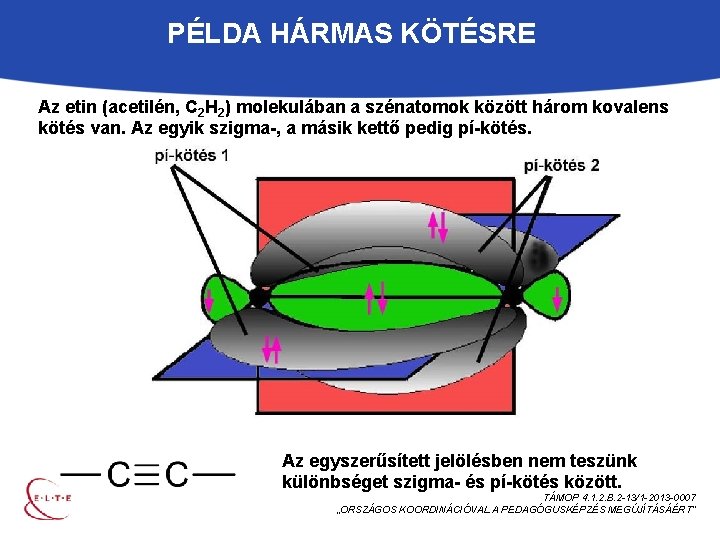
PÉLDA HÁRMAS KÖTÉSRE Az etin (acetilén, C 2 H 2) molekulában a szénatomok között három kovalens kötés van. Az egyik szigma-, a másik kettő pedig pí-kötés. Az egyszerűsített jelölésben nem teszünk különbséget szigma- és pí-kötés között. TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

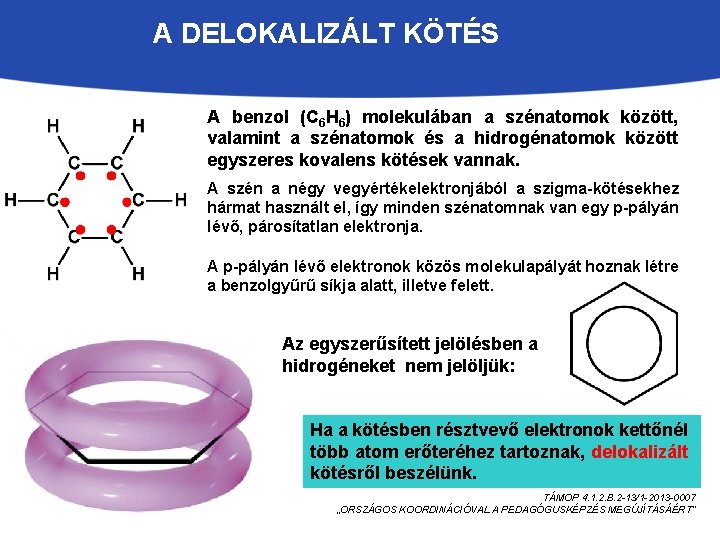
A DELOKALIZÁLT KÖTÉS A benzol (C 6 H 6) molekulában a szénatomok között, valamint a szénatomok és a hidrogénatomok között egyszeres kovalens kötések vannak. A szén a négy vegyértékelektronjából a szigma-kötésekhez hármat használt el, így minden szénatomnak van egy p-pályán lévő, párosítatlan elektronja. A p-pályán lévő elektronok közös molekulapályát hoznak létre a benzolgyűrű síkja alatt, illetve felett. Az egyszerűsített jelölésben a hidrogéneket nem jelöljük: Ha a kötésben résztvevő elektronok kettőnél több atom erőteréhez tartoznak, delokalizált kötésről beszélünk. TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

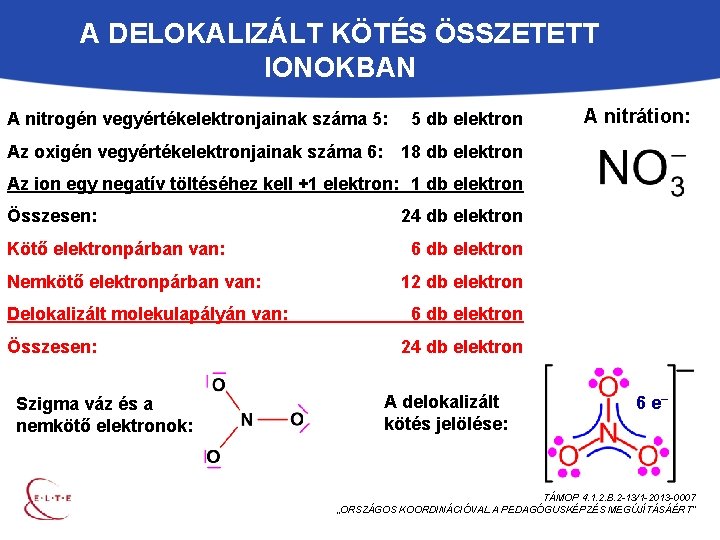
A DELOKALIZÁLT KÖTÉS ÖSSZETETT IONOKBAN A nitrogén vegyértékelektronjainak száma 5: 5 db elektron Az oxigén vegyértékelektronjainak száma 6: 18 db elektron A nitrátion: Az ion egy negatív töltéséhez kell +1 elektron: 1 db elektron Összesen: Kötő elektronpárban van: Nemkötő elektronpárban van: Delokalizált molekulapályán van: Összesen: Szigma váz és a nemkötő elektronok: 24 db elektron 6 db elektron 12 db elektron 6 db elektron 24 db elektron A delokalizált kötés jelölése: 6 e– TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

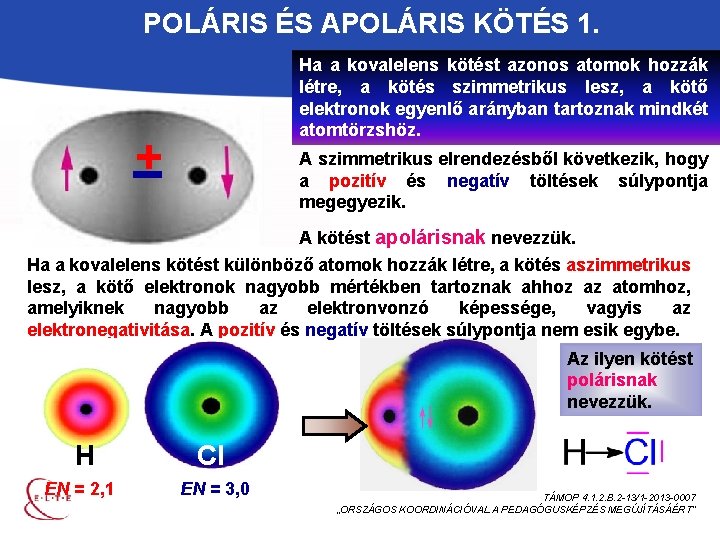
POLÁRIS ÉS APOLÁRIS KÖTÉS 1. Ha a kovalelens kötést azonos atomok hozzák létre, a kötés szimmetrikus lesz, a kötő elektronok egyenlő arányban tartoznak mindkét atomtörzshöz. + A szimmetrikus elrendezésből következik, hogy a pozitív és negatív töltések súlypontja megegyezik. A kötést apolárisnak nevezzük. Ha a kovalelens kötést különböző atomok hozzák létre, a kötés aszimmetrikus lesz, a kötő elektronok nagyobb mértékben tartoznak ahhoz az atomhoz, amelyiknek nagyobb az elektronvonzó képessége, vagyis az elektronegativitása. A pozitív és negatív töltések súlypontja nem esik egybe. Az ilyen kötést polárisnak nevezzük. H EN = 2, 1 Cl EN = 3, 0 TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

POLÁRIS ÉS APOLÁRIS KÖTÉS 2. Az apoláris, a poláris és az ionos kötés között nincs éles átmenet. apoláris 0, 5 EN ionos 2, 0 EN Polaritás H 2 0 apoláris HI ~0, 5 gyengén poláris HBr ~0, 7 poláris HCl ~0, 9 erősen poláris HF ~1, 9 igen erősen poláris Na. Cl ~2, 1 ionos A csak apoláris kötéseket tartalmazó molekula biztosan apoláris. Ha a molekula kötései polárisak, akkor a molekula szimmetriája TÁMOP dönti 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT” el, hogy a poláris kötések mellett a molekula poláris-e.

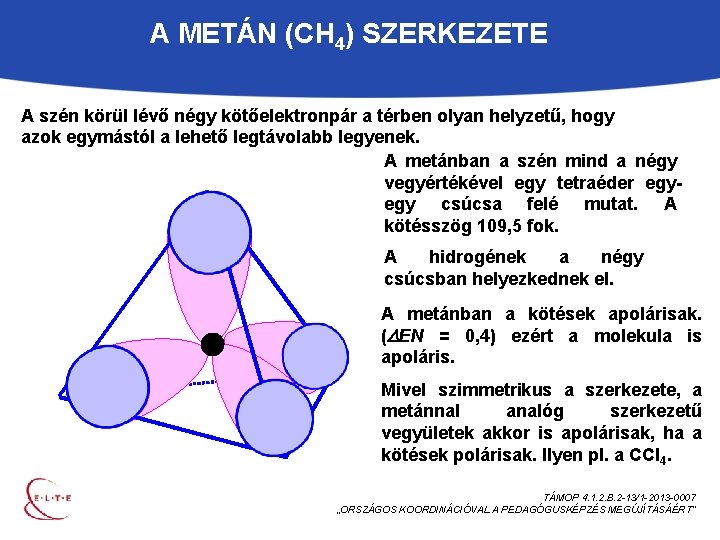
A METÁN (CH 4) SZERKEZETE A szén körül lévő négy kötőelektronpár a térben olyan helyzetű, hogy azok egymástól a lehető legtávolabb legyenek. A metánban a szén mind a négy vegyértékével egy tetraéder egyegy csúcsa felé mutat. A kötésszög 109, 5 fok. A hidrogének a négy csúcsban helyezkednek el. A metánban a kötések apolárisak. ( EN = 0, 4) ezért a molekula is apoláris. Mivel szimmetrikus a szerkezete, a metánnal analóg szerkezetű vegyületek akkor is apolárisak, ha a kötések polárisak. Ilyen pl. a CCl 4. TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

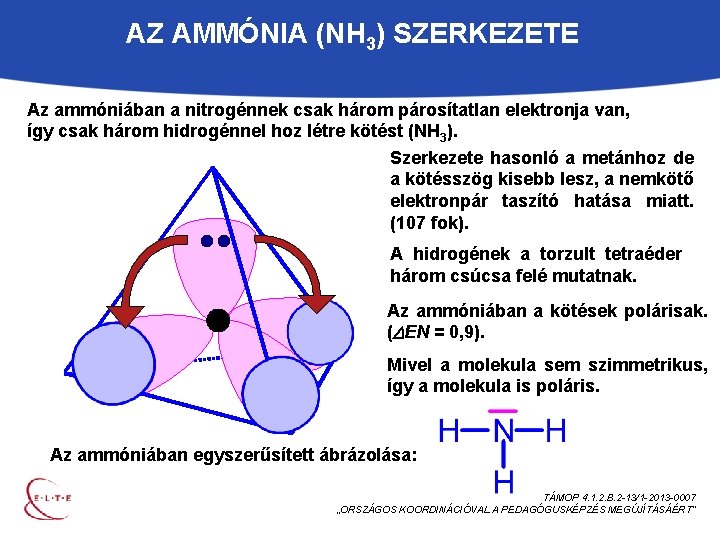
AZ AMMÓNIA (NH 3) SZERKEZETE Az ammóniában a nitrogénnek csak három párosítatlan elektronja van, így csak három hidrogénnel hoz létre kötést (NH 3). Szerkezete hasonló a metánhoz de a kötésszög kisebb lesz, a nemkötő elektronpár taszító hatása miatt. (107 fok). A hidrogének a torzult tetraéder három csúcsa felé mutatnak. Az ammóniában a kötések polárisak. ( EN = 0, 9). Mivel a molekula sem szimmetrikus, így a molekula is poláris. Az ammóniában egyszerűsített ábrázolása: TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

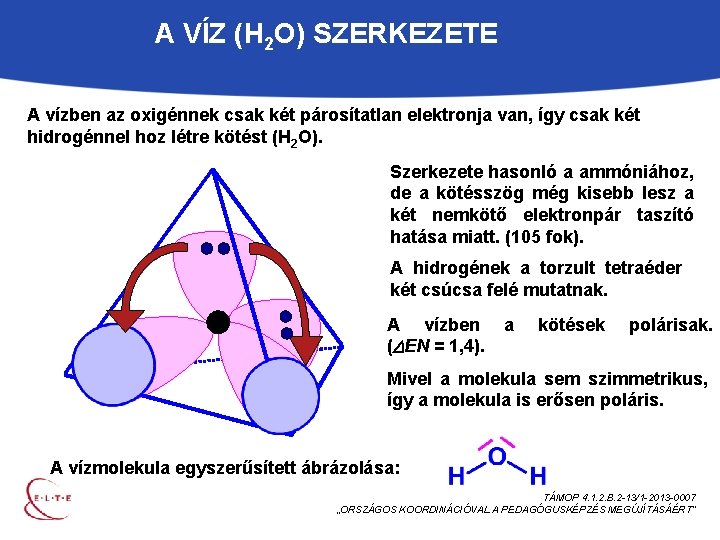
A VÍZ (H 2 O) SZERKEZETE A vízben az oxigénnek csak két párosítatlan elektronja van, így csak két hidrogénnel hoz létre kötést (H 2 O). Szerkezete hasonló a ammóniához, de a kötésszög még kisebb lesz a két nemkötő elektronpár taszító hatása miatt. (105 fok). A hidrogének a torzult tetraéder két csúcsa felé mutatnak. A vízben ( EN = 1, 4). a kötések polárisak. Mivel a molekula sem szimmetrikus, így a molekula is erősen poláris. A vízmolekula egyszerűsített ábrázolása: TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

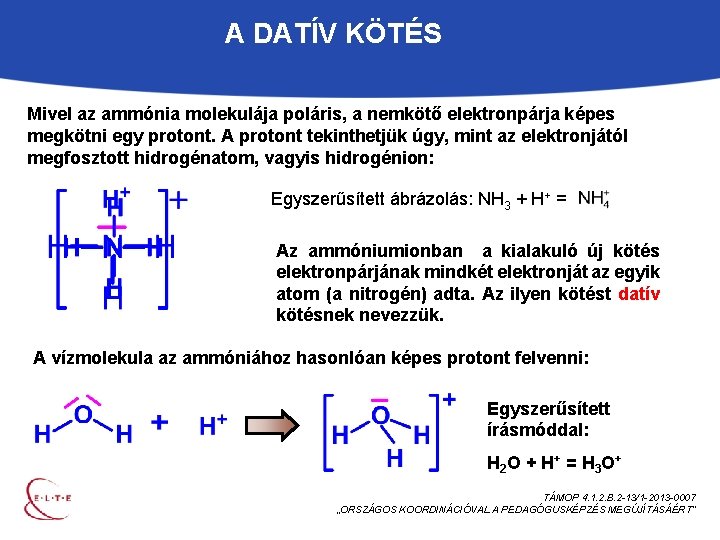
A DATÍV KÖTÉS Mivel az ammónia molekulája poláris, a nemkötő elektronpárja képes megkötni egy protont. A protont tekinthetjük úgy, mint az elektronjától megfosztott hidrogénatom, vagyis hidrogénion: Egyszerűsített ábrázolás: NH 3 + H+ = Az ammóniumionban a kialakuló új kötés elektronpárjának mindkét elektronját az egyik atom (a nitrogén) adta. Az ilyen kötést datív kötésnek nevezzük. A vízmolekula az ammóniához hasonlóan képes protont felvenni: Egyszerűsített írásmóddal: H 2 O + H + = H 3 O + TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

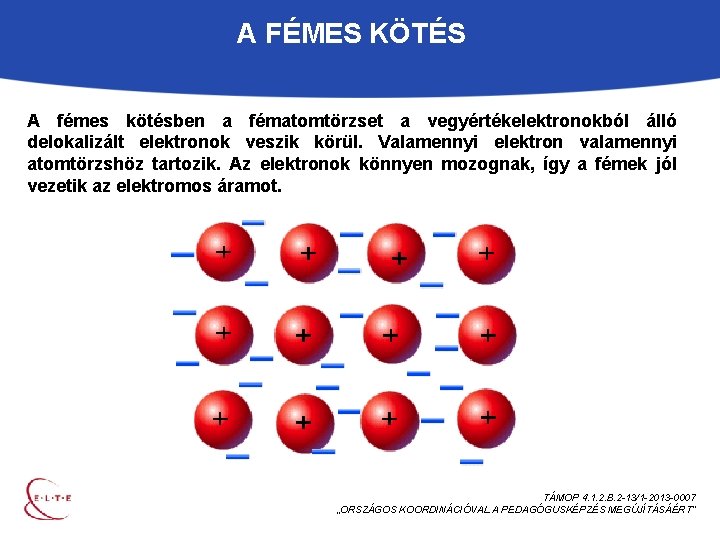
A FÉMES KÖTÉS A fémes kötésben a fématomtörzset a vegyértékelektronokból álló delokalizált elektronok veszik körül. Valamennyi elektron valamennyi atomtörzshöz tartozik. Az elektronok könnyen mozognak, így a fémek jól vezetik az elektromos áramot. TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

MÁSODRENDŰ KÖTÉSEK AZ ANYAGI HALMAZOK TULAJDONSÁGAIT, A HALMAZÁLLAPOTUKAT ELSŐDLEGESEN A HALMAZT FELÉPÍTŐ RÉSZECSKÉK KÖZÖTT KIALAKULÓ KÖLCSÖNHATÁSOK HATÁROZZÁK MEG. EZEKNEK A KÖLCSÖNHATÁSOKNAK A MÉRTÉKE IGEN ELTÉRŐ LEHET, EGYBEN AZONBAN MEGEGYEZNEK: AZ ERŐK HATÓTÁVOLSÁGA IGEN KICSI. AZOKNAK AZ ERŐKNEK AZ ÖSSZESSÉGÉT, AMELYEK EGY ADOTT ANYAG RÉSZECSKÉI KÖZÖTT ÖSSZETARTÓ ERŐKÉNT HATNAK, KOHÉZIÓNAK Vannak olyan anyagok, amelyekben a halmazt felépítő részecskék között ún. elsőrendű NEVEZZÜK. kötőerők működnek. Ilyen anyagi halmazok az ionvegyületek, a fémek és az atomrácsos kristályok. Az elsőrendű kötésekkel összekapcsolódó részecskék között a kohézió nagy, így azok jellemzően szilárd halmazállapotú, kristályos szerkezetű anyagok. Kohézió azonban nemcsak elsőrendű kötésből származhat. A molekulákból álló anyagi halmazokban is működnek összetartó erők. Az anyagi halmazok részecskéi között fellépő kötőerőket másodrendű kötéseknek nevezzük. A másodrendű kötések erőssége nagyságrendekkel kisebb, mint az elsőrendű kötéseké, felbontásukhoz kisebb energia is elegendő. TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

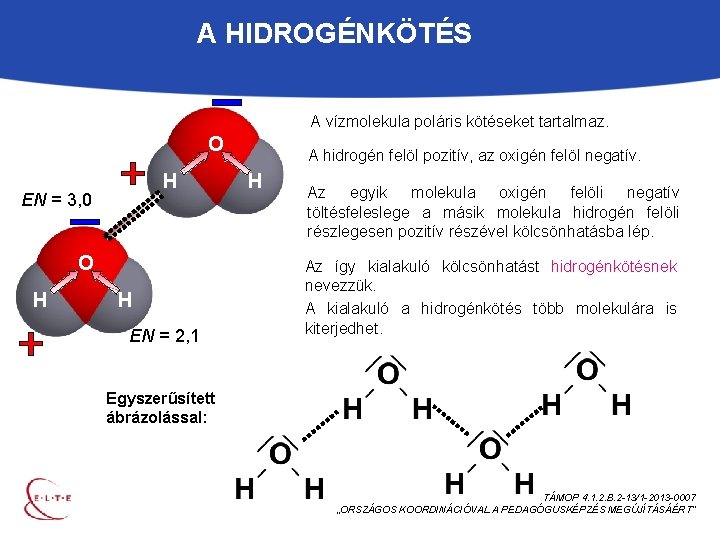
A HIDROGÉNKÖTÉS A vízmolekula poláris kötéseket tartalmaz. O H EN = 3, 0 O H H EN = 2, 1 A hidrogén felöl pozitív, az oxigén felöl negatív. H Az egyik molekula oxigén felöli negatív töltésfeleslege a másik molekula hidrogén felöli részlegesen pozitív részével kölcsönhatásba lép. Az így kialakuló kölcsönhatást hidrogénkötésnek nevezzük. A kialakuló a hidrogénkötés több molekulára is kiterjedhet. Egyszerűsített ábrázolással: TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

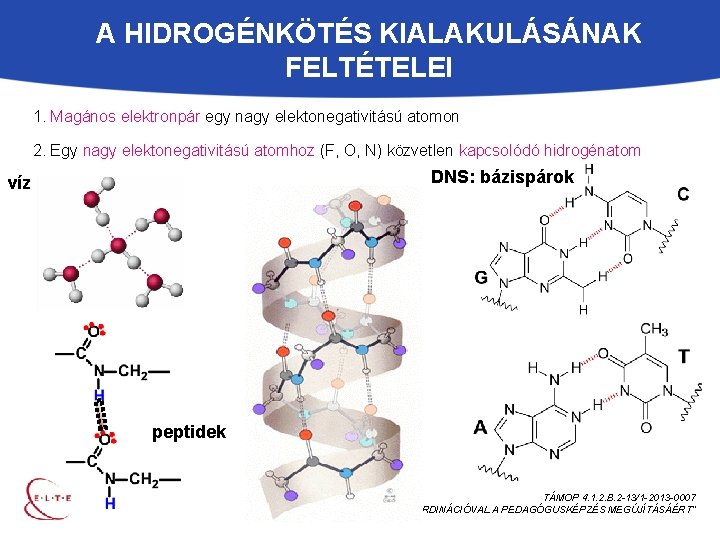
A HIDROGÉNKÖTÉS KIALAKULÁSÁNAK FELTÉTELEI 1. Magános elektronpár egy nagy elektonegativitású atomon 2. Egy nagy elektonegativitású atomhoz (F, O, N) közvetlen kapcsolódó hidrogénatom DNS: bázispárok víz peptidek TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

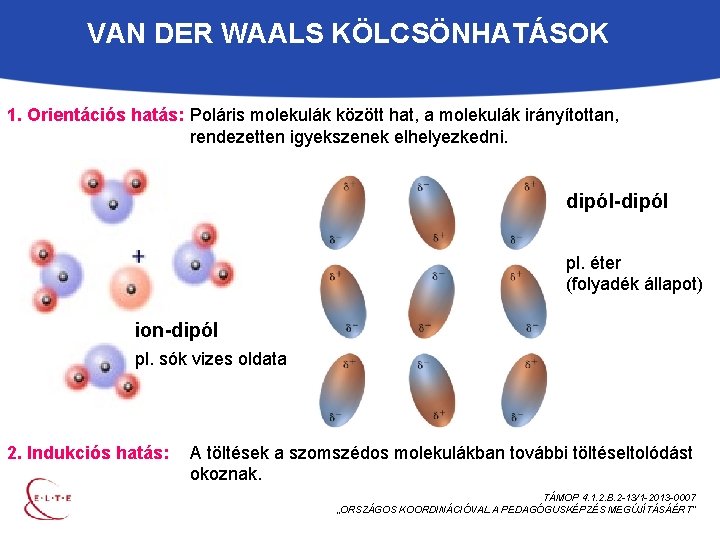
VAN DER WAALS KÖLCSÖNHATÁSOK 1. Orientációs hatás: Poláris molekulák között hat, a molekulák irányítottan, rendezetten igyekszenek elhelyezkedni. dipól-dipól pl. éter (folyadék állapot) ion-dipól pl. sók vizes oldata 2. Indukciós hatás: A töltések a szomszédos molekulákban további töltéseltolódást okoznak. TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

VAN DER WAALS KÖLCSÖNHATÁSOK 3. Diszperziós hatás: Az atomburok és az atommag egymáshoz képesti rezgés miatt jön létre. Pl. : alkánok (paraffin), kondenzált nemesgázok apoláris molekula fluktuáció másik apoláris molekula Johannes Diderik van der Waals (1837 1923) Nobel-díj: 1910 TÁMOP 4. 1. 2. B. 2 -13/1 -2013 -0007 „ORSZÁGOS KOORDINÁCIÓVAL A PEDAGÓGUSKÉPZÉS MEGÚJÍTÁSÁÉRT”

KÖSZÖNÖM A FIGYELMET!