A estrutura do tomo Parte 1 Rosngela Moreira

















- Slides: 18

A estrutura do átomo Parte 1 Rosângela Moreira

A idéia de átomo provavelmente é uma das mais primitivas da física. Seu conceito foi originado pelos gregos, dando a esta partícula o nome átomo, que em grego significa “indivisível”. O nome foi bem aceito até o início do século XX, quando Einstein conseguiu mostrar que era possível partir um átomo e obter uma grande quantidade de energia, que pode ser muito útil por exemplo no fornecimento de energia elétrica a uma grande cidade, ou então nefasta, quando utilizada em bombas atômicas. A idéia inicial dos gregos era de um átomo rígido e sólido. No entanto, já no século XIX, vários físicos e químicos tentavam explicar o átomo como sendo constituído por outras partículas ainda menores, como os prótons, elétrons e nêutrons. No final da década de 1930, foram descobertas partículas ainda menores, entre elas as denominadas múons, píons e káons. Hoje em dia, existe um número tão grande de partículas que nem o alfabeto grego foi suficiente para a denominação de todas elas. Desta forma, tais partículas são simplesmente associadas a números.

Toda a matéria é constituída de átomos. . . Sua constituição… Núcleo - região constituída basicamente por dois tipos de partículas. - prótons (apresentam massa e dotadas de carga elétrica positiva). - nêutrons (apresentam massa praticamente igual a do prótons e possuem carga elétrica nula). Eletrosfera - região constituída pelos elétrons. - elétrons são partículas que apresentam massa extremamente reduzida, dotadas de carga elétrica negativa e de valor absoluto igual a dos prótons.

Partículas Fundamentais do Átomo partícula carga relativa massa relativa próton +1 1 nêutron 0 1 elétron -1 1/1836 Todo o átomo é eletricamente neutro, ou seja, o número de prótons é igual ao número de elétrons. É possível, porém, eletrizar um corpo. . . Se o número de elétrons for maior que o número de prótons dizemos que o corpo estará carregado negativamente; se o número de elétrons for menor que o número de prótons dizemos que o corpo estará eletrizado positivamente.

Uma característica importante do núcleo é que ele determina o tipo químico do elemento que representa, por causa do número de prótons que contém. n O hidrogênio (símbolo químico, H) é o mais leve e o mais simples de todos os elementos químicos, e é também de longe o elemento mais abundante no universo. O núcleo dum átomo de hidrogénio consiste de um só próton e de um só nêutron. Hélio (símbolo químico, He) é o próximo elemento mais leve, e o segundo mais abundante, constituindo mais que 25% da matéria no universo. Um núcleo normal de hélio contém dois prótons e dois nêutrons. Por ele ter dois prótons tem que ter dois elétrons orbitando na nuvem à volta do núcleo para estar eletricamente neutro. n Os núcleos mais pesados, como o do ferro ou do urânio, contém mais nêutrons que prótons, mas o número de elétrons tem que ser sempre igual ao número de prótons para o átomo estar eletricamente neutro. n

ELEMENTOS QUÍMICOS n Os átomos são diferentes uns dos outros devido as quantidades destas partículas nele existentes. O elementos químico Hidrogênio, por exemplo, possui apenas um próton e um elétron em sua órbita. Já os átomos do elemento metálico ferro possuem 26 prótons, 30 nêutrons (em média) formando o seu núcleo, e 26 elétrons divididos em 4 camadas na eletrosfera Número Atômico (Z): é a quantidade de prótons que existe no núcleo do átomo, pois deles dependem os elétrons e o número de camadas que o átomo terá. Pode-se representar o Número Atômico (Z) por um número abaixo e a esquerda do símbolo do elemento. n Massa Atômica (A): é a massa total do átomo, ou seja, a soma dos prótons e dos nêutrons. Representamos a Massa Atômica (A) por um número acima e a esquerda do símbolo do elemento. No caso do ferro será A = 26 prótons + 30 nêutrons = 56. n

Curiosidades A despeito de seu minúsculo tamanho, o átomo é uma complexa combinação de componentes ainda menores. O diâmetro de um átomo é da ordem de 10 -8 cm, enquanto que o de seu núcleo é de cerca de 10 -12 cm. Algo equivalente a comparação entre os tamanhos de uma formiga e do Maracanã. n Essencialmente o átomo consiste de um núcleo, em torno do qual há uma região dita eletrosfera. O átomo contém um núcleo composto por prótons e nêutrons, com elétrons girando ao seu redor. Numa simples gota d'água, existem cerca de 6. 000 de átomos. 6. 1021átomos n


ÁTOMO Número atômico ( Z ): é o numero de prótons de um átomo. Z = P n Numero de massa (A ): é a soma de prótons e nêutrons de um átomo. A = p + n n Através de Z e A pode-se determinar o numero de partículas fundamentais do átomo, levando em conta que: n Num átomo neutro, isolado o numero de elétrons é igual ao numero de prótons, logo é p = e = Z. O numero de nêutron ( n ) é igual ao numero de massa ( A ) menos o numero de prótons ( p ), ou: n = A - p ou n = A - Z Resumindo… p = e e = p n =A – p ou n = A – Z Z = e A = p + n ou A = Z + n n

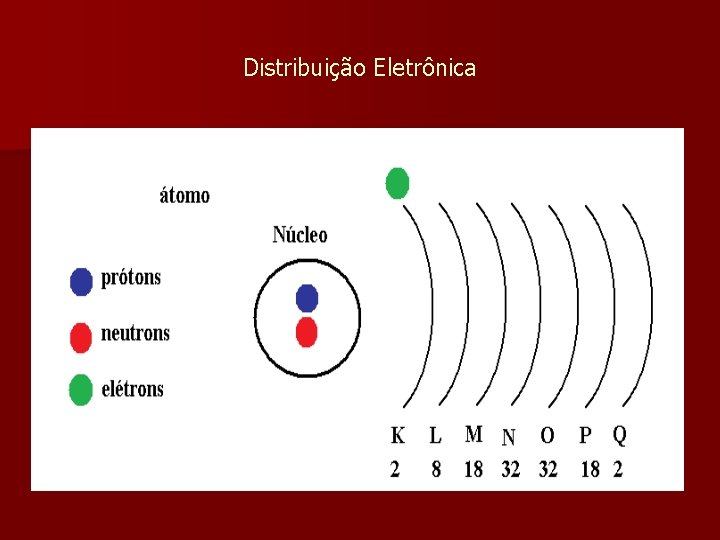
Distribuição Eletrônica

n

Camadas do átomo O número de camadas varia de acordo com o número de elétrons que o átomo possui. n Em qualquer átomo, exceto no paládio, o número de elétrons da última camada não ultrapassa a 8: a camada K comporta no máximo 2 elétrons. n Para os átomos com mais de 3 camadas, enquanto a penultima não estiver completa com 18 elétrons, a última terá no máximo, 2 elétrons. n

Exercício Faça a distribuição eletrônica para os seguintes elementos: a) Sódio Z = 11 b) Calcio Z = 20 c) Potássio Z = 19 d) Zircônio Z = 40

Sódio Z = 11 n K = 2 n L = 8 n M = 1

Calcio Z = 20 n K = 2 n L = 8 n M = 8 n N = 2

Potássio Z = 19 n K =2 n L = 8 n M= 8 n N = 1

Zircônio Z = 40 n K = 2 n L = 8 n M = 18 n N = 10 n O = 2

Ter amigos é ocupar-se com eles, mesmo que seja apenas para contemplá-los quando eles nem estão percebendo a sua presença.
 Sangrado rojo rutilante
Sangrado rojo rutilante Portal aprendere
Portal aprendere Que es el aprendizaje significativo ejemplos
Que es el aprendizaje significativo ejemplos Farm 212
Farm 212 Moreira
Moreira Esdras cabus moreira
Esdras cabus moreira Felipe moreira
Felipe moreira Christel moreira
Christel moreira Area moreira
Area moreira Rizia moreira
Rizia moreira Rua diogo moreira 184
Rua diogo moreira 184 Associação padre moreira
Associação padre moreira Quais são as partes da missa?
Quais são as partes da missa? Cinco decimales
Cinco decimales Los invitamos a ser parte
Los invitamos a ser parte Este parte aquele parte
Este parte aquele parte Leo primero tomo 1 primero basico
Leo primero tomo 1 primero basico Nivel subestandar de lenguaje ejemplos
Nivel subestandar de lenguaje ejemplos 10 november diperingati sebagai hari pahlawan
10 november diperingati sebagai hari pahlawan



































