ZKLADN KOLA SLOVAN KROM PSPVKOV ORGANIZACE ZEYEROVA 3354







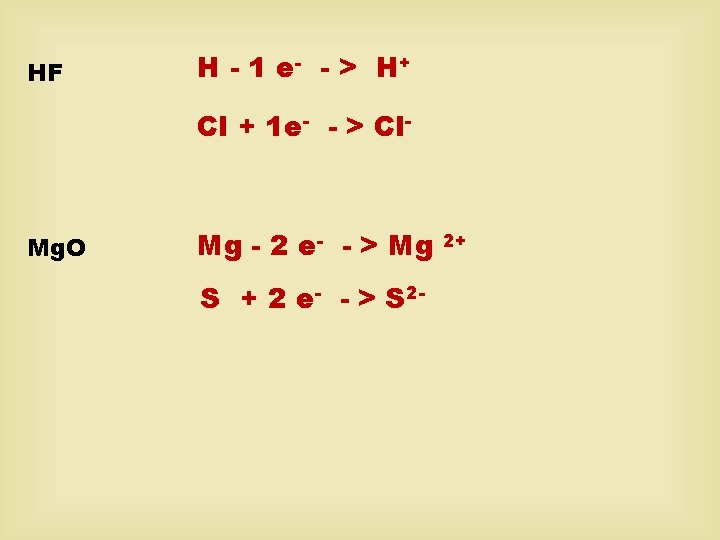

- Slides: 14

ZÁKLADNÍ ŠKOLA SLOVAN, KROMĚŘÍŽ, PŘÍSPĚVKOVÁ ORGANIZACE ZEYEROVA 3354, 767 01 KROMĚŘÍŽ projekt v rámci vzdělávacího programu VZDĚLÁNÍ PRO KONKURENCESCHOPNOST ŠABLONA ČÍSLO: III/2 NÁZEV: INOVACE A ZKVALITNĚNÍ VÝUKY PROSTŘEDNICTVÍM ICT PŘEDMĚT: Chemie ROČNÍK: 8. ročník TÉMA: Chemická vazba AUTOR: Ing. Pavla Zezulová DATUM VYTVOŘENÍ: 18. 10. 2012 VY_32_INOVACE_39_PZ

Anotace Materiál je určen především pro žáky osmého ročníku, ale lze jej použít i v devátém ročníku v rámci úvodního opakování učiva. Vysvětluje podstatu chemické vazby a jejich základních typů. Pro lepší názornost jsou použity jednoduché animace znázorňující pohyb elektronů mezi jednotlivými atomy. Součástí materiálu jsou příklady určené k procvičování učiva. Klíčové pojmy: chemická vazba, elektronegativita, valenční elektrony, kovalentní polární a nepolární vazba, iontová vazba, kation, anion Pilotáž Materiál byl ověřován ve všech paralelních třídách osmého ročníku. Žáci velmi dobře reagovali na animace vzniku vazeb – zejména slabším žákům pomohly v pochopení učiva. Drobné problémy se vyskytly u procvičování zápisu vzniku iontů.


- vazba mezi atomy v molekule pomocí valenčních elektronů - atom musí mít elektronegativitu (schopnost přitahovat valenční elektrony od jiných atomů) - vzácné plyny nemají elektronegativitu, netvoří molekuly, jsou neslučivé - inertní


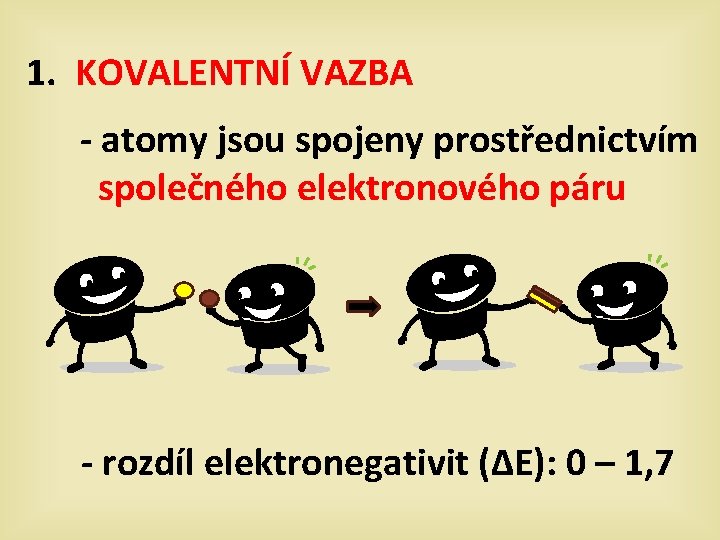
1. KOVALENTNÍ VAZBA - atomy jsou spojeny prostřednictvím společného elektronového páru - rozdíl elektronegativit (∆E): 0 – 1, 7

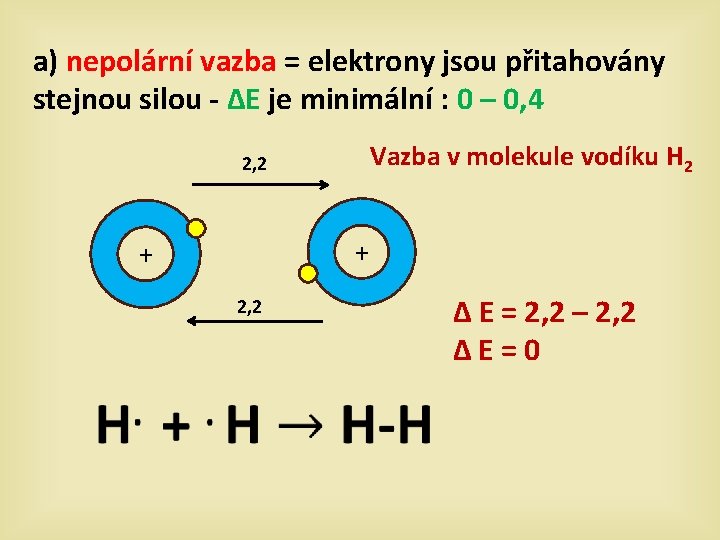
a) nepolární vazba = elektrony jsou přitahovány stejnou silou - ∆E je minimální : 0 – 0, 4 Vazba v molekule vodíku H 2 2, 2 + + 2, 2 ∆ E = 2, 2 – 2, 2 ∆E=0

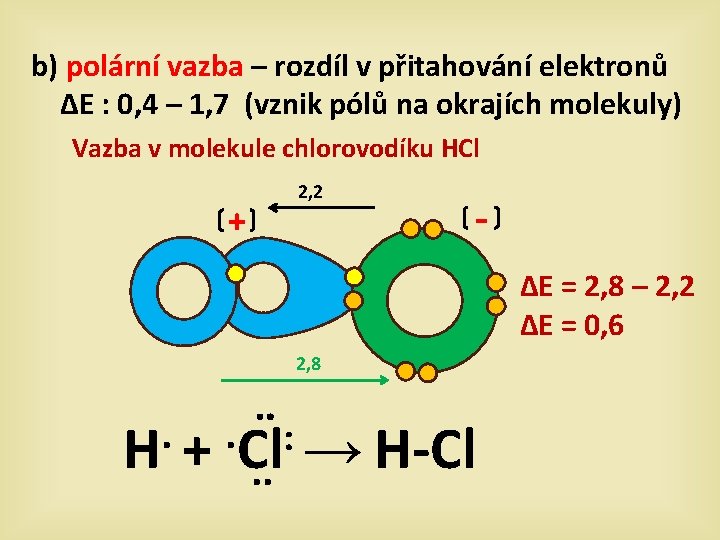
b) polární vazba – rozdíl v přitahování elektronů ∆E : 0, 4 – 1, 7 (vznik pólů na okrajích molekuly) Vazba v molekule chlorovodíku HCl + 2, 2 ∆E = 2, 8 – 2, 2 ∆E = 0, 6 2, 8 . . ¨ : H + Cl → H-Cl. .

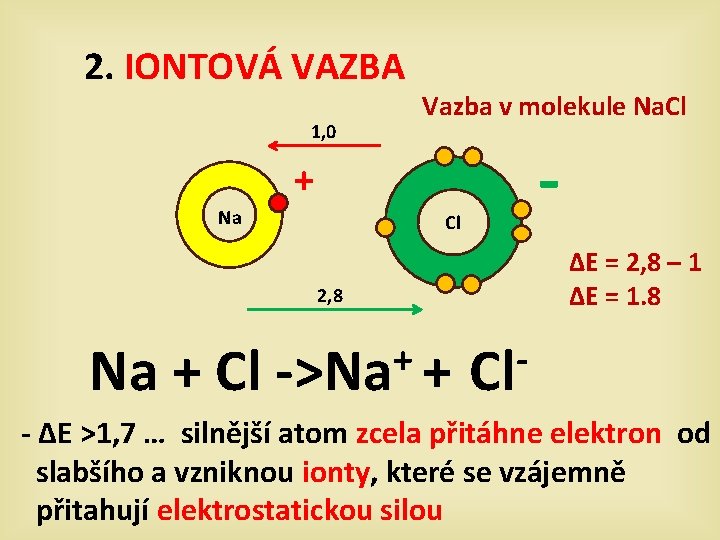
2. IONTOVÁ VAZBA 1, 0 Vazba v molekule Na. Cl - + Na Cl ∆E = 2, 8 – 1 ∆E = 1. 8 2, 8 Na + Cl + ->Na + Cl - ∆E >1, 7 … silnější atom zcela přitáhne elektron od slabšího a vzniknou ionty, které se vzájemně přitahují elektrostatickou silou

Ion je elektricky nabitá částice, která vzniká z atomu připojením nebo odtržením valenčních elektronů. KATION – kladně nabitý ion Na - 1 e- - > Na+ Ca - 2 e- - > Ca 2+ ANION – záporně nabitý ion Cl + 1 e- - > Cl. S + 2 e- - > S 2 -

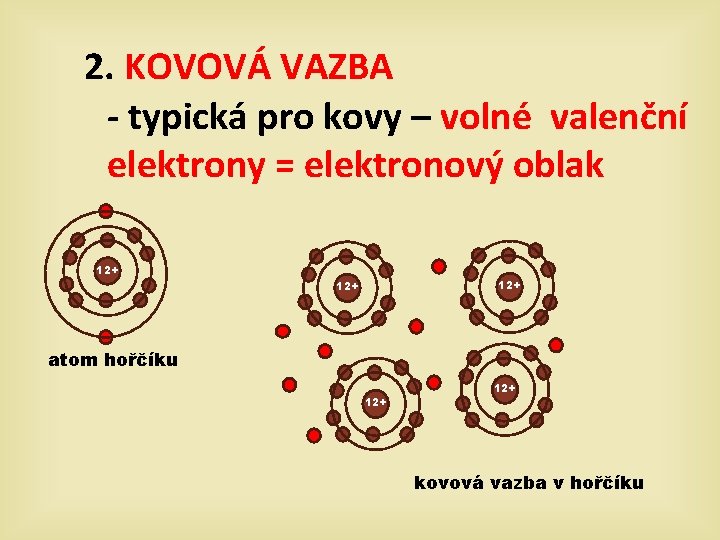
2. KOVOVÁ VAZBA - typická pro kovy – volné valenční elektrony = elektronový oblak 12+ 12+ atom hořčíku 12+ kovová vazba v hořčíku

Urči typ chemické vazby: (v případě iontové vazby zapiš rovnice vzniku iontů) Cu. S E(Cu)=1, 7 E(S)=2, 4 ∆E=0, 7 kovalentní polární CO E(C)=2, 5 E(O)=3, 5 ∆E=1 HF E(H)=2, 2 E(F)=4, 1 ∆E=1, 9 kovalentní polární iontová Ag. Br E(Ag)=1, 4 E(Br)=2, 7 ∆E=1, 3 kovalentní polární Mg. O E(Mg)=1, 2 E(O)=3, 5 ∆E=2, 3 iontová H 2 S E(H)=2, 2 E(S)=2, 4 ∆E=0, 2 kovalentní nepolární Pb. Cl 2 E(Pb)=1, 3 E(Cl)=2, 8 ∆E=1, 5 kovalentní polární
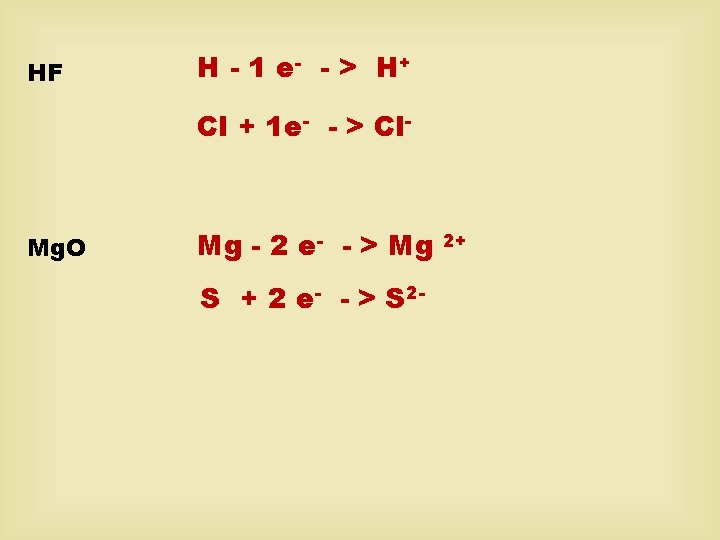
HF H - 1 e - - > H+ Cl + 1 e- - > Cl- Mg. O Mg - 2 e- - > Mg S + 2 e- - > S 2 - 2+

Zdroje LOS, P. , HEJSKOVÁ, J. , KLEČKOVÁ, M. Nebojte se chemie. 1. vyd. Praha: Scientia 1994, ISBN 80 -85827 -69 -0. s. 25 - 26 Ilustrace http: //office. microsoft. com/cs-cz/