Voda H 2 O Vskyt l 3 skupenstv









- Slides: 12

Voda H 2 O

Výskyt l 3 skupenství l Téměř ¾ povrchu Země … 97, 2% slaná l Lidské tělo … 50 -72%, l denní spotřeba 2 - 3 litry l Nejvýznamnější biogenní sloučenina

1. vypařování - 2. kondenzace - 3. srážení - 4. déšť, prosakování - 5. vodní toky - a opět vypařování…

Význam l l l l l Je základní podmínkou života. Ve vodě vznikl život. Je to rozpouštědlo, ve kterém probíhají veškeré chemické děje v organismu. Lidské tělo obsahuje 70 % a rostliny až 90 % vody. Už ztráta 20 % tělesné vody je smrtelná. Na dehydrataci člověk umírá asi během 7 dnů. (Podle Guinnesovy knihy rekordů vydržel bez vody nejdéle jeden mladý Rakušan, kterého policie zapomněla v cele pro zadržené. Našla ho po 18 dnech na prahu smrti. ) Je nejdůležitější surovinou všech průmyslových odvětví, používá se ke chlazení, ohřevu, oplachu, k výrobě elektrické energie ve formě páry a v potravinářství k výrobě nápojů atd. Je základní podmínkou rostlinné a živočišné výroby Je zdrojem obživy v přímořských státech Vodní toky (řeky) a plochy (oceány, moře, jezera) hrají významnou roli v dopravě. Přítomnost vodních ploch má vliv na klima krajiny. Voda je využívána při rekreaci a sportu. Minerální voda má léčivé účinky. Obsah vody v některých potravinách: máslo 18 % chléb 40 % sýr 30 až 60 % jogurt, mléko 87, 5 % maso 60 -75 % jablko, hruška 85 % vodní meloun 90 % mrkev 94 % okurky, rajčata 98 %

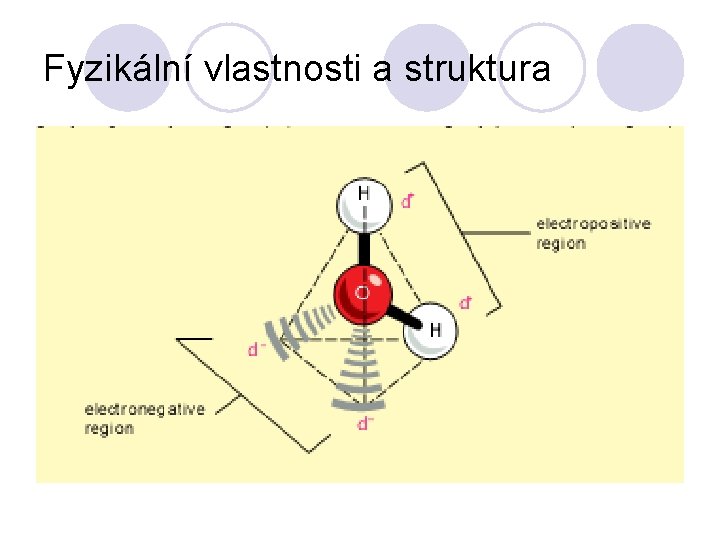
Fyzikální vlastnosti a struktura


Voda je za normální teploty bezbarvá, v silné vrstvě namodralá kapalina bez chuti a zápachu. Její teplota varu a tání je (100°C a 0 °C)tvoří základní body Celsiovy teplotní stupnice. ( tlak ? ) Při přechodu do pevného stavu vzrůstá objem o 10% a led plave na vodě, protože má menší hustotu než kapalná voda. Molekuly vody jsou lomené, kovalentní vazby O-H jsou silně polární, Dva volné (nevazebné) elektronové páry na kyslíku a polarita vazeb způsobují, že molekuly vody jsou polární (mají dipólový moment) Izolované molekuly H 2 O jsou jen ve vodní páře. V kapalné vodě se jednotlivé molekuly sdružují (asociují) prostřednictvím vodíkových vazeb. …tepelná vodivost, povrchové napětí, velké měrné teplo

Chemické vlastnosti • l l l Voda patří mezi nejstálejší sloučeniny, nepatrně se rozkládá na výchozí prvky až za velmi vysokých teplot. S vysoce reaktivními alkalickými kovy alkalických zemin (Ca, Sr, Ba) reaguje bouřlivě za běžné teploty, přičemž vzniká vodík a příslušný hydroxid, např. : 2 Na(s) + 2 H 2 O(l) -> 2 Na+(aq) + 2 OH- (aq) + H 2(g)Lodička, vodalodicka 2. mpg, Je voda vždy hasební prostředek ? vodaMg+H 2 O. mpg Acidobazické vlastnosti vodyvodaFlex. Int. UcebniceStart. htm chemicky je voda známá jako reaktant nebo reakční produkt, jako reakční prostředí při mnoha důležitých reakcích. NADH + H+ + 1/2 O 2 NAD+ + H 2 O

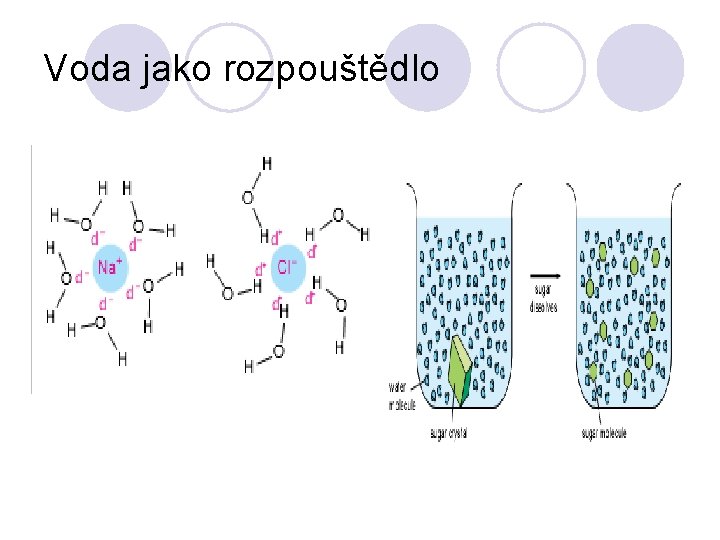
Voda jako rozpouštědlo

Přírodní voda není nikdy chemicky čistá. Podle jejího původu jsou v ní rozpuštěny různé látky, někdy obsahuje i látky suspendované. Celkovou tvrdost můžeme rozdělit na přechodnou, tj. uhličitanovou a na stálou. Přechodnou (karbonátovou) tvrdost vody způsobují rozpustné hydrogenuhličitany a to především hydrogenuhličitan vápenatý Ca(HCO 3)2 a hydrogenuhličitan hořečnatý Mg(HCO 3)2; tuto tvrdost vody lze odstranit převařením - dekarbonizací: Ca(HCO 3)2 → Ca. CO 3 + H 2 O + CO 2 Mg(HCO 3)2 → Mg. CO 3 + H 2 O + CO 2. Vařením se však nezbavíme tvrdosti trvalé (nekarbonátové), za kterou jsou odpovědné především sírany, a to síran vápenatý Ca. SO 4 a síran hořečnatý Mg. SO 4. K jejich odstranění používáme srážení působením hydroxidu vápenatého Ca(OH)2 a uhličitanu sodného Na 2 CO 3: Ca(HCO 3)2 + Ca(OH)2 → 2 Ca. CO 3 + 2 H 2 O Mg(HCO 3)2 + Ca(OH)2 → Ca. CO 3 + Mg. CO 3 + 2 H 2 O Mg. SO 4 + Ca(OH)2 → Ca. SO 4 + Mg(OH)2 Ca. SO 4 + Na 2 CO 3 → Ca. CO 3 + Na 2 SO 4, čímž se rozpustné hydrogenuhličitany a sírany převedou na méně rozpustné normální uhličitany, a to uhličitan vápenatý a uhličitan hořečnatý, resp. hydroxid hořečnatý.

Pitná voda se získává úpravou surové vody. Surová voda se získává v České republice z podzemních (asi 45 -55 %) nebo povrchových (asi 45 -55 %) zdrojů. Z některých zdrojů - zejména podpovrchových - je možné získat pitnou vodu bez úpravy. http: //projektysipvz. gytool. cz/Projekty. SIPVZ/Default. aspx? uid=132

Odpadní vody - ČOV
 Voda proste
Voda proste Voda u atmosferi
Voda u atmosferi Voda jako rozpouštědlo
Voda jako rozpouštědlo Voda se vypařuje z
Voda se vypařuje z Projekt voda
Projekt voda Voda u prirodi prezentacija
Voda u prirodi prezentacija Darcyev zakon
Darcyev zakon Vladimir nazor voda analiza likova
Vladimir nazor voda analiza likova Miesto kde vyviera voda zo zeme sa nazýva
Miesto kde vyviera voda zo zeme sa nazýva Voda prezentace chemie
Voda prezentace chemie Reakcii so voda
Reakcii so voda Panoramatická pojmová mapa
Panoramatická pojmová mapa Akým spôsobom sa dá získať sladká voda z morskej
Akým spôsobom sa dá získať sladká voda z morskej