VOD DO STUDIA CHEMIE Chemie je prodn vda














- Slides: 17

ÚVOD DO STUDIA CHEMIE

Chemie je přírodní věda, která zkoumá strukturu látek, jejich vlastnosti a reakce, zjišťuje jejich vliv na životní prostředí, zkoumá nové zdroje surovin (např. bioplyn), řeší problém likvidace chemických látek

Obory chemie • 1. chemie obecná –obecné zákonitosti společné pro ostatní chem. disciplíny (stavbu látek, složení látek a průběhy chemických dějů) • 2. anorganická chemie – sloučeniny všech prvků PSP, kromě některých sloučenin uhlíku • 3. organická chemie – všechny sloučeniny uhlíku (kromě CO 2, CO, H 2 CO 3 a uhličitanů), patří sem sloučeniny uhlíku s H, O, N, P, Ca, S Obory příbuzné (chemie fyzikální, analytická - kvalitativní a kvantitativní rozbory, jaderná, biochemie, geochemie, makromolekulární chemie, agrochemie…)

Základní chemické pojmy • Látka - hmota složená z atomů, molekul nebo iontů, má určité skupenství a charakteristické vlastnosti v celém svém objemu a) skupenství: - pevné (solid) H 2 O(s) - kapalné (liquid) H 2 O(l) - plynné (gas) H 2 O(g) - plazma skupenství závisí na tt, tv a hustotě b) vlastnosti: fyzikální a chemické

ATOM • Základní stavební nejmenší částice hmoty

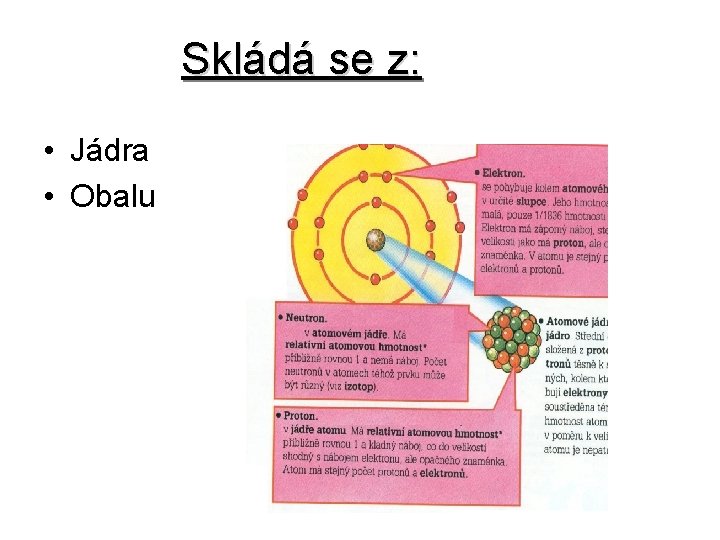
Skládá se z: • Jádra • Obalu


Stavba atomu Rel. hmotnost náboj částice Proton p 1 +1 tvoří jádro nukleony Neutron n 1 Elektron e 0 nemá jádro -1 obal

Atom je elektroneutrální částice (bez náboje) Obsahuje: stejný počet protonů a elektronů !!! Na neutronech nezáleží – bez náboje !!!

Počet protonů v jádře atomu udává protonové číslo Z Zároveň protonové číslo udává počet elektronů v obalu atomu Dále existuje nukleonové (hmotnostní číslo) A, které udává počet protonů a neutronů v jádře atomu A=16 Z= 8 O

Nuklidy – atomy se stejným počtem atomů i neutronů (stejné Z a A) Izotopy – atomy prvků, které mají stejné protonové číslo, ale různé hmotnostní číslo = soubor nuklidů 2 3 příklad: 11 H H 1 1 H - liší se počtem neutronů - hydrogenium H, deuterium D (těžká voda), tritium T (radioaktivní vodík) -výjimečně se používají značky D, T pro izotopy, přestože se jedná o stejný prvek

Prvky – látky složené z atomů se stejným Z - směs izotopů vyskytujích se v přírodě (hmotnostní číslo je průměr hmotn. č. těchto izotopů) Sloučeniny - látky tvořené atomy dvou a více prvků Elektroneutrální atom – má stejný počet protonů a elektronů

ION - IONTY Je částice s kladným nebo záporným nábojem Všechno závisí na elektronech !!! Jádro zůstává nedotčeno Pokud jsou kladné, pak jsou to Sn +2 kationty Pokud jsou záporné, pak jsou to anionty N -3

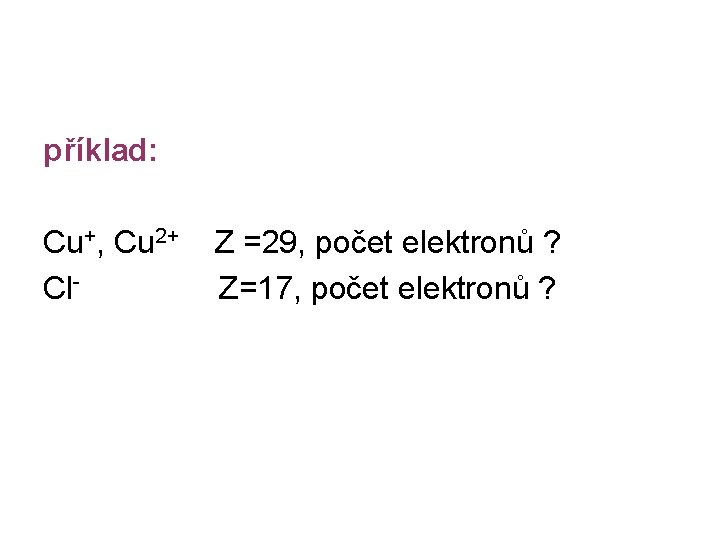
příklad: Cu+, Cu 2+ Cl- Z =29, počet elektronů ? Z=17, počet elektronů ?

Elektronegativita – schopnost atomu přitahovat elektrony (vznik iontů) Oxidační číslo – náboj prvku v chem. vazbě sloučeniny (ox. č. volných prvků je 0) - elektronegativnější prvek elektrony přitáhne a mění se na anion (počet protonů se nemění!) - nabývá kladných i záporných hodnot - H 2 O →H+ + OH- (elektr. H = 2, 2; O= 3, 5)

Molekula – skupina dvou nebo více atomů spojených chemickými vazbami, je elektroneutrální, zapisuje se pomocí vzorců (které vyjadřují počet atomů daného prvku) a) jednoprvkové H 2, O 3 b) z více prvků H 2 O, H 2 SO 4

Relativní atomová hmotnost Ar - číslo bezrozměrné - v tabulkách jako hmotnostní číslo A - kolikrát je hmotnost atomu větší než 1/12 hmotnosti atomu uhlíku 12 C ( 1, 66. 10 -27 kg) nebo než atom vodíku Relativní molekulová hmotnost Mr - číslo bezrozměrné - součet Ar všech prvků v molekule př. Mr : HCl = 1 + 35 = 36 (NH 4)2 SO 4 = 2(14+4) + 32 + 4. 16 = 132

































