UNIVERZITA KONTANTNA FILOZOFA FAKULTA PRRODNCH VIED PRVKY p











- Slides: 13

UNIVERZITA KONŠTANTÍNA FILOZOFA FAKULTA PRÍRODNÝCH VIED PRVKY p Vypracovala: Jana Romaňáková 4. ročník, BI-CHE

Základná charakteristika: n ako p prvky označujeme prvky 6 skupín periodickej sústavy/od VIII. A. po III. A. skupinu/ n ich atómy obsahujú vo valenčnom orbitále s 2 elektróny a v orbitáloch p 1 až 6 elektrónov n celkový počet valenčných orbitálov je zhodný s číslom skupiny, v ktorej sa prvok nachádza

PRVKY p : 6 1. prvky 2. prvky 3. prvky 4. prvky 5. prvky 6. prvky p -vzácne plyny p - halogény p - chalkogény p³-prvky V. A. skupiny p²- prvky IV. skupiny p¹ -prvky III. A. skupiny vzácne plyny

hélium: Vzácne plyny: Elektr. štruktúra neónu: argón: elektr. štruktúra radónu:

n medzi vzácne plyny zaraďujeme: hélium, neón, argón, kryptón, xenón a radón n nachádzajú n valenčné sa v VIII. A. skupine orbitály ich atómov sú plne obsadené ôsmimi elektrónmi/pri héliu len dvoma-1 s²/

n stabilita celkom obsadených valenčných orbitálov bola príčinou, že sa vzácne plyny považovali za chemicky inertné /nereaktívne/ nv roku 1962 sa podarilo pripraviť prvé zlúčeniny xenónu s prvkami, ktoré majú veľkú elektronegativitu napr. Xe. F 6 -fluorid xenónový , Xe. O 3 -oxid xenónový.

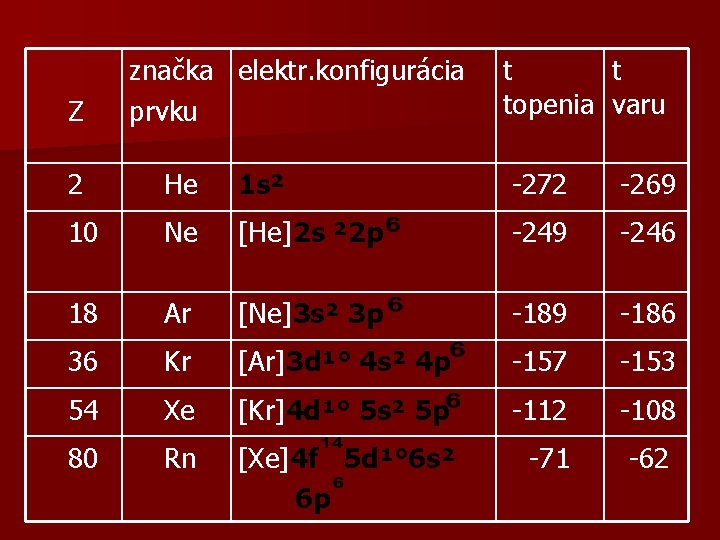
Z značka elektr. konfigurácia prvku t t topenia varu 2 He 1 s² -272 -269 10 Ne [He]2 s ² 2 p -249 -246 18 Ar [Ne]3 s² 3 p -189 -186 36 Kr [Ar]3 d¹° 4 s² 4 p -157 -153 54 Xe [Kr]4 d¹° 5 s² 5 p -112 -108 80 Rn [Xe]4 f 5 d¹° 6 s² 6 p -71 -62

Výskyt: n vzácne plyny sa vyskytujú v malom množstve vo vzduchu n získavajú sa frakčnou destiláciou ako vedľajší produkt pri výrobe dusíka a kyslíka n najrozšírenejší z nich je vo vesmíre hélium/w=25%/

Použitie vzácnych plynov: používajú sa ako náplň osvetľovacích trubíc /výbojky/ n n rádioaktívny radón sa v silne zriedených roztokoch používa na liečebné účely

Hélium: n má najnižšiu teplotu topenia a varu n je vynikajúci vodič elektrického prúdu, a má veľmi malú viskozitu tzv. supravodivosť n používa sa ako ochranný plyn v špeciálnom hutníctve, napr. pri výrobe titánu, tiež ako inertná atmosféra, v žiarovkách, výplň okien

Zrhnutie: 1. Ktoré prvky zaraďujeme medzi vzácne plyny? 2. Ich atómy sú obsadené. . . . . elektrónmi. 3. Ktorý prvok zo vzácnych plynov je najrozšírenejší?

Skontrolujme sa: 1. Medzi vzácne plyny zaraďujeme: hélium, neón, argón, kryptón a radón. 2. Ich atómy sú obsadené ôsmimi elektrónmi. 3. Najrozšírenejší prvok je: hélium.

Ďakujem za pozornosť!

























