TERMODINMICA Ciencia que estudia las transferencias energticas que















- Slides: 20

TERMODINÁMICA: Ciencia que estudia las transferencias energéticas que acompaña a los procesos físicos y químicos

Si el estudio se aplica a un cambio químico se denomina TERMOQUÍMICA Toda reacción obedece a dos leyes fundamentales: 1. - Ley de conservación de la masa o Ley de Lavoisier: Durante una reacción química no se puede ni crear ni destruir materia 2. - Ley de conservación de la energía: La energía no se crea ni se destruye, solo podrá transferirse o transformarse. (enunciado más simple del primer principio de la termodinámica)

Reactivos Productos ; E Esta variación de energía puede ser luminosa (h. u), eléctrica (Ee), en forma de trabajo mecánico (W) o de calor (Q). Tenemos por tanto una transferencia de energía del sistema al entorno. Entorno (alrededores, medio ambiente) Ejemplo: R P sistema SISTEMA : porción del universo que aislamos para su estudio ENTORNO : todo lo que rodea al sistema

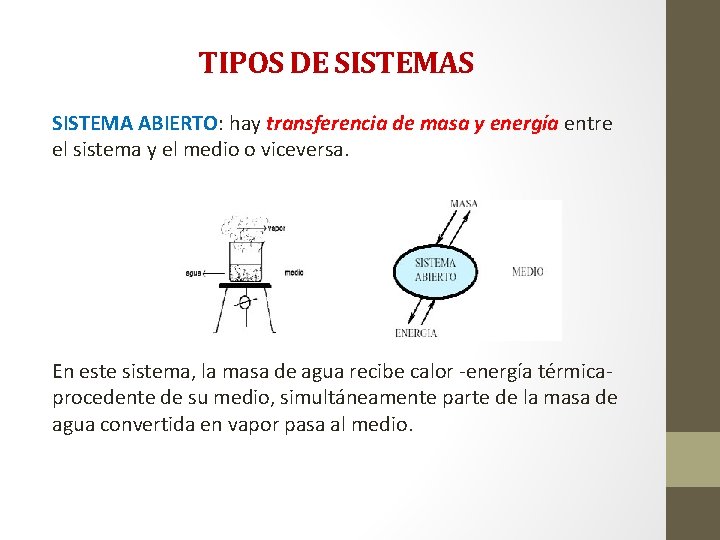
TIPOS DE SISTEMAS SISTEMA ABIERTO: hay transferencia de masa y energía entre el sistema y el medio o viceversa. En este sistema, la masa de agua recibe calor -energía térmica- procedente de su medio, simultáneamente parte de la masa de agua convertida en vapor pasa al medio.

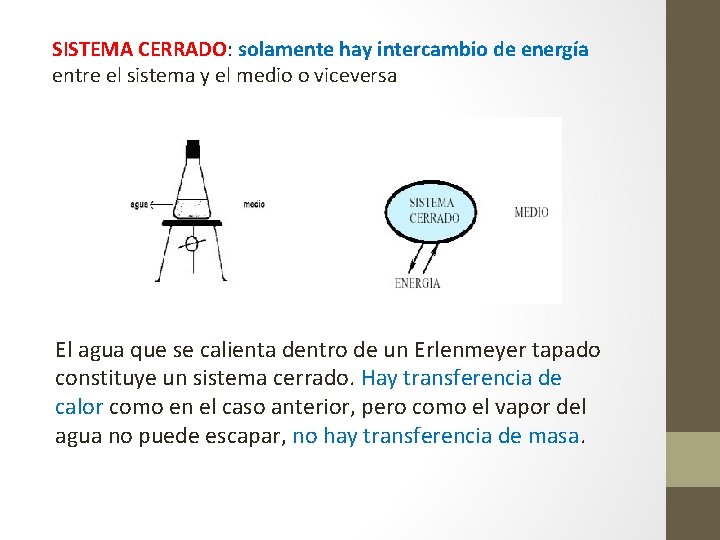
SISTEMA CERRADO: solamente hay intercambio de energía entre el sistema y el medio o viceversa El agua que se calienta dentro de un Erlenmeyer tapado constituye un sistema cerrado. Hay transferencia de calor como en el caso anterior, pero como el vapor del agua no puede escapar, no hay transferencia de masa.

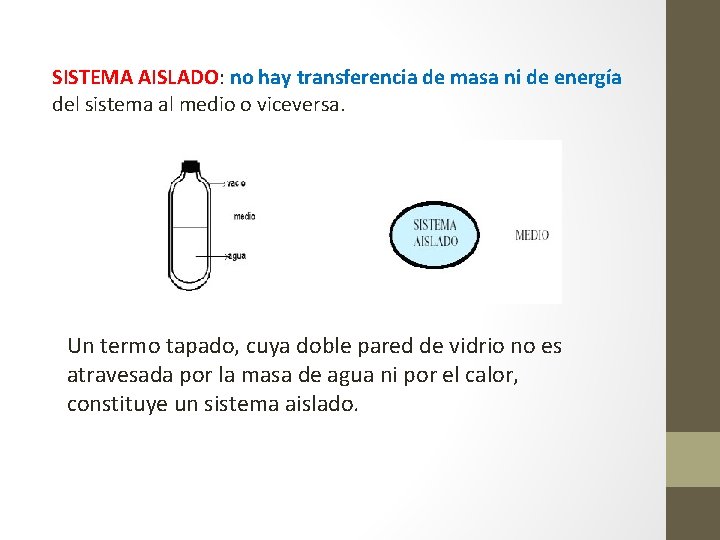
SISTEMA AISLADO: no hay transferencia de masa ni de energía del sistema al medio o viceversa. Un termo tapado, cuya doble pared de vidrio no es atravesada por la masa de agua ni por el calor, constituye un sistema aislado.

ESTADO DE UN SISTEMA. VARIABLES DE ESTADO Y FUNCIONES DE ESTADO Determinar el estado de un sistema es especificar su composición química, la concentración de sus componentes, los valores de la presión, temperatura, volumen, densidad. . . todas estas variables se denominan variables de estado. De estas, se denominan funciones de estado aquellas cuyo valor solo depende del estado del sistema con independencia del camino seguido hasta alcanzarlo.

TRABAJO, CALOR Y ENERGÍA •

TRABAJO MECÁNICO DE EXPANSIÓNCOMPRESIÓN DE UN GAS •

PRIMER PRINCIPIO DE LA TERMODINÁMICA •

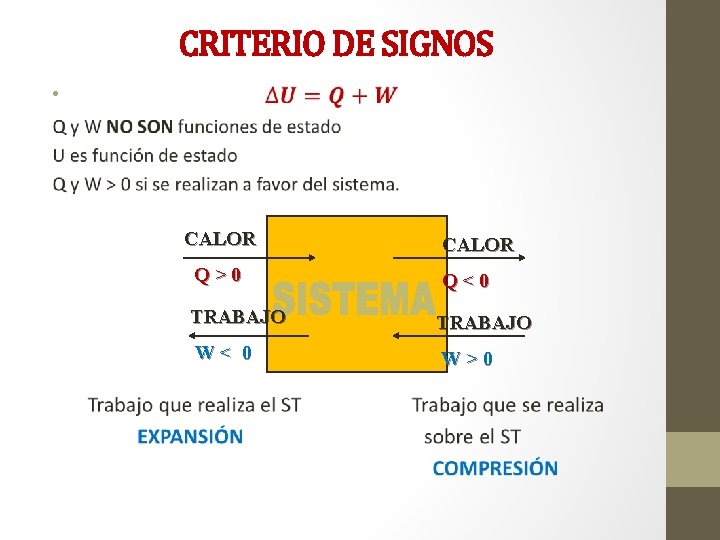
CRITERIO DE SIGNOS • CALOR Q>0 Q<0 TRABAJO W< 0 W>0


PROBLEMA. Calcular la variación de energía interna para el proceso de combustión de un mol de propano a 25ºC y 1 atm, si la variación de entalpía, en estas condiciones, vale -2219, 8 k. J. Nota: R = 8, 3 J/mol. K C 3 H 8(g) + 5 O 2 (g) 3 CO 2 (g) + 4 H 2 O(l) ; H = – 2219, 8 k. J U = H – n · R · T n = 3 + 4 – 1 – 5 = 1 U = -2219, 8 k. J - 1 mol · (8, 3· 10 -3 k. J/mol. K) · 298 K U = – 2222, 27 k. J

ECUACIONES TERMOQUÍMICAS •

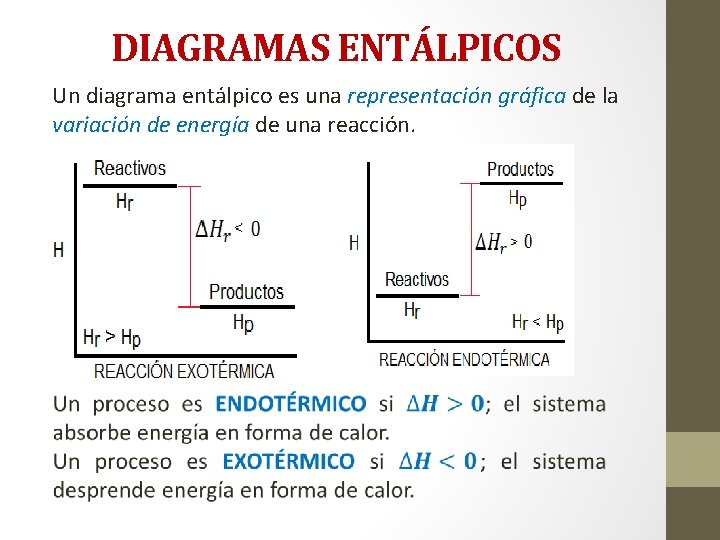
DIAGRAMAS ENTÁLPICOS Un diagrama entálpico es una representación gráfica de la variación de energía de una reacción.

A la variación de entalpía de un proceso se le llama ENTALPÍA DE REACCIÓN, pero hay ocasiones en las que se hace referencia al tipo de proceso: • Entalpía de COMBUSTIÓN: Energía desprendida cuando 1 mol de sustancia arde completamente en oxígeno a P constante. C 3 H 8(g) + 5 O 2 g) 3 CO 2 (g) + 4 H 2 O (l) ; H = – 2219, 8 k. J C 3 H 8(g) + 5 O 2 g) 3 CO 2 (g) + 4 H 2 O (l) + 2219, 8 k. J • Entalpía de DISOCIACIÓN: Es la energía necesaria para descomponer, a P constante, 1 mol de sustancia en sus átomos constituyentes en estado gaseoso. Siempre es + • Entalpías de CAMBIO DE ESTADO (vaporización, fusión, …): Energía puesta en juego cuando 1 mol de sustancia cambia de estado de agregación, a P y T constantes. También se llaman calores latentes. H 2 O (l) H 2 O (g)

ENTALPÍA DE FORMACIÓN Es el incremento entálpico ( H) que se produce en la reacción de formación de un mol de un determinado compuesto a partir de los elementos en estado físico normal (en condiciones estándar, 1 atm y 25ºC). • Se expresa como Hf 0. Se trata de un “calor molar”, es decir, el cociente entre H 0 y el número de moles formados de producto. • Por tanto, se mide en k. J/mol. Ejemplos: C(s) + O 2(g) CO 2(g) ; Hf 0 = – 393’ 13 k. J/mol H 2(g) + ½ O 2(g) H 2 O(l) ; Hf 0 = – 285’ 8 k. J/mol

LEY DE HESS • La entalpía es una función de estado; por tanto, la variación de entalpía de una reacción solo depende de los estados inicial y final y no influye si la reacción se ha llevado a cabo en una o varias etapas. • Se puede calcular aplicando: H 0 = np Hf 0(productos)– nr Hf 0(reactivos) • O aplicando la ley de Hess que establece: “Cuando una reacción química se puede expresar como suma algebraica de varias reacciones, la entalpía de dicha reacción debe ser igual a la suma algebraica de las entalpías de dichas reacciones”

PROBLEMA. Conocidas las entalpías estándar de formación del butano (g), agua líquida y CO 2(g), cuyos valores son respectivamente – 124’ 7, – 285’ 8 y – 393’ 5 k. J/mol, calcular la entalpía estándar de combustión del butano. • La reacción de combustión del butano es: C 4 H 10(g) +13/2 O 2(g) 4 CO 2(g) + 5 H 2 O(l) ; H 0 comb= ? Como: H 0 = np Hf 0(productos) – nr Hf 0(reactivos) = = 4 mol·(– 393’ 5 k. J/mol) + 5 mol·(– 285’ 8 k. J/mol) – 1 mol·(– 124’ 7 k. J/mol) = – 2878’ 3 k. J • Luego la entalpía estándar de combustión será: H 0 combustión = – 2878’ 3 k. J/mol

• H en una reacción química es constante con independencia de que la reacción se produzca en una o más etapas. • Por tanto, si una ecuación química se puede expresar como combinación lineal de otras, podremos igualmente calcular H de la reacción global combinando los H de cada una de las reacciones. Problema: Dadas las reacciones (1) H 2(g) + ½ O 2(g) H 2 O(g) H 10 = – 241’ 8 k. J (2) H 2(g) + ½ O 2(g) H 2 O(l) H 20 = – 285’ 8 k. J calcular la entalpía de vaporización del agua en condiciones estándar. La reacción de vaporización es. . . (3) H 2 O(l) H 2 O(g) H 03 = ? (3) puede expresarse como (1) – (2), luego H 03 = H 01 – H 02 = – 241’ 8 k. J – (– 285’ 8 k. J) = 44 k. J H 0 vaporización = 44 k. J /mol
 La ciencia que estudia las bacterias
La ciencia que estudia las bacterias La química estudia
La química estudia Ciencia formal
Ciencia formal Tejidos animales
Tejidos animales Ciencia que estudia el suelo
Ciencia que estudia el suelo Clases de parrafo
Clases de parrafo Cinco magnitudes escalares
Cinco magnitudes escalares Mapa conceptual de silvicultura
Mapa conceptual de silvicultura +transferencias +exterior +importaciones
+transferencias +exterior +importaciones Termodinmica
Termodinmica Equilibrio termodinamico
Equilibrio termodinamico Termodinmica
Termodinmica Termodinmica
Termodinmica Capacidade termica
Capacidade termica Termodinâmica
Termodinâmica Cv=du/dt
Cv=du/dt Termodinmica
Termodinmica Termodinmica
Termodinmica Termodinmica
Termodinmica Termodinmica
Termodinmica Ejemplo sistema adiabatico
Ejemplo sistema adiabatico