Tema 3 Segundo principio de la termodinmica Entropia














- Slides: 18

Tema 3 Segundo principio de la termodinámica: Entropia y energía libre

ESPONTANEIDAD DE LOS PROCESOS § Un proceso espontáneo es aquel que tiene lugar sin intervención externa. § Berthelot y Thomson establecieron, en 1870, que las reacciones químicas tienen lugar de manera espontánea en el sentido que se liberase calor. § Sin embargo, hay reacciones espontáneas que son endotérmicas: necesitan energía para producirse, o bien se realizan sin aporte energético externo, pero originando una disminución de temperatura. § Ejemplos: § evaporación del agua. § Disolución endotérmica de sales como el KNO 3 § Oxidación del hierro. § Enfriamiento de un cuerpo más caliente que su entorno.

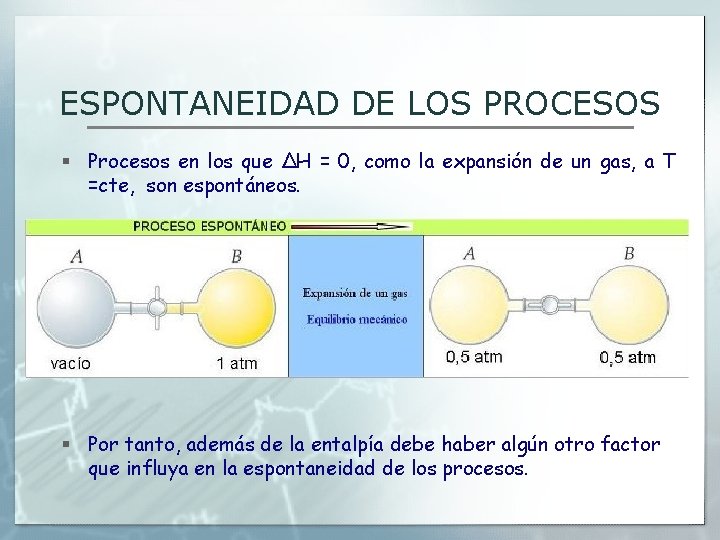
ESPONTANEIDAD DE LOS PROCESOS § Procesos en los que ΔH = 0, como la expansión de un gas, a T =cte, son espontáneos. § Por tanto, además de la entalpía debe haber algún otro factor que influya en la espontaneidad de los procesos.

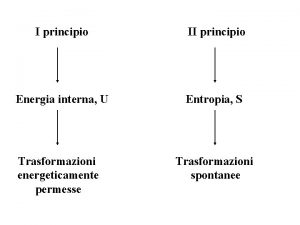
SEGUNDO PRINCIPIO DE LA TERMODINÁMICA § Los sistemas evolucionan espontáneamente en el sentido que aumente el desorden. Es decir: “ en un proceso espontáneo, el desorden total del sistema y de su entorno siempre aumenta” § Esto nos lleva a una nueva magnitud, que es también función de estado, llamada ENTROPÍA. § La entropía, desde un punto de vista microscópico, podríamos decir que mide el desorden del sistema (grado de desconocimiento de las propiedades del sistema).

ENTROPÍA § Cuando un sistema intercambia energía con su entorno, la variación de entropía depende del calor intercambiado y de la temperatura a la que ocurra el intercambio, así para un sistema reversible § Se producen espontáneamente los procesos en los que la S del Universo aumenta o no cambia: si la del sistema disminuye, la del entorno debe aumentar por lo menos lo mismo. ΔSuniv = Δ Ssist + Δ Salred > 0 (proceso espontáneo) Δ Suniv = Δ Ssist + Δ Salred = 0 (proceso en equilibrio)

ENTROPÍA Y ESPONTANEIDAD § § Si el sistema cede calor, la entropía del entorno aumenta El proceso será espontáneo si: § Aumenta la entropía del sistema, por ejemplo aumentando el nº de partículas. § O si aunque disminuya la entropía del sistema, esta es menor que el aumento del entorno. ΔSent>0 Proceso exotérmico § Si el sistema absorbe calor, la entropía del sistema aumenta y disminuye la del entorno y el sistema será espontáneo si en su conjunto la entropía del universo aumenta ΔSuniv = Δ Ssist + Δ Salred > 0 (proceso espontáneo) Q Q ΔSent<0 Proceso endotérmico

ENTROPÍA Y ESPONTANEIDAD § § Para predecir la espontaneidad de un proceso habrá que tener en cuenta la tendencia del sistema a pasar a un estado de mínima energía y máximo desorden. Y como ya se ha dicho: ΔSuniv = Δ Ssist + Δ Sent El calor ganado por el entorno es el mismo que el perdido por el sistema y como el entorno es mucho mayor que el sistema, se puede considerar que no se modifica su temperatura y el proceso es a T=cte para el entorno. Como la mayoría de los procesos ocurren a p=cte Q sist =ΔHsist

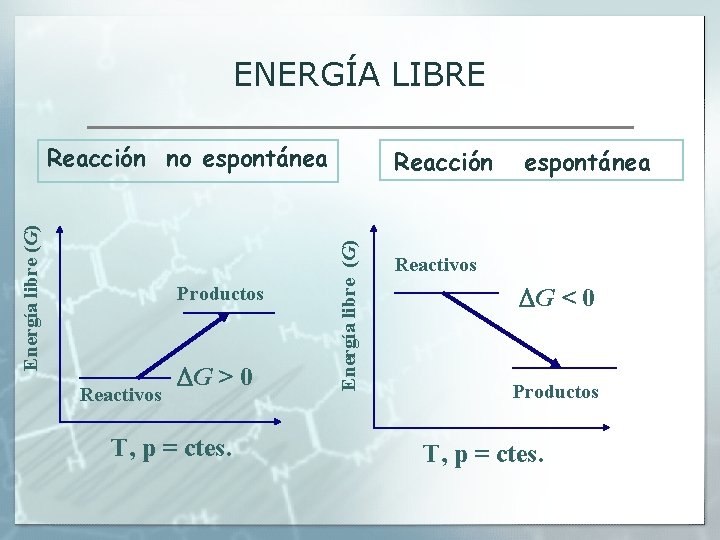
ENTROPÍA Y ESPONTANEIDAD § Esta expresión nos permite evaluar la espontaneidad del proceso, así si el proceso es espontáneo. Para facilitar las operaciones J. W. Gibbs definió una nueva función de estado denominada ENERGÍA LIBRE, G, que sería igual a G= H-TS → ΔG = ΔH –Δ(TS) y a T=cte → ΔG = ΔH –TΔS Luego para un proceso a T y p constantes ΔG< 0 proceso espontáneo ΔG> 0 proceso no espontáneo ΔG = 0 en equilibrio ΔG representa la parte de la energía total del sistema que se puede obtener de él (liberar).

ENERGÍA LIBRE Productos Reactivos G > 0 T, p = ctes. Reacción Energía libre (G) Reacción no espontánea Reactivos G < 0 Productos T, p = ctes.

ENERGÍA LIBRE § En las reacciones donde los términos entálpicos y entrópicos están enfrentados la temperatura influye mucho. § Una reacción puede ser espontánea a una temperatura pero no a otra. § A temperaturas bajas el valor absoluto de TΔS suele ser pequeño y por lo tanto ΔG ≈ ΔH y las reacciones exotérmicas suelen ser espontáneas y las endotérmicas no. § A temperaturas altas TΔS suele ser predominante y entonces ΔG ≈ -TΔS y por consiguiente son espontáneas las reacciones que implican un aumento del desorden como la descomposición.

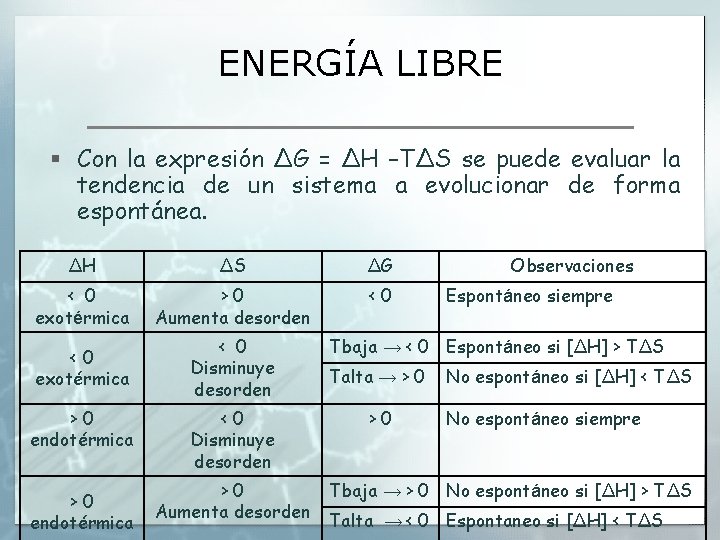
ENERGÍA LIBRE § Con la expresión ΔG = ΔH –TΔS se puede evaluar la tendencia de un sistema a evolucionar de forma espontánea. ΔH ΔS ΔG < 0 exotérmica >0 Aumenta desorden <0 <0 exotérmica < 0 Disminuye desorden >0 endotérmica <0 Disminuye desorden >0 Aumenta desorden Observaciones Espontáneo siempre Tbaja → < 0 Espontáneo si [ΔH] > TΔS Talta → > 0 >0 No espontáneo si [ΔH] < TΔS No espontáneo siempre Tbaja → > 0 No espontáneo si [ΔH] > TΔS Talta → < 0 Espontaneo si [ΔH] < TΔS

Calculo de ΔG de los procesos § Por ser G es una función de estado el incremento de energía libre de una reacción puede obtenerse a partir de Gf 0 de reactivos y productos: § G 0 = np x Gf 0(productos)– nr x Gf 0(reactivos) § Para cada sustancia se define la energía libre de formación estándar G 0 f, como la energía necesaria para formar un mol de compuesto a partir de sus elementos en su estado termodinámico más estable en condiciones estándar de p y T. § Por convenio la energía libre de formación de los elementos en su estado termodinámico más estable es cero. § El valor de G 0 f, es una medida de la estabilidad de un compuesto respecto a la descomposición en sus elementos. § G 0 f <0, compuesto estable § G 0 f >0, compesto inestable

Cálculo de ΔG en condiciones no estándar § Cuando los sistemas no están en condiciones estándar, se necesita un método para evaluar G en cualquier condición. Veamos como se hace a partir de la definición de energía libre. G = H – TS = U + p. V – TS § Para variaciones infinitesimales : § Por el primer principio de la termodinámica: § y de la definición de entropía: § Sustituyendo estas dos expresiones en la primera se tiene:

Cálculo de ΔG en condiciones no estándar § Si el proceso es a temperatura constante: § Para un gas ideal: § Se sustituye en la ecuación y se integra:

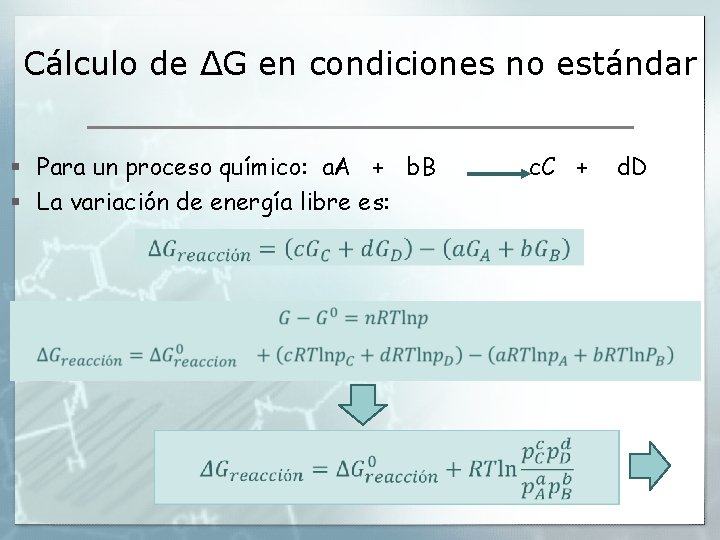
Cálculo de ΔG en condiciones no estándar § Para un proceso químico: a. A + b. B § La variación de energía libre es: c. C + d. D

Cálculo de ΔG en condiciones no estándar § Si llamamos cociente de la reacción Q a: § Relación que nos permite evaluar en que sentido evoluciona un sistema de forma espontánea, teniendo en cuenta su composición en un momento determinado.

Tercer principio de la termodinámica § Este principio estable que la entropía de una sustancia (elemento o compuesto) que se encuentra como cristal perfecto (perfectamente ordenado), 0 K, es cero § La entropía, por tanto, nunca es negativa ya que a cualquier otra temperatura la entropía será mayor que cero. § En igualdad de condiciones P, T, las S de los gases son mayores que las de los líquidos y estas a su vez mayores que las de los sólidos. § La entropía también depende del nº de enlaces de las moléculas. S(CO) < S(CO 2) y S(C 6 H 6) < S(C 6 H 12 ) Como la entropía es una función de estado ΔSº se calcula a partir de las Sºmolares. § ΔSºr = ∑n. PSº[P] - ∑n. RSº[R]

Tercer principio de la termodinámica § La entropía es una magnitud extensiva, depende de n. § La ΔS de un proceso es igual y de signo contrario a la ΔS del proceso inverso. § Lo que mas influye al determinar ΔS de un proceso es el aumento o disminución del nº de partículas gaseosas del sistema, si el nº de partículas de los productos es mayor que en los reactivos. § ΔS aumenta si: § § Se forman líquidos o disoluciones a partir de sólidos. Se forman gases a partir de líquidos. Al aumentar el nº de moléculas de gas (se rompen moléculas). Al aumentar la temperatura ya que significa un mayor nº de niveles de energía accesibles para el movimiento molecular (vibracional, rotacional y traslacional)
 Tercer principio de la termodinamica
Tercer principio de la termodinamica Segundo principio de la termodinámica
Segundo principio de la termodinámica Termodinamica
Termodinamica Termodinmica
Termodinmica Cuales son las propiedades de los gases
Cuales son las propiedades de los gases Termodinmica
Termodinmica Termodinmica
Termodinmica Calor en sistema ingles
Calor en sistema ingles Maquina de thomas newcomen
Maquina de thomas newcomen Termodinmica
Termodinmica Termodinmica
Termodinmica Termodinâmica
Termodinâmica Termodinmica
Termodinmica Calor y trabajo
Calor y trabajo Terceira lei da termodinâmica
Terceira lei da termodinâmica Termodynamika wzory
Termodynamika wzory Entropia residual
Entropia residual Funzioni di stato
Funzioni di stato Variacion entropia
Variacion entropia