Struttura degli anticorpi Gli anticorpi sono costituiti da










- Slides: 22

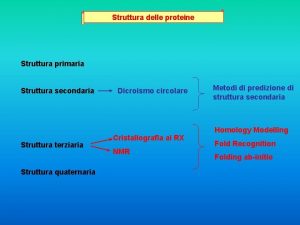
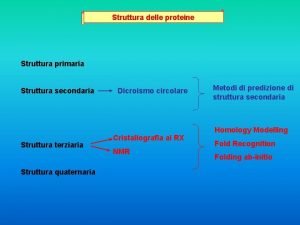
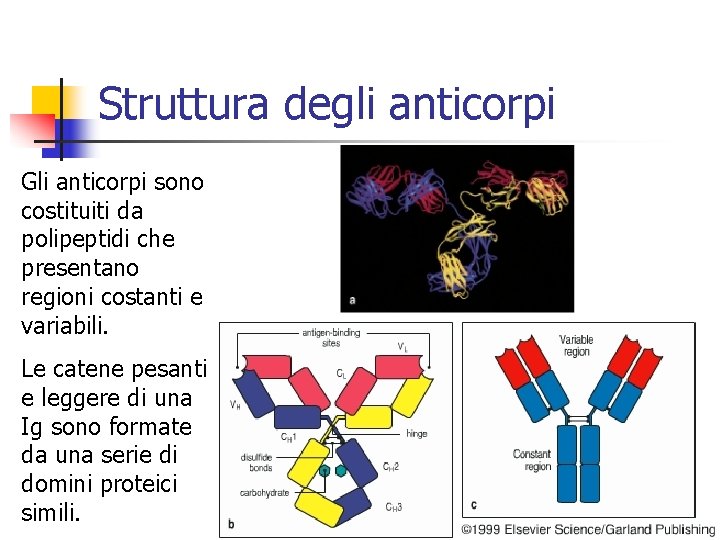
Struttura degli anticorpi Gli anticorpi sono costituiti da polipeptidi che presentano regioni costanti e variabili. Le catene pesanti e leggere di una Ig sono formate da una serie di domini proteici simili.

Gli anticorpi n Gli anticorpi sono glicoproteine che possiedono uno scheletro comune formato da quattro catene polipeptidiche. Questa unità di base consiste di due catene pesanti (H) identiche e due catene leggere (L) identiche ma più piccole, che sono assemblate in una struttura simile alla lettera Y dell’alfabeto

Gli anticorpi (continua) n n Ciascun braccio della Y è composto da una catena leggera completa appaiata con l’N-terminale ad una catena pesante, covalentemente legate tra loro da ponti disolfuro Il gambo della Y è formato dalle porzioni appaiate C-terminali delle due catene pesanti. Anche le catene pesanti sono unite tra loro da ponti disolfuro.

Gli anticorpi (continua) n n Tra differenti tipi di molecole anticorpali, le maggiori differenze in sequenza amminoacidica sono concentrate nelle regioni N-terminali delle catene H e L. Queste regioni prendono il nome di regioni variabili o V.

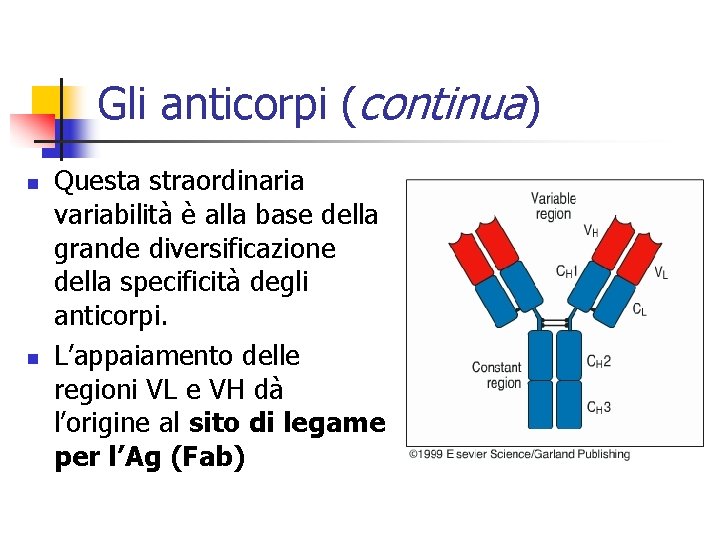
Gli anticorpi (continua) n n Questa straordinaria variabilità è alla base della grande diversificazione della specificità degli anticorpi. L’appaiamento delle regioni VL e VH dà l’origine al sito di legame per l’Ag (Fab)

Gli anticorpi (continua) n n Ogni molecola anticorpale a forma di Y possiede pertanto due identici siti di legame per l’Ag, uno è l’estremità di ciascun braccio. Le parti restanti della catena L ed H, presentano una variazione nella sequenza amminoacidica molto più limitata tra i differenti anticorpi, e per questo sono dette regioni costanti o C.

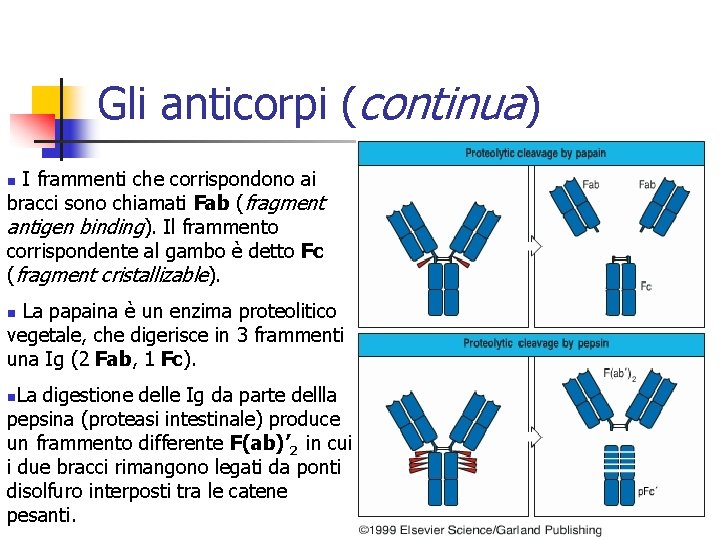
Gli anticorpi (continua) I frammenti che corrispondono ai bracci sono chiamati Fab (fragment antigen binding). Il frammento corrispondente al gambo è detto Fc (fragment cristallizable). n La papaina è un enzima proteolitico vegetale, che digerisce in 3 frammenti una Ig (2 Fab, 1 Fc). n La digestione delle Ig da parte dellla pepsina (proteasi intestinale) produce un frammento differente F(ab)’ 2 in cui i due bracci rimangono legati da ponti disolfuro interposti tra le catene pesanti. n

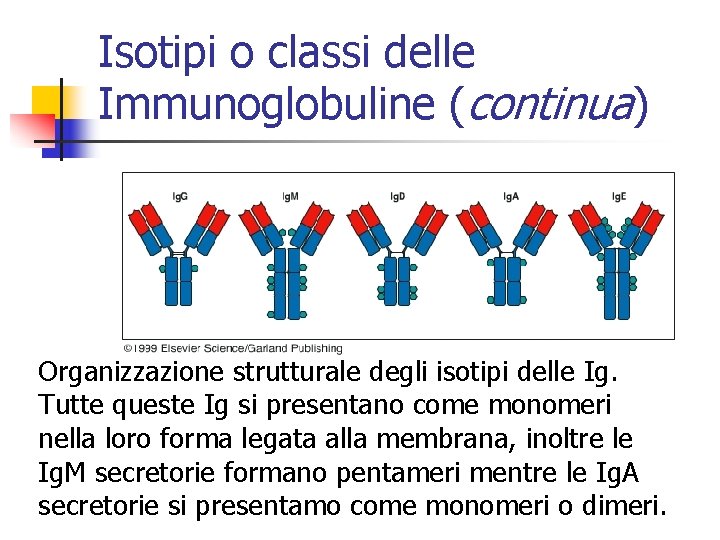
Isotipi o classi delle Immunoglobuline n 1. 2. 3. 4. 5. n n Le differenze osservabili nelle regioni C delle catene H definiscono 5 principali isotipi o classi delle Ig, ciscuna dotata di differente funzione nelle risposta immunitaria. Esse sono: Immunoglobulina A (Ig. A) Immunoglobulina D (Ig. D) Immunoglobulina E (Ig. E) Immunoglobulina G (Ig. G) Immunoglobulina M (Ig. M) Le loro catene pesanti vengono inodicate con le corrispondenti lettere greche minuscole: a, d, e, g, m Esistono solo 2 isotipi o classi di catena leggera: kappa (k) e lambda (l).

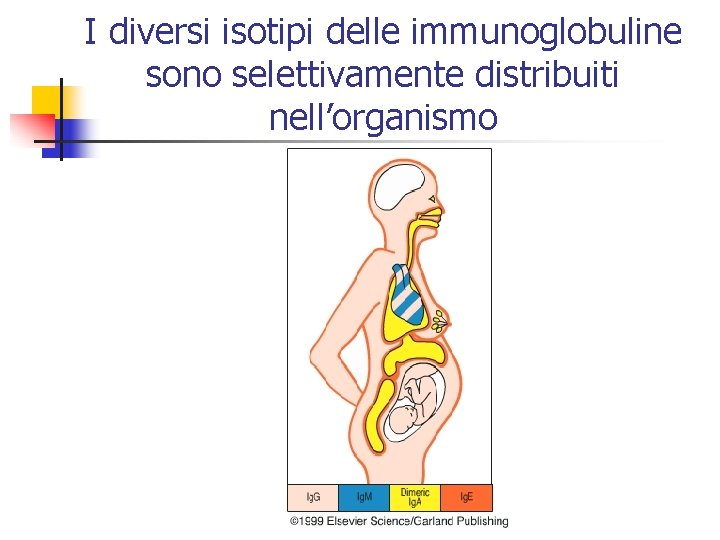
I diversi isotipi delle immunoglobuline sono selettivamente distribuiti nell’organismo

Isotipi o classi delle Immunoglobuline (continua) Organizzazione strutturale degli isotipi delle Ig. Tutte queste Ig si presentano come monomeri nella loro forma legata alla membrana, inoltre le Ig. M secretorie formano pentameri mentre le Ig. A secretorie si presentamo come monomeri o dimeri.

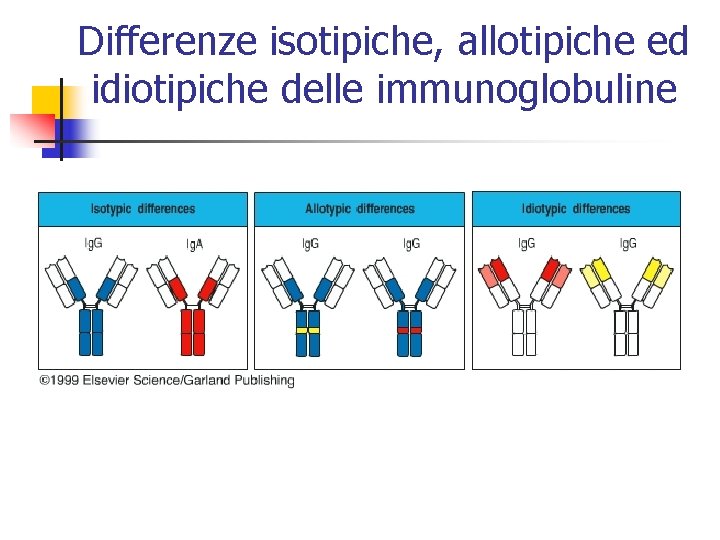
Differenze isotipiche, allotipiche ed idiotipiche delle immunoglobuline

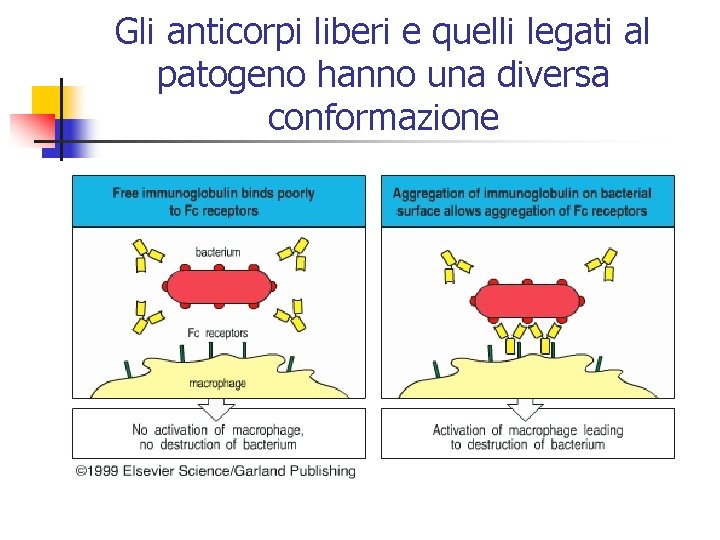
Gli anticorpi liberi e quelli legati al patogeno hanno una diversa conformazione

Domini delle Immunoglobuline n Le catene delle Ig sono ripiegate in domini proteici compatti e stabili. Ciascuna catena pesante e leggera, infatti, contiene una serie di motivi di sequenze omologhe, ogni singolo motivo è composto da 100 -110 amminoacidi disposti in tratti lineari e ripiegati in un dominio compatto ed eccezionalmente stabile, detto dominio della immunoglobulina.

Domini delle Immunoglobuline (continua) n n n La regione variabile N-terminale di ciascuna catena H ed L, è composta da un singolo dominio variabile (dominio V): VH nella catena pesante e VL nella catena leggera. Un dominio VH ed un dominio VL formano un sito di legame per l’antigene. Gli altri domini presentano una scarsa o nessuna variabilità di sequenza all’interno di un particolare isotipo, e vengono definiti domini costanti (dominio C). Essi formano le regioni costanti.

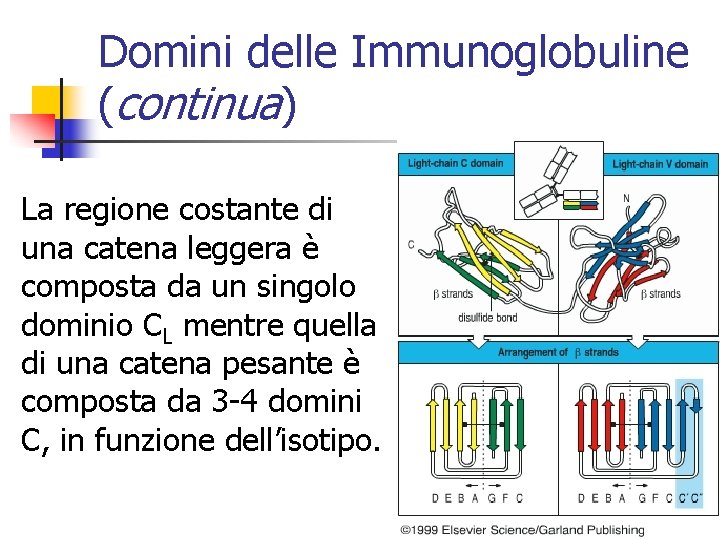
Domini delle Immunoglobuline (continua) La regione costante di una catena leggera è composta da un singolo dominio CL mentre quella di una catena pesante è composta da 3 -4 domini C, in funzione dell’isotipo.

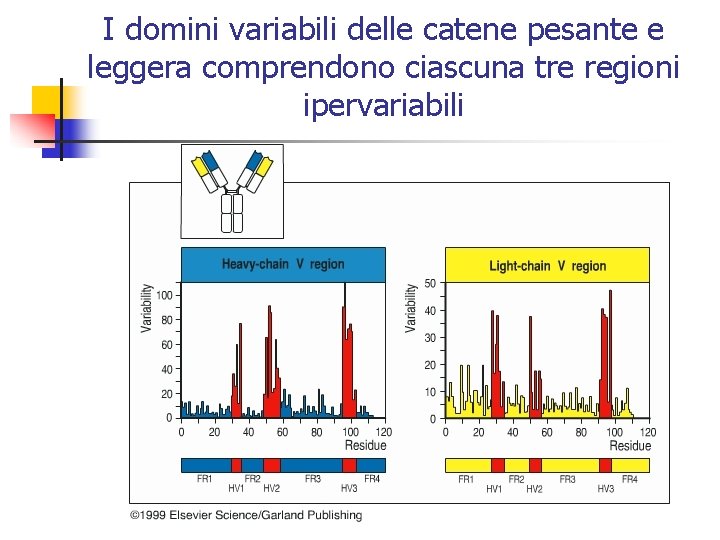
Regioni determinanti la complementarietà (CDRs) n Dal confronto fra i domini V delle catene pesanti e leggere di differenti molecole anticorpali è emerso che le diversità della sequenza amminoacidica sono concentrate a livello delle regioni dette ipervariabili (HV) affiancate dalle regioni cornice (regioni framework, FR) con struttura meno variabile.

Regioni determinanti la complementarietà (CDRs) (continua) n n n In ciascun dominio V esistono 3 regioni ipervariabili localizzate a livello delle 3 anse esposte all’estremità del dominio In una molecola anticorpale le differenze che esistono nelle anse di anticorpi diversi creano sia la specificità che la diversità del sito di legame per l’antigene. Le anse ipervariabili sono anche dette regioni determinanti la complementarietà (CDRs)

I domini variabili delle catene pesante e leggera comprendono ciascuna tre regioni ipervariabili

Funzioni e proprietà dei diversi isotipi immunoglobulinici n n Ciascun isotipo immunoglobulinico ha funzioni specializzate e proprietà distinte. Le funzioni maggiori sono mostrate in rosso (+++), le minori in rosa acceso (++), quelle di minor rilievo in rosa pallido (+)

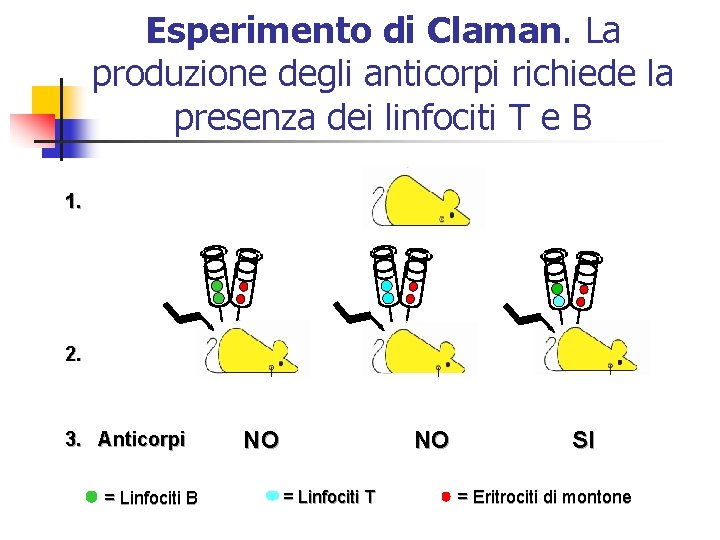
Esperimento di Claman. La produzione degli anticorpi richiede la presenza dei linfociti T e B 1. 2. 3. Anticorpi = Linfociti B NO NO = Linfociti T SI = Eritrociti di montone

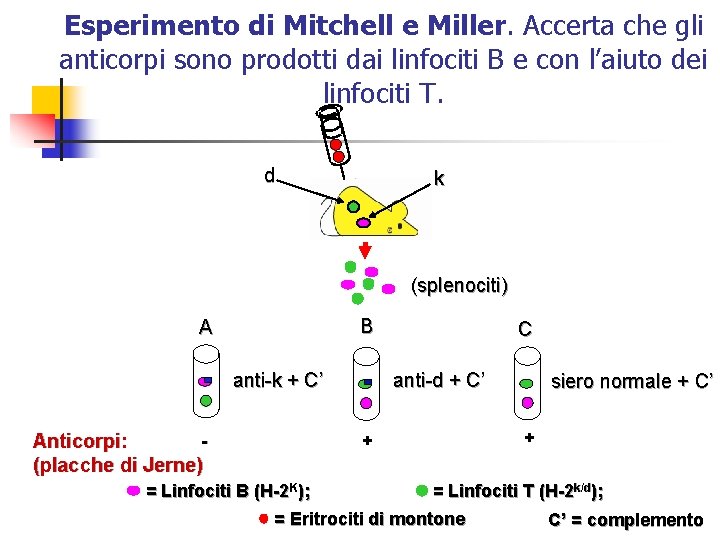
Esperimento di Mitchell e Miller. Accerta che gli anticorpi sono prodotti dai linfociti B e con l’aiuto dei linfociti T. d k (splenociti) B A anti-k + C’ Anticorpi: (placche di Jerne) C anti-d + C’ + + = Linfociti B (H-2 K); siero normale + C’ = Linfociti T (H-2 k/d); = Eritrociti di montone C’ = complemento

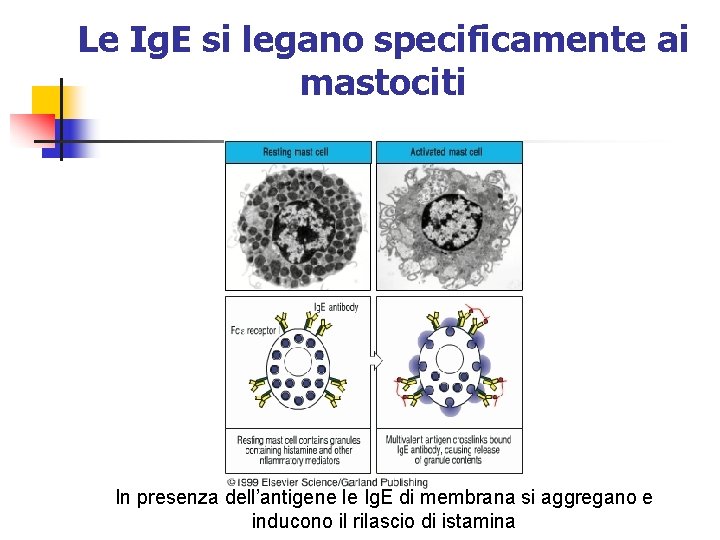
Le Ig. E si legano specificamente ai mastociti In presenza dell’antigene le Ig. E di membrana si aggregano e inducono il rilascio di istamina
 Geometria etimologia
Geometria etimologia Quali sono gli elementi fondamentali di uno stato
Quali sono gli elementi fondamentali di uno stato Artropodi invertebrati
Artropodi invertebrati Molti sono gli animali a cui s'ammoglia
Molti sono gli animali a cui s'ammoglia Cos'è l'aedo
Cos'è l'aedo Software autore della lim
Software autore della lim Gli aerofoni
Gli aerofoni In una scuola gli studenti sono stati divisi in tre gruppi
In una scuola gli studenti sono stati divisi in tre gruppi Pronomi interrogativi ed esclamativi
Pronomi interrogativi ed esclamativi Stili cognitivi schema
Stili cognitivi schema Effetto corona
Effetto corona Animali pluricellulari
Animali pluricellulari Errori morfosintattici esempi
Errori morfosintattici esempi Enti primitivi
Enti primitivi Affluenti po
Affluenti po Pronomi interrogativi esercizi
Pronomi interrogativi esercizi Esborsi di portineria
Esborsi di portineria Gli strumenti dello storico
Gli strumenti dello storico Chi sono gli incapaci assoluti
Chi sono gli incapaci assoluti Quali sono gli organi di garanzia costituzionale
Quali sono gli organi di garanzia costituzionale Incapacita naturale
Incapacita naturale Figura retorica sudate carte
Figura retorica sudate carte Linea gerarchica sicurezza
Linea gerarchica sicurezza