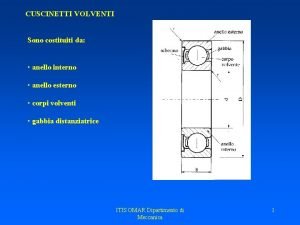
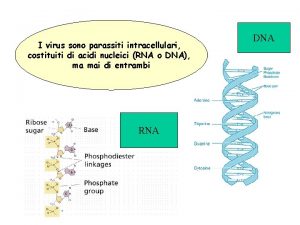
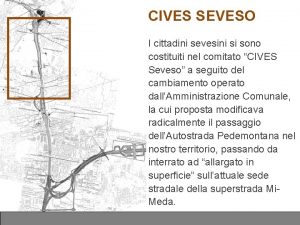
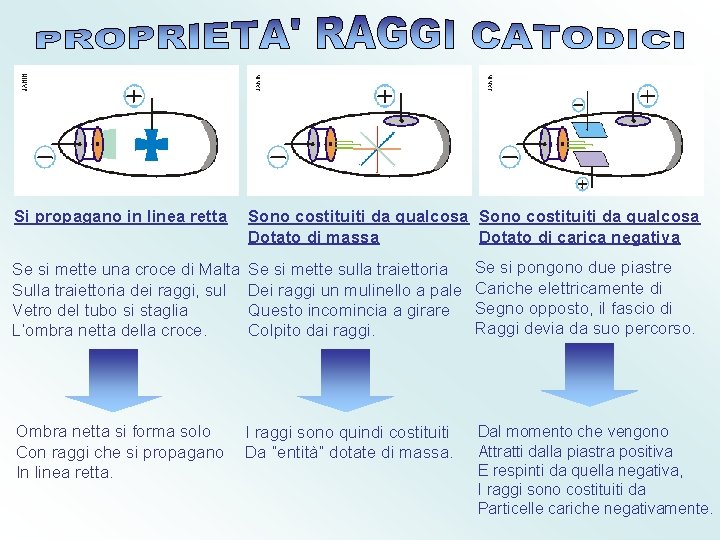
Si propagano in linea retta Sono costituiti da















- Slides: 23


Si propagano in linea retta Sono costituiti da qualcosa Dotato di massa Dotato di carica negativa Se si mette una croce di Malta Sulla traiettoria dei raggi, sul Vetro del tubo si staglia L’ombra netta della croce. Se si mette sulla traiettoria Dei raggi un mulinello a pale Questo incomincia a girare Colpito dai raggi. Se si pongono due piastre Cariche elettricamente di Segno opposto, il fascio di Raggi devia da suo percorso. Ombra netta si forma solo Con raggi che si propagano In linea retta. I raggi sono quindi costituiti Da “entità” dotate di massa. Dal momento che vengono Attratti dalla piastra positiva E respinti da quella negativa, I raggi sono costituiti da Particelle cariche negativamente.

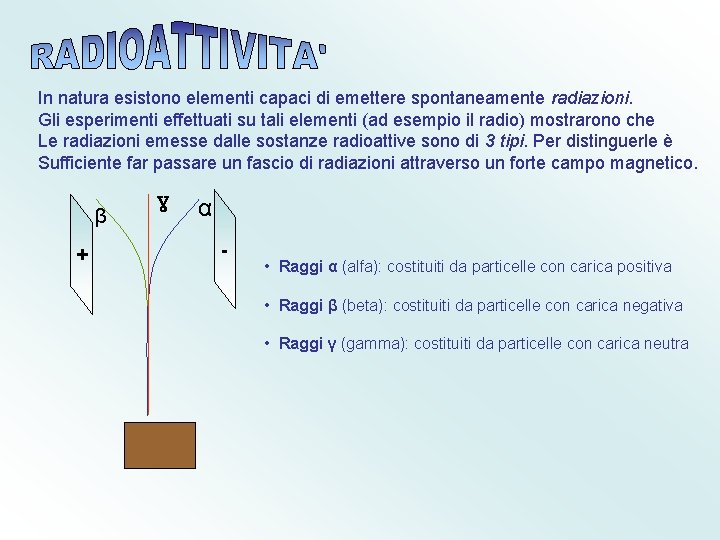
In natura esistono elementi capaci di emettere spontaneamente radiazioni. Gli esperimenti effettuati su tali elementi (ad esempio il radio) mostrarono che Le radiazioni emesse dalle sostanze radioattive sono di 3 tipi. Per distinguerle è Sufficiente far passare un fascio di radiazioni attraverso un forte campo magnetico. β + γ α - • Raggi α (alfa): costituiti da particelle con carica positiva • Raggi β (beta): costituiti da particelle con carica negativa • Raggi γ (gamma): costituiti da particelle con carica neutra

Queste scoperte cambiarono radicalmente l’immagine dell’atomo, perché: • ESISTONO PARTICELLE PIU’ PICCOLE DELL’ATOMO Perciò l’atomo non è il più piccolo costituente della materia • ALCUNI ATOMI POSSONO EMETTERE PARTICELLE Ciò dimostra che gli atomi contengono particelle più piccole al loro interno, quindi hanno una struttura complessa • LE PARTICELLE EMESSE SONO DOTATE DI CARICA ELETTRICA Ciò dimostra che l’elettricità è una caratteristica della materia Inoltre, dato che l’atomo è normalmente neutro, è evidente che, All’interno dell’atomo, cariche positive e negative devono bilanciarsi.

Stabilito che l’atomo è costituito da particelle Più piccole si poneva il problema di come Fossero organizzate queste particelle. Per questo motivo Nascono i primi 1899 MODELLO DI THOMSON 1913 MODELLO DI BOHR 1911 MODELLO DI RUTHERFORD 1925 MODELLO DI SCHRODINGER

Clicca sul pulsante per la sintesi dei 4 modelli Il modello atomico oggi riconosciuto valido è il frutto di una lunga serie di teorie che si sono succedute a partire dal 1899. Il primo modello proposto, quello di Thomson , prevedeva che gli elettroni fossero distribuiti Questa tabella il processo evolutivocomprese avvenuto nello studio dei modelli uniformemente in unariassume sfera positivamente carica. Rutherford invece che la carica positiva doveva essere concentrata al centro dell’atomo (nel nucleo), e gli elettroni orbitare nello spazio circostante. Bhor andò Atomici. Ora prenderemo in esame ciascuno di questi. oltre, introducendo il concetto di quantizzazione delle orbite elettroniche; Schrodinger, infine, rivoluzionò l’idea di orbita elettronica intendendola non più come la traiettoria fisicamente percorsa dall’elettrone, ma come regione dello spazio che possiede la più alta probabilità di essere occupata dall’elettrone.

Thomsom, basandosi su una vecchia idea di Lord Kevin, ipotizzò che l’atomo avesse una struttura omogenea, con la massa e la carica positiva distribuite omogeneamente in tutto lo spazio dell’atomo, e gli elettroni inserite all’interno come particelle individuali distribuite in modo uniforme. Questo modello non fu però ritenuto valido dalle prove sperimentali condotte Da Rutherford, Geiger e Marsden.

Ernest Rutherford compì esperimenti di diffusione di particelle α su atomi di oro E concluse che in un atomo la carica positiva e quella negativa non possono Essere distribuite in modo uniforme, come previsto dal modello di Thomson. Egli Propose quindi che la carica positiva, come la maggior parte della massa, si trovi Concentrata in uno spazio ridotto al centro dell’atomo (il nucleo) e che gli elettroni Vi ruotino intorno come i pianeti intorno al sole. Clicca qui per le immagini dell’esperimento

Giunti alla conclusione che l’atomo è costituito da un nucleo, nel quale sono Concentrate la masse e la carica positiva, e dagli elettroni che si trovano intorno Al nucleo e occupano la quasi totalità del volume dell’atomo, possiamo soffermarci Sul cuore dell’atomo, cioè il nucleo e i suoi componenti. PARTICELLE CARICA MASSA In unità di e In u. m. a. Protoni +1 1 Neutroni 0 1 Elettroni -1 1/1836 Clicca qui per visualizzare video con commento audio sulle particelle subatomiche

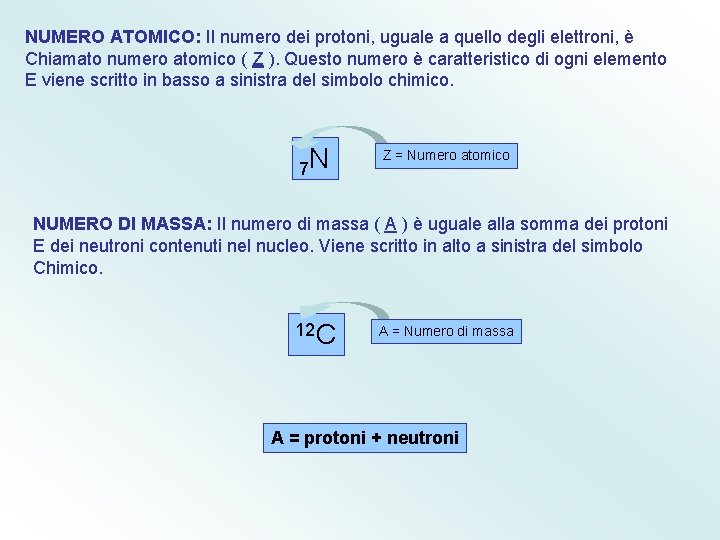
NUMERO ATOMICO: Il numero dei protoni, uguale a quello degli elettroni, è Chiamato numero atomico ( Z ). Questo numero è caratteristico di ogni elemento E viene scritto in basso a sinistra del simbolo chimico. 7 N Z = Numero atomico NUMERO DI MASSA: Il numero di massa ( A ) è uguale alla somma dei protoni E dei neutroni contenuti nel nucleo. Viene scritto in alto a sinistra del simbolo Chimico. 12 C A = Numero di massa A = protoni + neutroni

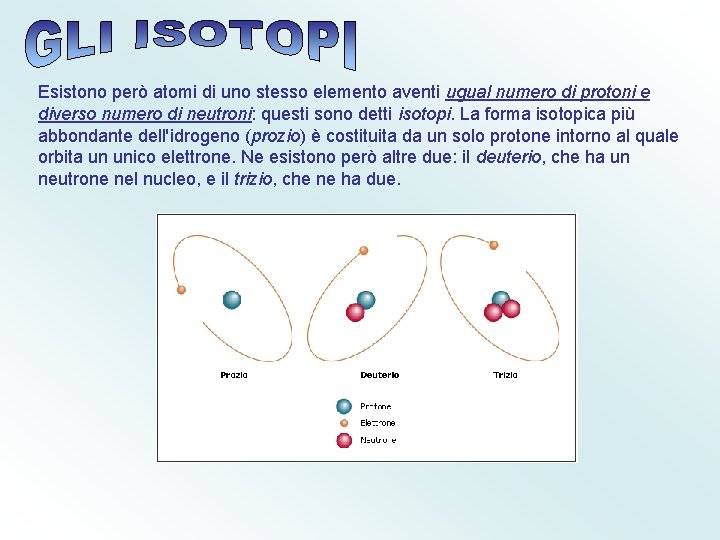
Esistono però atomi di uno stesso elemento aventi ugual numero di protoni e diverso numero di neutroni: questi sono detti isotopi. La forma isotopica più abbondante dell'idrogeno (prozio) è costituita da un solo protone intorno al quale orbita un unico elettrone. Ne esistono però altre due: il deuterio, che ha un neutrone nel nucleo, e il trizio, che ne ha due.

Da quanto visto fin ora, ci si può rendere conto di come il comportamento delle Particelle del mondo microscopico non risultava in accordo con le leggi della Fisica classica. Secondo queste leggi l’atomo, così come lo aveva ipotizzato Rutherford, non sarebbe potuto esistere. Infatti nucleo ed elettroni hanno carica Di segno opposto, e particelle con carica di segno opposto si attirano. In altre Parole, secondo le leggi della fisica classica, gli elettroni dovrebbero andare Tutti a cadere sul nucleo emettendo energia per tutta la durata del suo moto. Questo però non avviene: gli atomi esistono, con i loro elettroni ben distanti dal nucleo - + En g er ia Era perciò necessario, per descrivere il comportamento degli elettroni, creare un Nuovo modello, una nuova fisica.

RADIAZIONE ELETTROMAGNETICA Fenomeno particellare o ondulatorio? E = mc 2 E = h frequenza (Hz o s-1) lunghezza d’onda 1/ numero d’onda

Onda elettromagnetica

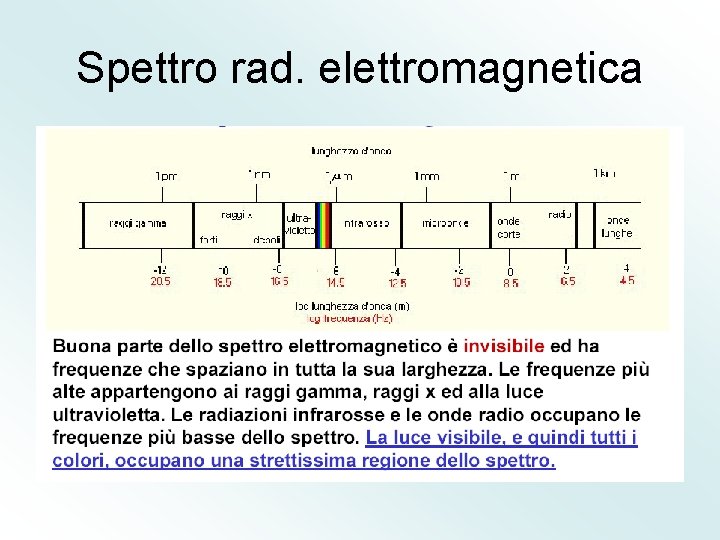
Spettro rad. elettromagnetica

Radiazione visibile • Un corpo ci appare colorato perché trasmette o riflette la radiazione “complementare”

Un altro fenomeno che non poteva essere spiegato sulle basi della fisica classica Era quello degli spettri. Gli atomi, infatti, in particolari condizioni, possono emettere Energia sotto forma di radiazione elettromagnetica. Atomi di elementi diversi emettono radiazioni diverse (aventi diversi valori di Lunghezza d’onda, frequenza ed energia). L’insieme delle radiazioni emesse dagli atomi di un elemento è detto spettro di Emissione (o spettro atomico). La luce bianca è un esempio di spettro continuo. Essa infatti è Costituita da sette colori (rosso, arancio, giallo, verde, azzurro, Indaco, violetto) che presentano un passaggio graduale dall’uno All’altro, senza interruzioni. Gli spettri atomici hanno una caratteristica particolare: Essi non sono continui, ma Discreti, cioè non presentano un passaggio graduale da attraverso i vari valori di Energia (o di frequenza), ma delle righe nette, corrispondenti a ben definiti valori di Energia. Ciò significa che un atomo può emettere soltanto radiazioni con valori di Energia specifici e suoi caratteristici.

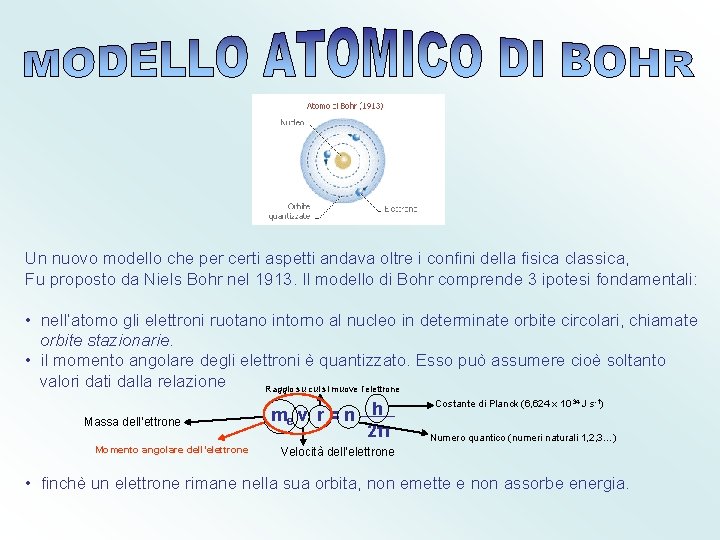
Un nuovo modello che per certi aspetti andava oltre i confini della fisica classica, Fu proposto da Niels Bohr nel 1913. Il modello di Bohr comprende 3 ipotesi fondamentali: • nell’atomo gli elettroni ruotano intorno al nucleo in determinate orbite circolari, chiamate orbite stazionarie. • il momento angolare degli elettroni è quantizzato. Esso può assumere cioè soltanto valori dati dalla relazione Raggio su cui si muove l’elettrone Massa dell’ettrone Momento angolare dell’elettrone me v r = n h 2π Costante di Planck (6, 624 x 10 -34 J s-1) Numero quantico (numeri naturali 1, 2, 3…) Velocità dell’elettrone • finchè un elettrone rimane nella sua orbita, non emette e non assorbe energia.

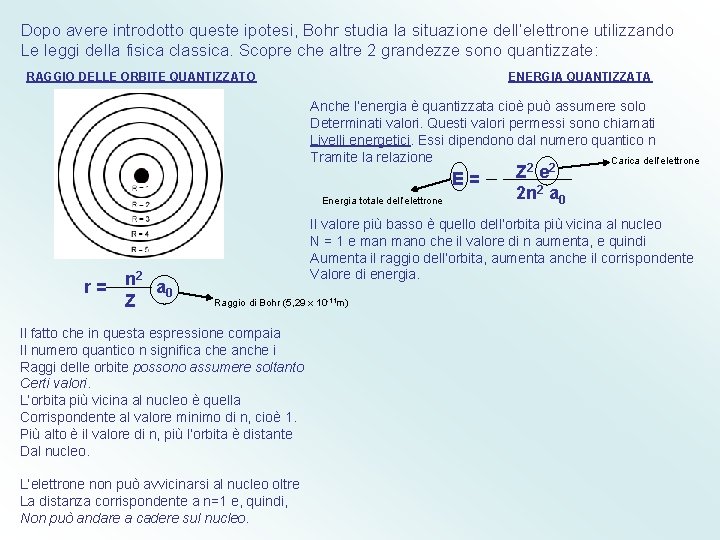
Dopo avere introdotto queste ipotesi, Bohr studia la situazione dell’elettrone utilizzando Le leggi della fisica classica. Scopre che altre 2 grandezze sono quantizzate: RAGGIO DELLE ORBITE QUANTIZZATO ENERGIA QUANTIZZATA Anche l’energia è quantizzata cioè può assumere solo Determinati valori. Questi valori permessi sono chiamati Livelli energetici. Essi dipendono dal numero quantico n Tramite la relazione Carica dell’elettrone E= Energia totale dell’elettrone r= n 2 a 0 Z Z 2 e 2 2 n 2 a 0 Il valore più basso è quello dell’orbita più vicina al nucleo N = 1 e mano che il valore di n aumenta, e quindi Aumenta il raggio dell’orbita, aumenta anche il corrispondente Valore di energia. Raggio di Bohr (5, 29 x 10 -11 m) Il fatto che in questa espressione compaia Il numero quantico n significa che anche i Raggi delle orbite possono assumere soltanto Certi valori. L’orbita più vicina al nucleo è quella Corrispondente al valore minimo di n, cioè 1. Più alto è il valore di n, più l’orbita è distante Dal nucleo. L’elettrone non può avvicinarsi al nucleo oltre La distanza corrispondente a n=1 e, quindi, Non può andare a cadere sul nucleo.

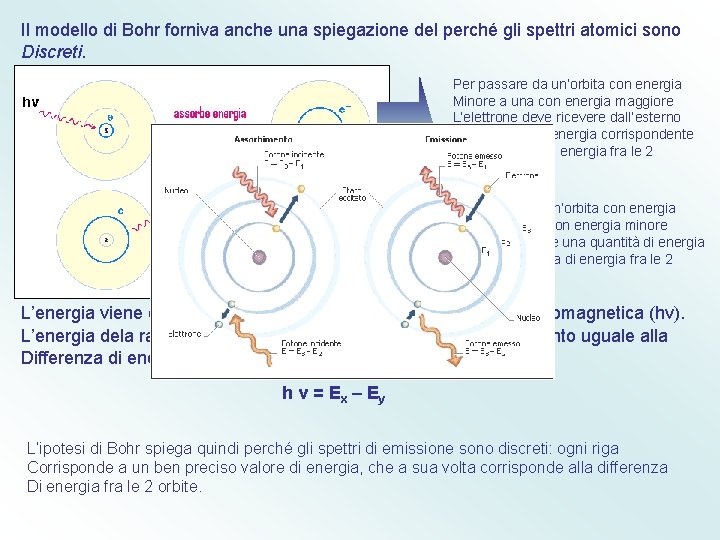
Il modello di Bohr forniva anche una spiegazione del perché gli spettri atomici sono Discreti. Per passare da un’orbita con energia Minore a una con energia maggiore L’elettrone deve ricevere dall’esterno Una quantità di energia corrispondente Alla differenza di energia fra le 2 Orbite. Per passare da un’orbita con energia Maggiore a una con energia minore L’elettrone emette una quantità di energia pari alla differenza di energia fra le 2 Orbite. L’energia viene emessa o assorbita sotto forma di radiazione elettromagnetica (hv). L’energia dela radiazione emessa o assorbita dall’elettrone è pertanto uguale alla Differenza di energia delle 2 orbite interessate, cioè h v = E x – Ey L’ipotesi di Bohr spiega quindi perché gli spettri di emissione sono discreti: ogni riga Corrisponde a un ben preciso valore di energia, che a sua volta corrisponde alla differenza Di energia fra le 2 orbite.

Alcuni anni dopo che Bohr aveva proposto il suo modello, vennero fatte 2 scoperte Destinate a cambiare la nostra visione dell’atomo. IL PRINCIPIO DI INDETERMINAZIONE DI HEISENBERG Consiste nell’impossibilità teorica di determinare contemporaneamente e con precisione arbitraria due parametri fisici importanti di una particella (l’elettrone) quali sono la posizione spaziale e la quantità di moto. LA DOPPIA NATURA DELL’ELETTRONE La teoria, introdotta da De Broglie, muoveva dalla considerazione che, così come la radiazione elettromagnetica manifestava, nell’ambito di alcuni fenomeni fisici, caratteristiche tipicamente corpuscolari, anche le particelle – e in particolare gli elettroni - potessero presentare caratteristiche ondulatorie. Δ x · Δp ≥ h 4π La quantità di moto è una grandezza legata all’energia Cinetica, quindi un’incertezza nella determinazione Della quantità di moto implica un’incertezza anche Nella determinazione dell’energia della particella. Lunghezza d’onda, Proprietà tipica di Un’onda λ= h mv Quantità di moto, Tipica delle particelle A ciascun corpo in movimento è associata Una lunghezza d’onda

Il principio di indeterminazione di Heisenberg e la scoperta della doppia natura Dell’elettrone indicavano chiaramente che non era più possibile trattare quest’ultimo Come una particella classica (come aveva fatto Bohr). Ciò portò all’elaborazione di Una nuova fisica, la meccanica quantistica. Il fulcro della meccanica quantistica è l’equazione di Schrödinger che applicata al sistema di elettroni all'interno dell'atomo, consente una precisa valutazione delle orbite e il calcolo dei livelli energetici. Operatore dell’energia o hamiltoniano È costituito dai vari contributi all’energia Del sistema considerato Funzione d’onda HΨ = E Ψ Valore di energia del sistema considerato Risolvendo l’equazione di Schrödinger è possibile individuare le regioni dello spazio In cui la probabilità di trovare l’elettrone è massima. Tali regioni sono dette orbitali. Secondo questo modello gli elettroni non occupano più delle posizioni fisse e determinate come Nel caso delle orbite di Bohr; gli elettroni possono trovarsi anche in regioni diverse dagli orbitali, Ma la probabilità che questo si verifichi è minima.

FINE
 Iperbole equilatera traslata
Iperbole equilatera traslata Coefficiente angolare retta passante per due punti
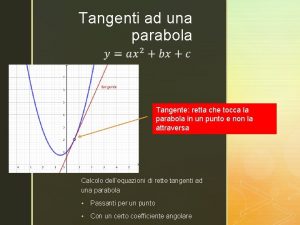
Coefficiente angolare retta passante per due punti Retta tangente ad una parabola
Retta tangente ad una parabola Concetto primitivo
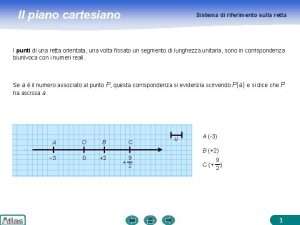
Concetto primitivo Mappe concettuali piano cartesiano
Mappe concettuali piano cartesiano Distanza da un punto ad una retta
Distanza da un punto ad una retta Slidetodoc
Slidetodoc Significato geometrico della derivata
Significato geometrico della derivata Punti linee e piani nello spazio
Punti linee e piani nello spazio Bisettrice primo e terzo quadrante coefficiente angolare
Bisettrice primo e terzo quadrante coefficiente angolare Calcolo pendenza
Calcolo pendenza Esercizi su piano cartesiano e retta
Esercizi su piano cartesiano e retta Mappa piano cartesiano
Mappa piano cartesiano Retta esterna alla parabola
Retta esterna alla parabola Esercizi sulla retta nel piano cartesiano zanichelli
Esercizi sulla retta nel piano cartesiano zanichelli Angoli interni di un poligono
Angoli interni di un poligono Distanza punto retta
Distanza punto retta Una piramide retta ha per base un rombo
Una piramide retta ha per base un rombo Distanza tra due punti sulla stessa retta
Distanza tra due punti sulla stessa retta Numeri relativi esercizi
Numeri relativi esercizi Prisma regolare triangolare
Prisma regolare triangolare Numeri relativi concordi
Numeri relativi concordi Assioma di partizione del piano da parte di una retta
Assioma di partizione del piano da parte di una retta Retta orientata frazioni
Retta orientata frazioni